超声、CT引导下射频消融治疗肝恶性肿瘤的临床疗效
2022-08-26王亮亮吴广迎
肝恶性肿瘤发病隐匿,进展迅速,早期无明显症状,多数患者在发现时已经是中晚期,已失去手术根治机会。随着微创介入治疗技术的发展,影像引导下的射频消融治疗在肿瘤临床得到广泛应用。射频消融术(RFA)是在影像学设备(超声、CT等)引导下,通过热效应造成肿瘤组织坏死,从而达到治疗目的,安全性高,且疗效较好
。但有临床发现,超声、CT由于设备的局限性,可存在死角、盲区,难以显示肿瘤特殊部位或微小组织,从而降低RFA治疗效果
。本研究探讨分别采用超声、CT引导肝恶性肿瘤RFA的治疗效果,现报道如下。
施工场地狭小,四周全是高大建筑物,基坑南侧距大同市古城墙14 m,西侧距3座砖混结构的住宅楼15 m,东侧距两座砖混结构住宅楼20 m,北侧距雁同东路30 m。
1 资料与方法
1.1 一般资料 回顾分析2017年6月至2020年6月收治的126例肝恶性肿瘤患者,按RFA不同的引导方式分组研究,对照组患者63例,男40例,女23例,年龄37~70岁,平均(53.51±10.49)岁,共有病灶77个,单发51例,多发12例。观察组患者63例,男43例,女20例,年龄40~72岁,平均(56.08±10.71)岁,病灶共有80个,单发50例,多发13例。两组患者的一般资料方面比较差异无统计学意义(
>0.05)。
1.2 纳入及排除标准 纳入标准:①经影像学、病理等确诊为肝恶性肿瘤;②均行RFA治疗;③多发肿瘤数目≤3个,单发肿瘤最大直径≤5 cm;④肝功能Child-Pugh分级A、B级;⑤患者及家属对本研究知情并签署知情同意书。
排除标准:①门静脉癌栓形成者;②合并严重凝血功能障碍者;③肿瘤巨大者(直径>5 cm);④合并严重感染者;⑤预期生存期少于半年者。
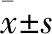
于是,我爬了墙,这一招我练习了很久,终于等到这一天,刘佳没有锁窗户,真是太好了。他睡得正香,嘴边流了一丝口水,我把窗帘拉开,朦胧的月光让躺着的刘佳看起来像一个睡王子,我傻乎乎地看着睡着了。
1.4 观察与评价指标 随访1个月复查,用增强MRI扫描评估肿瘤消融及残留情况,术后并发症等,比较两组患者的治疗效果、肝功能指标等。治疗前、治疗后1个月,空腹抽取静脉血检测肝功能,包括甲胎蛋白(AFP)水平、天门冬氨酸氨基转移酶(AST)、血浆白蛋白(Alb)、丙氨酸氨基转移酶(ALT)、血清总胆红素(TBil)等。
2.1 两组患者肝功能指标水平比较 治疗前,两组患者的肝功能指标水平比较差异均无统计学意义(
>0.05),治疗后3个月,各项肝功能指标与治疗前比较差异有统计学意义(
<0.05),治疗后两组患者各项肝功能指标比较差异无统计学意义(
>0.05),见表1。
2.2 治疗效果比较 随访3个月,观察组患者治疗总有效率显著高于对照组(
<0.01),见表2。
1.3 研究方法 对照组患者采用飞利浦HD3彩色超声诊断仪行常规超声检查,明确肿瘤的位置、大小、数量、解剖结构等,使用美国RI-TA1500X射频消融仪及RITA Starburst XL多极电极针进行治疗,患者取仰卧位,行局部麻醉,确定进针入路和穿刺点,常规消毒铺巾,超声引导下,把消融针刺入肿瘤组织,打开子针,确定有效消融体积后给予热消融
。在此过程中,根据肿瘤病灶的位置、大小等情况决定射频治疗次数,以保障消融效果。
2 结果
疗效判定标准:完全缓解(CR),MRI检查未见肿瘤。部分缓解(PR),与治疗前比较,肿瘤体积减少>50%,且无新病灶出现。稳定(SD),与治疗前比较,肿瘤体积减少<50%。恶化(PD),与治疗前比较,肿瘤体积增大≥25%。治疗总有效率=(完全缓解+部分缓解)/n×100%。

在完成品牌定位设计以及相应的品牌传播和推广活动后,图书馆还是需要密切注意读者对品牌定位的反映,并根据读者的反映进行适当的调整,使品牌定位更贴合读者的需求。
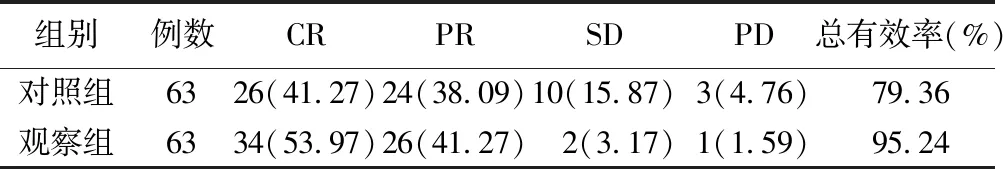
2.3 并发症发生情况比较 见表3。
观察组患者采用CT引导,采用德国西门子16排螺旋CT扫描仪进行扫描,参数设置:管电压130 kV、管电流150 mA、层厚5 mm。CT实时引导,明确肿瘤病灶大小、解剖结构等,消融针刺入肿瘤组织中,打开子针,再行CT平扫获得平扫图像,之后经桡静脉用高压注射器注入碘帕醇,输注速度为2.5 ml/s,注射时间为25 s,行增强CT扫描,对比剂注射完成后的35 s、70 s、180 s分别获取动脉期、静脉期、延迟期图像。观察射频针位置并适度调整,确定有效的消融体积后行射频消融治疗,在此过程中,消融针发热点应保持在病灶中央,完成消融后,再次行增强CT扫描,观察消融区周边,若有异常强化灶,则表示肿瘤病灶仍有残留,需再补充消融治疗。在CT引导过程中,每次进针时,适当调整各项参数,消融治疗应遵循由远及近的原则,采用多点布针、适形消融、多针重叠等方法,结束后,拔出消融针。术后均给予患者保肝、抗感染等综合治疗
。
他给《中国医院院长》杂志记者的名片上,已经印着自己在宁波一院出诊的信息。“社区医院主要以常见病为主,而在宁波一院遇到的病种多、病情急、病情复杂。这样的锻炼,扩展临床思维,积累临床经验”。
3 讨论
目前肝恶性肿瘤治疗方法较多,包括手术切除、肝移植、放化疗等,大量临床证实,射频消融在治疗肿瘤直径<5 cm的恶性肝肿瘤取得显著疗效,且具有创伤小、可重复操作、安全性高、并发症少、疗效佳等优势
。谢璐璐等
研究发现,RFA治疗肝恶性肿瘤中虽然疗效较好,但仍存在很多问题,如消融不彻底、应用于大肝癌疗效不佳、局部复发率高等。RFA是一种热消融治疗方法,在影像学引导下可清晰显示病灶位置、数量、大小、结构等具体情况,从而有利于消融精准性,目前,RFA已成为小肝癌的主要治疗手段。张曼等
研究证实,单发且直径不超过5 cm的肝恶性肿瘤患者,采用RFA其治疗效果堪比手术切除效果。临床上,RFA的影像学引导主要采用超声或CT,但由于设备自身的局限性,往往存在一定的不足,尤其是肿瘤特殊部位、微小病灶等方面难以清晰显示
。
本研究结果提示,经过3个月的随访复查,CT引导的观察组治疗总有效率(95.24%)明显高于超声引导的对照组(79.63%),两组术后均出现有肝区疼痛、发热、恶心呕吐等并发症,但两组并发症发生率并无显著性差异,结果说明,CT引导下行RFA治疗肝恶性肿瘤可有效提高治疗效果,且不增加并发症的发生,具有很高的安全性和有效性。李丽珍等
认为,超声引导下可实时观察RFA干预针的走行、位置,并可随时进行调整,具有实时动态监测、操作方便、费用低、可重复等优势,但也存在明显不足,如难以清晰显示较小等回声病灶;超声图像与肿瘤组织有差异,影响消融精准性;无法显示特殊位置病灶;组织内水分气化出现气泡干扰大,导致超声图像中肿瘤边界模糊等因素影响下,可能降低治疗效果。孙文杰等
研究表明,CT引导虽然具有扫描范围大、定位精准、图像清晰等优势,但也存在一定的不足,如需反复多次扫描,延长了治疗时间,不能实时动态观察穿刺及消融过程,可能会损伤肿瘤周围的血管、胆管等。大量研究证实,肝恶性肿瘤RFA治疗采用超声、CT引导,各具优势与不足,超声可实时监测,但CT显像更清晰,能够准确显示肿瘤具有情况,精准测出病灶距脏器、血管的距离,减少布针和消融参数误差,最大限度消除干扰因素,消融后又立即行增强CT检查,一旦发现残留病灶,则立即进行补充消融治疗,从而提高消融效果
。
冰面消失对海洋生态系统也将带来巨变。海洋浮游植物是所有海洋生物赖以生存的食物链的基础和重要环节,在此之前人们一直认为北冰洋海区的浮游植物只有在夏季冰面融化之后才会生长繁殖,而现在科学家们认识到,由于全球变暖导致海冰冰层变薄,原本不透光的冰层已经开始变得可以通过光线,这一变化造就了这里海水中浮游植物的生长,这会对北冰洋食物链上的高级海洋生物带来影响。
本研究分别对治疗前后肝功能指标进行检测发现,治疗后3个月,两组患者的AFP、TBil、AST、Alb、ALT等指标水平均明显改善,但两组各项指标比较也无明显差异,说明B超、CT引导下的肝恶性肿瘤RFA对肝功能的影响差别不大。AFP是主要肿瘤标志物之一,与多种肿瘤的发生发展存在密切相关性,目前,已成为多种肿瘤的阳性检测指标
。AFP是原发性肝癌的血清标志物,可有效诊断原发性肝癌,AFP水平升高则提示肿瘤局部增生处于活跃状态,可监测肝恶性肿瘤的疗效
。本研究中,与治疗前相比较,治疗后两组患者的AFP水平均明显降低,说明RFA取得显著效果。
综上所述,超声、CT引导下行射频消融治疗肝恶性肿瘤,可有效提高消融精准性,缩短治疗时间,降低肿瘤局部复发率,提高治疗效果。
[1] 吴林霖,施一翔,刘敬禹,等.超声引导与CT引导原发性肝癌射频消融对比分析[J].介入放射学杂志,2019,28(12):46-50.
[2] 林淑芝,徐倩,武金玉,等.超声引导下经皮射频消融治疗恶性肿瘤肝转移[J].中国介入影像与治疗学,2018,15(1):29-32.
[3] 林淑芝,徐倩,武金玉,等.超声引导下经皮射频消融治疗恶性肿瘤肝转移[J].中国介入影像与治疗学,2018,15(1):29-32.
[4] 周洪珍,张涛,李虹.超声造影在肝脏残留复发性恶性肿瘤射频消融中的应用[J].中国肿瘤临床与康复,2017,24(11):1313-1316.
[5] 司贮元,朱化强,高恒军,等.超声与CT引导下射频消融治疗早期肝细胞癌效果比较[J].中华肝胆外科杂志,2020,26(6):417-421.
[6] 谢璐璐,廖锦堂,李悦怡,等.肝脏恶性肿瘤射频消融术后即刻超声造影的临床价值[J].中国普通外科杂志,2017,26(2):228.
[7] 张曼,李凯,苏中振,等.融合成像技术辅助普通超声显示困难的肝恶性肿瘤射频消融的应用价值[J].中华超声影像学杂志,2016,25(8):691-695.
[8] Xiang Z J,Wang Y,Du EF,
. The value of Cone-Beam CT-guided radiofrequency ablation in the treatment of pulmonary malignancies (≤3 cm)[J]. Bioen Rep, 2019,39(2):168-170.
[9] 李丽珍,钟秋红,黄昌辉,等.超声引导下经皮微波消融与CT超声引导下肿瘤射频消融治疗原发性肝癌的临床比较[J].中国CT和MRI杂志,2017,22(1):158-160.
[10] 孙文杰,高知玲,高雨佳,等.肝脏恶性肿瘤射频消融治疗及其术后影像表现[J].实用放射学杂志,2019,35(8):1303-1306.
[11] 位国军.超声引导经皮射频消融治疗肝癌的临床疗效分析[J].世界最新医学信息文摘,2018,18(1):30-31.
[12] 吴猛,郑齐超,李雄,等.超声造影与CT对肝癌射频消融术疗效的评估[J].中华普通外科杂志,2016,31(2):159-160.
[13] 刘建军,崔林,刘兴祥,等.CT引导下射频消融术在肝脏恶性肿瘤患者治疗中的应用[J].中国肿瘤临床与康复,2017,16(10):1219-1221.
[14] 王菡,王宏伟.超声-CT/MRI融合成像技术对肝癌射频消融术疗效的评估价值[J].肝脏,2018,23(8):727-729.
[15] 梁志超.超声联合CT融合图像对小肝癌诊出率及肝癌消融效果的影响[J].中国CT和MRI杂志,2020,18(5):22-24.
