腹腔镜根治术在Ⅰ~Ⅲ期胃癌患者中的应用研究
2022-08-25谢勇陈德锋胡林伍达章林艺强黄剑程俊波
谢勇 陈德锋 胡林 伍达章 林艺强 黄剑 程俊波
(1 福建省泉州市中医院 泉州 362000;2 南昌大学第二附属医院 江西 南昌 330006)
胃癌是临床发病率、致死率极高的一种恶性肿瘤疾病,早期胃癌是指癌组织浸润于黏膜层与黏膜下层,未发生转移的一种情况[1],因此,胃癌早期治疗尤为重要,可采用根治性手术进行治疗,切除肿瘤病灶组织与转移部位,改善预后。研究发现,传统开腹手术对机体创伤较大,术后并发症风险较大,复发率高,整体疗效欠佳[2]。而随着微创技术的发展,腹腔镜根治术凭借创伤小、恢复快、并发症少等优势在早期胃癌治疗中得到有效应用[3],可有效清除病灶,极大的延长患者生存期。本研究主要就Ⅰ~Ⅲ期胃癌行腹腔镜根治术对胃癌病人手术相关指标及糖类抗原 199(CA199)、糖类抗原 125(CA125)、胃蛋白酶原Ⅰ(PGⅠ)的影响展开研究。现报道如下:
1 资料与方法
1.1 一般资料 研究对象为2016 年1 月至2017年1 月于泉州市中医院及南昌大学第二附属医院胃肠外科接受手术治疗的64 例Ⅰ~Ⅲ期胃癌患者。纳入标准:满足《胃癌规范化诊疗指南(试行)》[4]相关诊断标准;经病理检查确诊为胃癌;满足手术治疗条件;基础资料完整;患者及家属阅读并签署同意书。本研究取得医院医学伦理会审批(伦理编号:2016032)。排除标准:患有急性上消化道出血、胃穿孔及其它恶性肿瘤疾病;术前或术中探查证实为Ⅳ期胃癌;合并免疫系统、凝血系统疾病;患有严重精神疾病,丧失沟通能力;拒绝配合临床检查及术后随访者。参照随机数字表法分成对照组与研究组,每组32 例。对照组男 20 例,女 12 例,年龄 42~65 岁,平均(54.39±8.36) 岁;肿瘤直径 0.8~6 cm,平均(4.22±0.31)cm;术后 TNM 分期:Ⅰ期 5 例,Ⅱ期15 例,Ⅲ期 12 例。观察组男 21 例,女 11 例,年龄43~66 岁,平均(55.02±8.84)岁;肿瘤直径 0.7~6 cm:平均(4.43±0.42)cm;术后 TNM 分期:Ⅰ期 6例,Ⅱ期14 例,Ⅲ期12 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 对照组予以传统开腹手术治疗:协助患者调整至仰卧位,实施气管内插管全身麻醉,于上腹部正中绕脐做切口,打开腹腔,显露病灶,观察是否发生转移,按照胃癌治疗指南行D2或D2+根治术,分离大网膜与结肠附着,分离结肠系膜前叶,结扎胃周动静脉供血系统,清扫血管根部周围淋巴结,切除病灶组织,采用吻合器吻合,根据肿瘤位置及浸润情况行远端胃切除(毕Ⅰ、毕Ⅱ)或全胃切除术,留置引流管,根据解剖结构缝合切口。观察组予以腹腔镜根治术治疗:指导患者取平卧位,实施气管内插管全身麻醉。于脐下做1 个长度为1 cm 的橫向切口,建立人工气腹(10~12 mmHg),主穿刺孔建立在左侧腋前线肋缘下2 cm 处,另于左侧锁骨中线平脐部位做副穿刺孔,分别选用12 mm 及5 mm 实施套管针穿刺,另外在左右两侧对称位置各自做1 个长度为5 mm 的助手操作孔,缓慢置入腹腔镜,探查肿瘤大小及具体位置,观察有无发生转移,并实施D2或D2+胃癌根治术,分离大网膜,向左离断血管至脾曲,结扎胃网膜左血管及相应胃短血管,同时剥离横结肠系膜与胰腺包膜组织,对胃结肠韧带实施,精准结扎胃网膜右侧血管,对幽门下淋巴结实施彻底清扫,最后再对胃右动脉进行结扎,断离十二指肠,裸化肝总动脉及胃左血管等,对第七、八组淋巴组织实施清扫,关闭气腹。另于上腹部正中建立1 个纵向切口(5~7 cm),将切口保护套置入腹腔内,切除病灶,结合胃组织残留情况,使用毕Ⅰ、毕Ⅱ或全胃+Roux-en-Y 胃肠吻合术重建消化道,灭菌用水对腹腔进行彻底冲洗,直至腹腔完全干净置入引流管,关闭腹腔。
1.3 观察指标 (1)手术相关指标。手术用时、切口长度、术中出血量、淋巴清扫数目。(2)血清肿瘤标记物水平。采用电化学发光法测定两组术前、术后3 个月的酶联免疫吸附试验(ELISA)法检测CA199、CA125;采用乳胶增强免疫比浊法测量两组术前、术后3 个月的PGⅠ。(3)炎症因子水平。采用酶联免疫吸附法检测两组术前、术后3 个月的C 反应蛋白(CRP)、白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)。(4)术后并发症总发生率。包括切口感染、幽门梗阻、吻合口瘘、肠粘连。(5)远期生存率。对于Ⅱ、Ⅲ期胃癌术后均予以辅助化疗,以术后复查与电话形式随访患者术后1、3、5 年的生存率。
1.4 统计学分析 选用SPSS22.0 统计学软件分析处理数据,全部计量资料均经Shapiro-Wilk 正态性检验,符合正态分布以()表示,用独立样本t 检验,计数资料以%表示,用χ2检验,若期望值<5,采用连续校正χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清肿瘤标记物水平对比 术前,两组血清肿瘤标记物水平对比,差异无统计学意义(P>0.05);术后 3 个月,观察组 CA199、CA125 水平均低于对照组,PGⅠ水平高于对照组,差异有统计学意义(P<0.05)。见表 1。
表1 两组血清肿瘤标记物水平对比()
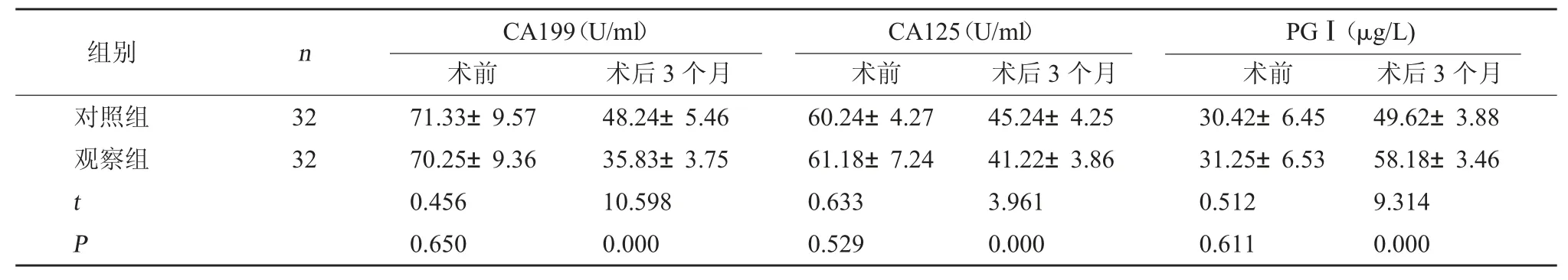
表1 两组血清肿瘤标记物水平对比()
PGⅠ(μg/L)术前 术后3 个月对照组观察组组别 n CA199(U/ml)术前 术后3 个月CA125(U/ml)术前 术后3 个月32 32 t P 71.33±9.57 70.25±9.36 0.456 0.650 48.24±5.46 35.83±3.75 10.598 0.000 60.24±4.27 61.18±7.24 0.633 0.529 45.24±4.25 41.22±3.86 3.961 0.000 30.42±6.45 31.25±6.53 0.512 0.611 49.62±3.88 58.18±3.46 9.314 0.000
2.2 两组炎症因子水平对比 术前,两组炎症因子水平对比,差异无统计学意义(P>0.05);术后3 个月,观察组 IL-6、CRP、TNF-α 水平均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组炎性因子水平对比()
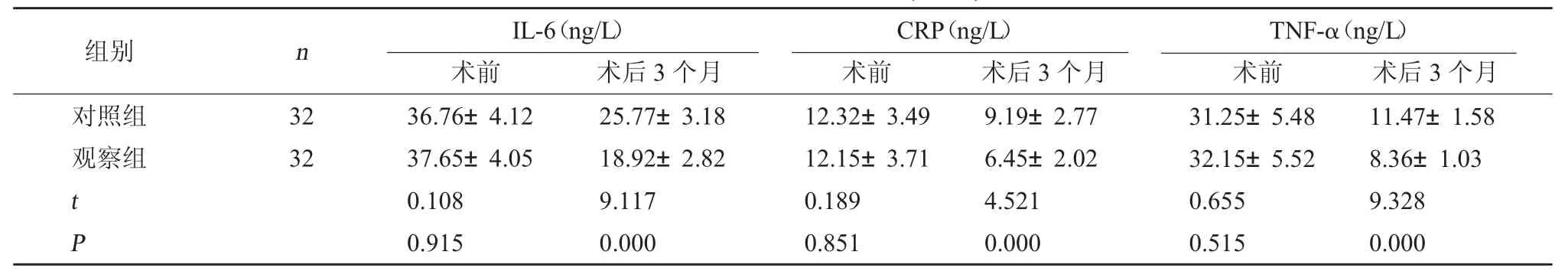
表2 两组炎性因子水平对比()
TNF-α(ng/L)术前 术后3 个月对照组观察组组别 n IL-6(ng/L)术前 术后3 个月CRP(ng/L)术前 术后3 个月32 32 t P 36.76±4.12 37.65±4.05 0.108 0.915 25.77±3.18 18.92±2.82 9.117 0.000 12.32±3.49 12.15±3.71 0.189 0.851 9.19±2.77 6.45±2.02 4.521 0.000 31.25±5.48 32.15±5.52 0.655 0.515 11.47±1.58 8.36±1.03 9.328 0.000
2.3 两组手术相关指标对比 两组手术时间对比,差异无统计学意义(P>0.05);相比对照组,观察组术中出血量更少、切口长度更短、淋巴清扫数目更多,差异有统计学意义(P<0.05)。见表3。
表3 两组手术相关指标对比()
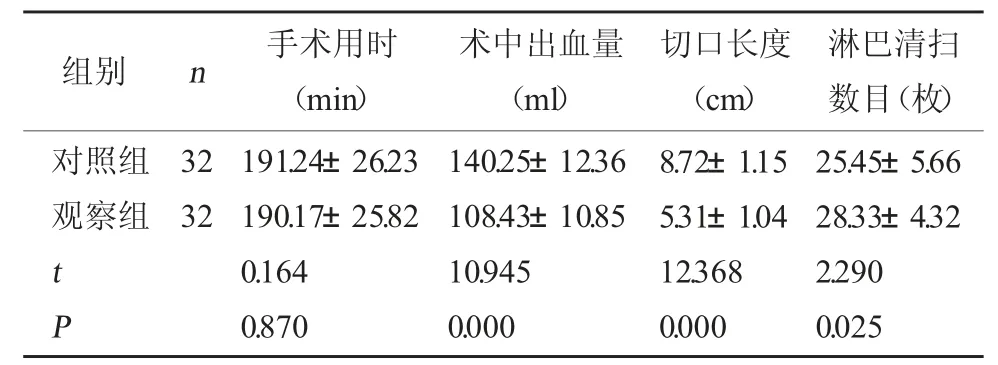
表3 两组手术相关指标对比()
淋巴清扫数目(枚)对照组观察组组别 n 手术用时(min)术中出血量(ml)切口长度(cm)32 32 t P 191.24±26.23 190.17±25.82 0.164 0.870 140.25±12.36 108.43±10.85 10.945 0.000 8.72±1.15 5.31±1.04 12.368 0.000 25.45±5.66 28.33±4.32 2.290 0.025
2.4 两组术后并发症总发生率对比 观察组术后并发症总发生率低于对照组,差异有统计学意义(P<0.05)。见表 4。
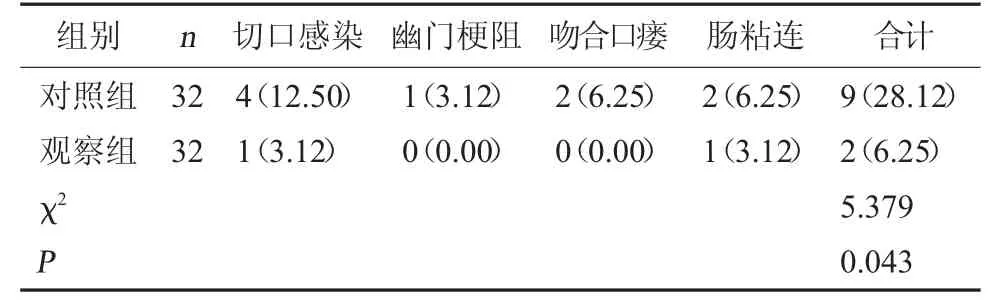
表4 两组术后并发症总发生率对比[例(%)]
2.5 两组远期生存率对比 两组术后1、3 年生存率对比,差异无统计学意义(P>0.05);观察组术后5年生存率高于对照组,差异有统计学意义(P<0.05)。见表 5。
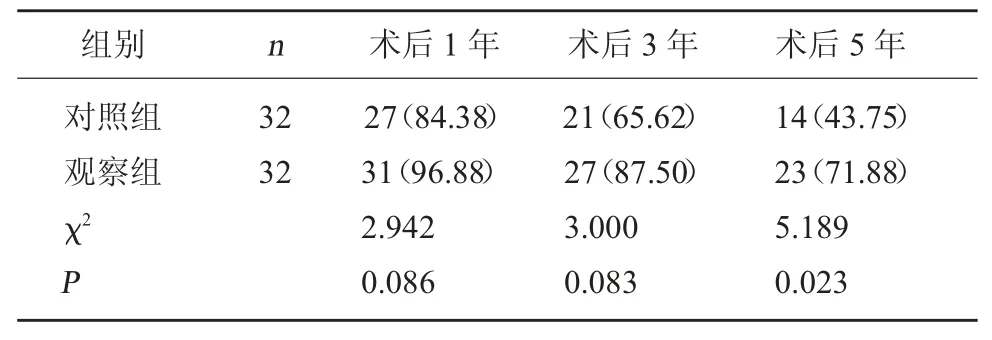
表5 两组远期生存率对比[例(%)]
3 讨论
胃癌在我国各类肿瘤中发病率居首位[5],每年约有17 万人死于胃癌,占恶性肿瘤死亡总人数的1/4,且每年还会新增2 万以上的患者,已严重影响到人们的生命安全。有报道称,早期胃癌症状不明显,具有较强的隐匿性,极易被忽视,但一经确诊,病情多发展至中晚期阶段,预后效果欠佳[6]。因此,早期胃癌的诊断与治疗异常关键。目前,胃癌根治术是临床治疗早期及进展期胃癌最常用的手段,与传统开腹手术相比,具有创伤小、术中出血量少、术后并发症及疾病复发风险低等多重优势,有助于改善预后[7]。
李荣发等[8]研究认为,腹腔镜根治术作为胃癌微创手术的一种常用术式,借助腹腔镜视频放大作用,可将患者腹腔内脏器图像清晰显示在液晶屏幕上,有助于医生准确辨别解剖结构,进行更加精细的手术操作,同时也可更加彻底的清扫胃淋巴结,对机体创伤及胃肠道功能干扰极小,还能明显减轻患者术后痛感,有助于患者术后快速恢复,加之手术切口瘢痕小、术后并发症少,得到临床医师与患者的高度认可。本研究采用腹腔镜根治术治疗的观察组,在手术用时方面,与采用传统开腹手术治疗的对照组相比,未见明显差异。主要是因为腹腔镜根治术虽可准确定位病灶,快速清除病灶,但需建立人工气腹,做主穿刺孔与多个操作孔,因此与传统开腹手术相比,手术时间长短相差不大。在术中出血量、切口长度及淋巴清扫数量等方面,腹腔镜根治术优势较为突出,相比与对照组,观察组术中出血量较少,切口长度较短,淋巴清扫数目更多,说明腹腔镜根治术可减轻患者机体损伤,提升病灶清除效果。此研究结果与郭晓磊等[9]研究一致,证实腹腔镜根治术可减轻胃癌患者机体损伤,减少术中出血量,有助于患者术后快速康复。一方面,腹腔镜根治术可精准定位病灶具体位置,在手术操作过程中可有效避免手术器械过度牵拉损伤到腹部神经及肌肉组织[10],同时也有助于医生更加清晰、快速的检查、清除胃周围血管及淋巴结的病变组织,减少对健康组织的损伤及术中出血量。另一方面,放大作用是腹腔镜自带功能,在手术过程中,即便通过较小的切口,也可清楚探查病灶,准确分离解剖层面,因此可明显缩短切口长度。
CA199、CA125 是恶性肿瘤的重要标记物,在临床评估胃癌手术疗效及预后效果中具有较高的特异性[11~12]。当血清 CA199、CA125 水平异常升高,意味着机体肿瘤发生恶性病变的可能性较高。PG 作为胃蛋白酶前体,可根据免疫圆形与生化性质分成PGⅠ、PGⅡ。PGⅠ多源于胃底黏液细胞与主细胞,当胃粘膜萎缩、发生病变后,胃底腺体数量就会异常减少,PGⅠ水平也会随之下降。说明PGⅠ与胃癌发展过程密切相关,是筛查胃癌病情高危症状的重要指标。本研究中,与接受常规开腹手术治疗的对照组相比,选择腹腔镜根除术的观察组患者,术后3 个月的CA199、CA125 水平明显较低,PGⅠ水平显著较高。此结果与崔正旅等[13]研究结果相似,对胃癌患者实施腹腔镜根治术,可显著降低CA199、CA125 血清肿瘤标记物水平。究其原因,腹腔镜根治术有助于医师更加清晰、详细的探查胃管周围血管及淋巴结情况,可显著提升清除肿瘤组织效果,减少肿瘤标记物分泌,进而有效调整血清肿瘤标记物水平。
研究发现,腹腔镜根治术可明显减轻内脏组织机械性损伤,避免炎症细胞活性过度激活,降低血清炎症反应[14]。柏巍松、谭玉成等[15~16]报道称,侵入性操作会促使机体产生不同程度的炎症反应与氧化应激反应。IL-6、CRP、TNF-α 在炎症反应中发挥着关键性作用,当机体发生氧化应激反应时,会促进其合成与分泌,进一步加重炎症反应,激活炎症细胞活性。本研究通过对比两组患者术后3 个月的IL-6、CRP、TNF-α 水平,发现观察组的炎症因子水平较对照组更低,说明腹腔镜根治术可减轻机体炎症反应。与传统开腹手术相比,切口短是腹腔镜根治术的突出优势,可有效减轻机体损伤,手术过程中产生的炎症及氧化应激反应也相对较轻,可明显减少各类炎症因子的释放。
程川兵等[17]研究显示,腹腔镜根治术除可有效治疗进展期胃癌,减轻患者应激反应以外,还可降低术后并发症发生率,证实了腹腔镜根除术治疗进展期胃癌的安全性。而本研究为证实两种手术方式的安全性与远期疗效,专门对两组患者术后并发症发生率及术后1、3、5 年生存率进行对比,发现观察组术后发生并发症的概率及术后5 年生存率较对照组均明显较低,但术后1、3 年生存率对比未见显著差异,提示腹腔镜根治术的安全性与远期疗效均优于对照组。此结论与冯伟静等[18]研究相一致,均认为腹腔镜根治术可有效提高胃癌患者的远期生存率。一方面,腹腔镜根治术具有创伤小、恢复快,对患者机体氧化应激反应、炎症反应及胃肠道功能影响小等多种优势,因此可有效预防、减少术后并发症;另一方面,腹腔镜根治术与传统开腹手术视野相比,具有放大作用,可更加彻底、精准的清除肿瘤组织,加之超声刀凝闭作用,能够有效避免淋巴清扫过程中发生淋巴肿瘤细胞脱落情况,因此可显著提升胃癌患者术后的远期生存率。另外,相比与传统开腹手术,腹腔镜根治术有发生肿瘤转移的可能,主要是由被肿瘤污染的器械造成切口污染或脱落的肿瘤细胞直接种植而引起的,因此在具体应用中,需不断加强医师的无瘤操作技术与腹腔镜操作技术,以进一步缩短手术操作时间,精准切除病变组织,降低肿瘤术中种植转移的风险。
综上所述,腹腔镜根治术可明显减少胃癌患者术中出血量少,减轻机械性损伤,提高淋巴清扫效果,在降低血清肿瘤标记物水平,减轻机体炎症反应,降低术后并发症发生风险,提高远期生存率等方面也具有突出优势,值得临床广泛推广与应用。
