基于网络药理学分析黄芩素降低血压和调控炎症的作用机制*
2022-08-25张铃刘菲曾建伟赵春雨熊晓满林珊黄彬陈达鑫林育鹏蔡巧燕
张铃 刘菲 曾建伟 赵春雨 熊晓满 林珊 黄彬 ,2 陈达鑫 林育鹏 蔡巧燕 #
(1 福建中医药大学中西医结合研究院 福州 350122;2 福建省中西医结合老年性疾病重点实验室 福州 350122;3 福建中医药大学陈可冀学术思想传承工作室 福州 350122;4 福建中医药大学中西医结合学院 福州 350122)
据统计,全球有超过15 亿人患有高血压,且呈年轻化趋势[1]。高血压是一种低级别炎症的慢性疾病,其发生发展伴随着炎症细胞的持续激活,是心脏病、脑卒中、慢性肾病、外周动脉疾病等最主要的危险因素之一。研究表明,有效抑制炎症反应可以阻滞高血压的进展[2]。目前许多中药在抗炎方面发挥了良好的疗效,如丹参[3]、苦参[4]、肉桂[5]、黄芩[6]等。其中,黄芩是一种传统中药,其味苦、性寒,归肺、心、肝、胆、大肠经,具有清热燥湿、泻火、解毒、止血等功效,在临床上用于高脂血症、动脉粥样硬化、高血压等疾病的治疗[7]。而黄芩素是从黄芩干燥根中提取出的一种黄酮类化合物,其能通过多靶点、多通路起到抗炎、抗氧化、保肝、利尿、抗癌等功效[8]。在高血压的相关研究中发现,黄芩素通过促进内皮细胞中的内皮型一氧化氮合酶(eNOS)重组蛋白表达与一氧化氮(NO)释放,可增强乙酰胆碱对血管的舒张作用[9],但其对高血压所致炎症反应的调控作用未见报道。本研究以AngⅡ诱导的高血压小鼠作为研究对象,明确了黄芩素降低血压及调控血清中炎症相关因子表达的药效作用,并进一步通过网络药理学探讨其治疗高血压的潜在机制。现报道如下:
1 材料与方法
1.1 动物 雄性 C57BL/6 小鼠,SPF 级别,7 周龄,购自于上海斯莱克公司,饲养于福建中医药大学动物实验中心SPF 级动物房观察室。实验动物使用许可证号:SYXK(闽)2019-0007。
1.2 药物配制 黄芩素购买于上海源叶生物科技有限公司,用0.9%氯化钠溶液超声助解,现配现用。1.3 主要仪器与试剂 Coda 血压测量仪购自于美国Kent Scientific 公司;Bio-Plex 悬液芯片系统购自于美国Bio-Rad 公司;Alzet Osmotic Pump(型号:2004)购自于美国Alzet 公司;AngⅡ粉末购自于美国Abcam 公司;Bio-Plex Pro assays 试剂盒购自于美国Bio-Rad 公司。
1.4 AngⅡ诱导的高血压小鼠模型的构建 采用皮下植入AngⅡ1 000 ng(/kg·min)缓释微型注射泵的方式构建高血压小鼠模型。具体操作如下:在小鼠的右侧背部后的两侧肩胛骨中间做一长约1.0~2.0 cm 的纵行皮肤切口,沿皮下组织游离,游离至左侧颈部皮下,将预装好的微量泵埋入到切口对侧皮下,用针、线缝合皮肤切口,并用碘伏进行消毒处理。把做完手术的小鼠放在电热毯上保温,防止死亡,直到小鼠麻醉清醒,再放回笼子里。
1.5 动物分组和给药 随机将小鼠分成对照组、AngⅡ组和AngⅡ+黄芩素组,每组各8 只。黄芩素的给药剂量为:5 mg(/kg·d)。于术后第1 天开始给药,1 次/d,每次灌胃0.3 ml,连续灌胃28 d。对照组和AngⅡ组同步给予等体积的生理盐水灌胃。
1.6 鼠尾无创血压仪测量血压 手术前测量基础血压,在黄芩素干预后第7、14、21、28 天测量血压。血压检测步骤如下:将Coda 血压测量系统安装好,包括加热板、压差传感器装置、装有Coda 软件的电脑等,打开电源和开关。诱使小鼠钻进固鼠器,固定完毕后放于加热板上加热,固定器和小鼠尾部均在加热板上,让小鼠稳定约3 min。将大小合适的尾袖套在小鼠尾巴根部,设置好电脑上的Coda 软件后开始测定,每只小鼠预测定10 次,正式测定15 次,每次30 s,记录合格小鼠的收缩压、舒张压数据,并计算其平均动脉压,平均动脉压=(收缩压+2×舒张压)/3。
1.7 Bio-Plex Pro assays 试剂盒检测血清中炎症相关因子的表达 往96 孔板中加入50 μl 1×与抗体偶联的微球,用wash buffer 洗板2 次。分别将50 μl的标准品、样本、Blank 加入到对应的孔中,900 rpm室温避光孵育30 min。用wash buffer 洗板2 次,再加入25 μl 1×检测抗体,900 rpm 室温避光孵育30 min。用 wash buffer 洗板 3 次,加入 50 μl 链霉亲和素 -PE,900 rpm 室温避光孵育 10 min。用 wash buffer 洗板 3 次,加入 125 μl 的 assay buffer,900 rpm 室温避光振荡30 s,于Bio-Plex 200 分析仪上机检测,使用Bio-Plex Manager 软件分析每个炎症相关因子相对的荧光强度,通过标准曲线计算对应的浓度。
1.8 黄芩素作用靶点基因与高血压疾病相关靶点基因的提取与交集 通过ETCM、TCMSP 数据库检索黄芩素的潜在作用靶点基因;以“hypertension”为关键词,在Disgenet、OMIM 等数据库中进行检索,以获得高血压疾病相关靶点基因;采用Draw Venny Diagram 在线程序将黄芩素和高血压靶基因取交集,获得两者共有的靶点,此集合为黄芩素治疗高血压疾病的可能潜在作用靶点。
1.9 KEGG 分析 将黄芩素和高血压靶基因取交集后取得的潜在作用靶点导入到David 数据库中,分析获得KEGG 通路富集的气泡图及关键信号通路(只展示前20 条具有统计学意义的显著性结果)。1.10 数据整理与统计分析 所有实验结果均采用SPSS15.0 软件进行统计学处理,实验结果用()表示。多组数据间比较,符合正态分布且方差齐的,采用单因素方差(ANOVA)分析。若不符合正态性分布,则使用非参数检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 黄芩素对AngⅡ诱导的高血压小鼠血压的影响 与对照组比较,AngⅡ组小鼠在第1~4 周的收缩压、舒张压及平均动脉压均显著升高(P<0.05),表明高血压小鼠模型构建成功,且持续稳定;在给药2 周后,与AngⅡ组比较,AngⅡ+黄芩素组小鼠的收缩压、舒张压及平均动脉压均显著降低(P<0.05),表明黄芩素能显著抑制AngⅡ诱导的高血压小鼠血压的升高。见图1。
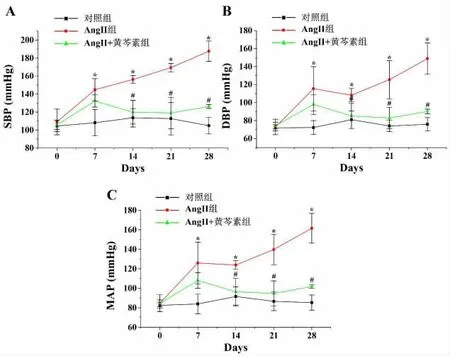
图1 黄芩素对AngⅡ诱导的高血压小鼠血压的影响
2.2 黄芩素对AngⅡ诱导的高血压小鼠血清中炎症相关因子表达的影响 与对照组比较,AngⅡ组小鼠血清中的白介素-6(IL-6)、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子 -α(TNF-α)、白介素 -1α(IL-1α)、单核细胞趋化蛋白 -1α(MIP-1α)、T 细胞激活分泌调节因子(RANTES)的表达均显著升高(P<0.05),IL-10 的表达则显著降低(P<0.05);而黄芩素干预后,能显著降低AngⅡ诱导的高血压小鼠血清中IL-6 和MCP-1 的表达(P<0.05),升高IL-10 的 表 达 (P <0.05), 但 对 TNF-α、IL-1α、MIP-1α、RANTES 的表达没有显著影响(P>0.05)。见图2。
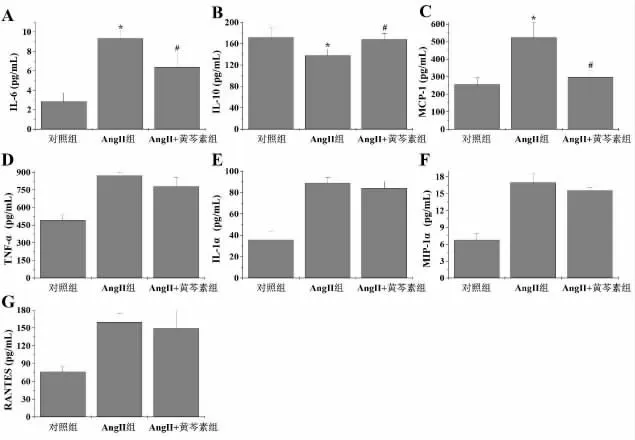
图2 黄芩素对AngⅡ诱导的高血压小鼠血清中炎症相关因子表达的影响
2.3 黄芩素作用靶点、 高血压疾病作用靶点的Venn 分析 从ETCM、TCMSP 数据库搜集到的黄芩素潜在作用靶点基因共有72 个,从Disgenet、OMIM 等数据库搜集到的高血压疾病靶点基因共有9 032 个。对两者的靶点基因进行Venn 分析,获得的交集靶点基因共有58 个。见图3。
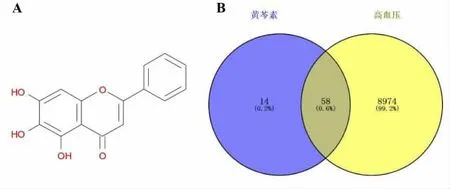
图3 黄芩素与高血压交集靶点的韦恩图
2.4 黄芩素治疗高血压的KEGG 通路富集分析黄芩素治疗高血压的潜在靶点涉及到的信号通路包括代谢途径、氮代谢、JAK-STAT 信号通路、PI3K-AKT 信号通路、趋化因子信号通路等。见图4。

图4 黄芩素治疗高血压的KEGG 通路富集分析
3 讨论
高血压是一种复杂的慢性疾病,是心脑血管疾病、慢性肾病和全因死亡的危险因素,其发病机制与肾 素 - 血 管 紧 张 素 - 醛 固 酮 系 统(Renin-Angiotensin-Aldosterone System, RAAS)密切相关[10]。AngⅡ是RAAS 系统中的重要效应因子,它能刺激醛固酮的分泌,从而增强肾小管对钠和水的再吸收,引起水钠潴留,导致血管内积液量增加,血压升高[11]。本研究利用AngⅡ皮下埋泵灌注的方式建立了高血压小鼠模型,结果表明在造模的28 d内,AngⅡ组小鼠的收缩压、舒张压及平均动脉压均持续、稳定升高。而经黄芩素干预2 周后,AngⅡ诱导的高血压小鼠的收缩压、舒张压及平均动脉压均显著降低,表明黄芩素具有良好的降压疗效。苗杰[12]研究表明黄芩素干预4 d 后就能显著降低AngⅡ诱导的高血压小鼠收缩压,但对舒张压及平均动脉压的影响尚未阐明。该研究实验结果与我们的研究结果一致,但黄芩素起效时间有所差别。该研究造模采用的AngⅡ剂量为1 200 ng/(kg·min),而本研究采用的AngⅡ剂量为1 000 ng/(kg·min);并且黄芩素给药方式及剂量也存在差别,该研究采用每天腹腔注射25 mg/kg 的黄芩素,而本研究采用每天灌胃5 mg/kg 的黄芩素。因此,本研究黄芩素发挥药效的作用时间有所延迟。
近年来,越来越多的证据表明高血压在发生发展的过程中会造成全身低级别的炎症反应,同时,炎症反应也会加剧高血压的进展[13~14]。目前许多炎症因子和趋化因子已经被证实与高血压密切有关,其中包括 IL-6、MCP-1、TNF-α 和 IL-10 等[15]。如有报道显示:IL-6 可能是健康人群高血压的高度独立危险因素,并发现这些细胞因子的高表达与高血压靶器官损伤呈正相关[16];MCP-1 的缺失或阻断能有效降低血压,减轻血管和肾脏炎症反应[17];IL-10 在AngⅡ诱导的盐敏感性高血压和肾损伤中发挥着保护作用[18]。本研究表明,在AngⅡ诱导的高血压小鼠血清中,其促炎因子及趋化因子 IL-6、MCP-1、TNF-α、IL-1α、MIP-1α、RANTES 的表达均显著高于对照组,但血清中抑炎因子IL-10 的含量显著低于对照组。而黄芩素干预显著降低AngⅡ诱导的高血压小鼠血清中IL-6、MCP-1 的表达,升高IL-10 的表达,证明了黄芩素具有显著抗炎的功效,但其具体的调控机制尚不清楚,因此我们通过网络药理学初步探索了其可能的潜在作用机制。
通过数据库分别搜集到黄芩素及高血压疾病的潜在作用靶点,并对两者取交集,发现了58 个共有靶点,并对这些共有靶点进行KEGG 分析,发现这些靶点涉及到代谢途径、氮代谢、JAK-STAT 信号通路、PI3K-AKT 信号通路、趋化因子信号通路等多条通路。其中PI3K-AKT 信号通路能激活下游NF-κB信号通路依赖性的转录,进而促进炎症相关因子表达的升高[19];JAK-STAT 信号通路作为应激的炎症信号通路,可以激活炎症因子相关基因转录,引起炎症因子级联反应,加速疾病的进程[20]。趋化因子是一类能诱导白细胞归巢的细胞因子。如MCP-1 通过结合其受体CCR2,从而诱导单核-巨噬细胞、T 淋巴细胞迁移到炎症部位,是炎症反应的始动因子,且参与了高血压的发生发展及靶器官(血管、心脏、脑)的损伤[21]。因此,本研究证实了黄芩素除了能调控血压升高外,还具有显著降低炎症反应的功效,但其是否与调控JAK-STAT、PI3K-AKT 和趋化因子信号通路等有关,还有待进一步的实验验证。
