大麻二酚对急性放射性肺损伤保护作用及机制研究
2022-08-25武忠宝吕东阳柳云恩
武忠宝, 阎 英, 徐 莹, 吕东阳, 柳云恩
1.沈阳药科大学,辽宁 沈阳 110016;2.北部战区总医院 放疗科,辽宁 沈阳 110016
放射治疗是一种应用广泛且有效的非手术治疗方法。 超过50%的肺癌患者在病程中至少接受过一次的放射治疗[1],但放射治疗常会造成放射性肺损伤,主要表现为急性放射性肺炎和纤维化[2]。有研究发现,放射会造成肺泡上皮细胞和血管内皮细胞损伤,进而诱导单核细胞、淋巴细胞和粒细胞聚集在组织损伤部位[3]。 这些炎症细胞会产生细胞因子、趋化因子和生长因子,如转化生长因子-β、干扰素(interferon,INF)-γ 和白细胞介素(interleukin,IL)-13 等,从而聚集更多的炎症细胞,破坏细胞间的紧密连接,过量的细胞外基质沉积,最终导致肺纤维化[4-5]。 目前,放射性肺损伤发病机制尚不明确,且缺乏有效的治疗手段,寻找新的可减轻放射性肺损伤的有效手段是亟待解决的难题之一。大麻二酚(cannabidiol,CBD)是从大麻中提取的一种无毒成分,具有抗炎、抗细胞凋亡和抗氧化应激的能力[6-8]。 近年来,欧美国家在非精神活性成分大麻提取物CBD 的药理研究和药物开发应用方面取得了较大进展,纯CBD 的制备已用于肿瘤、急慢性疼痛、风湿性疾病、精神类疾病、多发性硬化症和儿童癫痫的治疗[9-12]。 CBD 的用药安全性具有保障,但CBD 在放射性肺损伤中的作用却少见报道。 本研究通过构建放射性急性肺损伤动物模型,腹腔注射CBD,旨在阐明CBD 对放射性急性肺损伤的保护作用及机制。 现报道如下。
1 材料与方法
1.1 实验动物与分组 40 只健康雄性SD 大鼠(6 ~8 周龄,体质量280 ~300 g)购自本溪长生生物科技公司。 大鼠饲养于北部战区总医院重症战创伤实验室,实验室温度为22℃~24℃,相对湿度40% ~70%,12 h 昼夜交替。 大鼠可自由饮水、饮食。 经过7 d 环境适应后,将40 只将大鼠随机分成对照组、放射组、CBD 低剂量组(15 mg/kg)和CBD高剂量组(30 mg/kg),每组各10 只。 所有实验操作和实验方案经北部战区总医院动物伦理委员会审批通过。
1.2 放射性急性肺损伤动物模型制备 采用10%水合氯醛3 ml/kg 腹腔注射麻醉,麻醉过程中密切关注大鼠行为和呼吸变化,待肌肉完全松弛后固定在自制泡沫板上,腹部向上,在泡沫板上画好标记。麻醉后,立即送至Phillips CT 模拟定位机下模拟定位,CT 图像通过网络以DICOM 格式传输至Elekta Monaco 治疗计划系统,在TPS 上对大鼠肺部进行勾画并生成放射治疗计划。 按TPS 制定计划行直线加速器单次照射20 Gy。 照射结束待大鼠恢复行动能力后送至动物实验室继续饲养。
1.3 给药方式及取材 照射结束后第2 天开始,每天同一时间测量并记录大鼠的体质量。 CBD 低剂量组和CBD 高剂量组大鼠分别腹腔注射15 mg/kg 和30 mg/kg 的CBD,连续注射6 d。 腹腔注射时倾斜进针,使药物进入腹腔避免刺破肠腔,整个过程不需要麻醉。 取大鼠血液,在EP 管中室温静置1 h以上,3 000 r/min 离心10 min,取血清并做好标记。3%苯巴比妥钠麻醉后处死大鼠。
1.4 组织病理学观察 肺组织用10%中性甲醛固定、脱水、透明、石蜡包埋,然后制成3 ~4 μm 切片。将切片摊铺并在室温下烘焙过夜。 自然干燥后,用苏木精-伊红(HE)对切片进行染色,并在显微镜下观察肺组织的病理变化。
1.5 酶联免疫吸附实验 采用酶联免疫吸附试剂盒检测肺组织IL-1β、IL-6 和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的浓度。 在450 nm 波长处测定IL-1β、IL-6 和TNF-α 在微板阅读器中的浓度,生成标准曲线,绘制最佳密度值与标准浓度的关系图,计算并测定样品浓度的曲线方程和r 值。
1.6 蛋白免疫印迹法 通过添加冷蛋白裂解物和蛋白酶抑制剂,从冷冻的肺组织中提取总蛋白。 用BCA 法测定各组大鼠的总蛋白浓度。 组织蛋白经10%聚丙烯酰胺凝胶电泳法分离后转移至聚偏氟乙烯膜上。 膜用TBST 清洗3 次,室温下用5%脱脂奶粉封闭2 h,用TBST 清洗,参照Marker 切割。 添加 一 抗(IL-1β、 IL-4、 IL-6、 IL-17、 TNF-α、 IREα、MDA5、CHOP、Semaphorin 7α、AHSG 和Uteroglobin)在4℃孵育过夜。 用TBST 清洗3 次,每次10 min。加入二抗反应液,在室温下孵育2 h,然后用TBST清洗3 次,每次10 min。 采用ECL 化学发光显影,置于化学凝胶成像系统(伯乐,美国)中进行扫描曝光。 采用Image J 软件测量灰度值,以相应的内部参数作为测量和分析标准。
1.7 统计学方法 采用SPSS 20.0 统计学软件对数据进行处理。 计量资料用均数±标准差(±s)表示,组间比较采用单因素方差分析和Fisher 精确检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理结果 对照组大鼠肺组织未见明显改变,放射组大鼠肺组织明显水肿、变性/坏死、炎症细胞浸润,而CBD 低剂量组和CBD高剂量组放射导致的急性肺损伤明显改善。 见图1。

图1 各组大鼠肺组织病理结果(HE×200)
2.2 各组大鼠血清炎症因子表达水平比较 与对照组比较,放射组血清IL-1β、IL-6、TNF-α 水平明显升高(P <0.05);与放射组比较,CBD 低剂量组和CBD 高剂量组血清IL-1β、IL-6、TNF-α 水平明显降低(P<0.05)。 见图2。

图2 各组大鼠血清炎症因子表达水平
2.3 各组大鼠肺组织炎症因子蛋白表达水平比较 与对照组比较,放射组肺组织IL-1β、IL-4、IL-6、IL-17 和TNF-α 蛋 白 表 达 明 显 增 加(P <0.05);与放射组比较,CBD 低剂量组和CBD 高剂量组肺组织IL-4、IL-6、IL-17 和TNF-α 蛋白表达明显降低(P<0.05);与放射组比较,CBD 高剂量组肺组织IL-1β 蛋白表达明显降低(P < 0.05)。见图3。
2.4 各组大鼠肺组织氧化应激蛋白表达水平比较 与对照组比较,放射组肺组织IREα、MDA5 和CHOP 蛋白表达明显增加(P <0.05);与放射组比较,CBD 高剂量组肺组织IREα、MDA5 和CHOP 蛋白表达明显降低(P<0.05)。 见图4。
2.5 各组大鼠炎症浸润调控关键蛋白表达水平比较 与对照组比较,放射组大鼠炎症浸润调控蛋白Semaphorin 7α、AHSG 和Uteroglobin 表达明显增加(P<0.05);与放射组比较,CBD 高剂量组肺组织Semaphorin 7α、AHSG 和Uteroglobin 蛋白表达明显降低(P <0.05);与放射组比较,CBD 低剂量组肺组织Semaphorin 7α 蛋白表达明显降低(P<0.05)。见图5。
3 讨论
放射性肺损伤常见于肺癌、食管癌及其他胸部肿瘤的放射治疗中,易造成早期急性放射性肺炎及晚期肺纤维化[13]。 有研究发现,放射治疗4 ~24 h内,肺组织常出现非特异性的急性反应,受损的肺组织和内皮细胞会吸引巨噬细胞与内皮细胞释放大量炎症细胞因子、趋化因子和生长因子[14]。 本研究发现,放射导致大鼠血清炎症细胞因子IL-1β、IL-6、TNF-α 明显增加,同时肺组织IL-1β、IL-4、IL-6、IL-17 和TNF-α 蛋白表达也明显增加,提示放射可以造成血清和组织炎症因子表达水平升高。
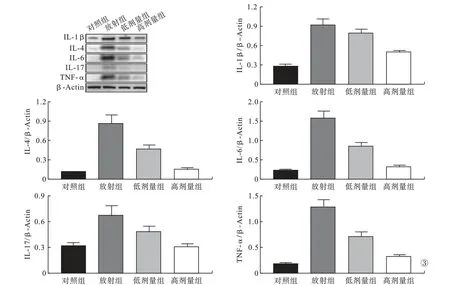
图3 各组大鼠肺组织炎症因子蛋白表达水平

图4 各组大鼠肺组织氧化应激蛋白表达水平
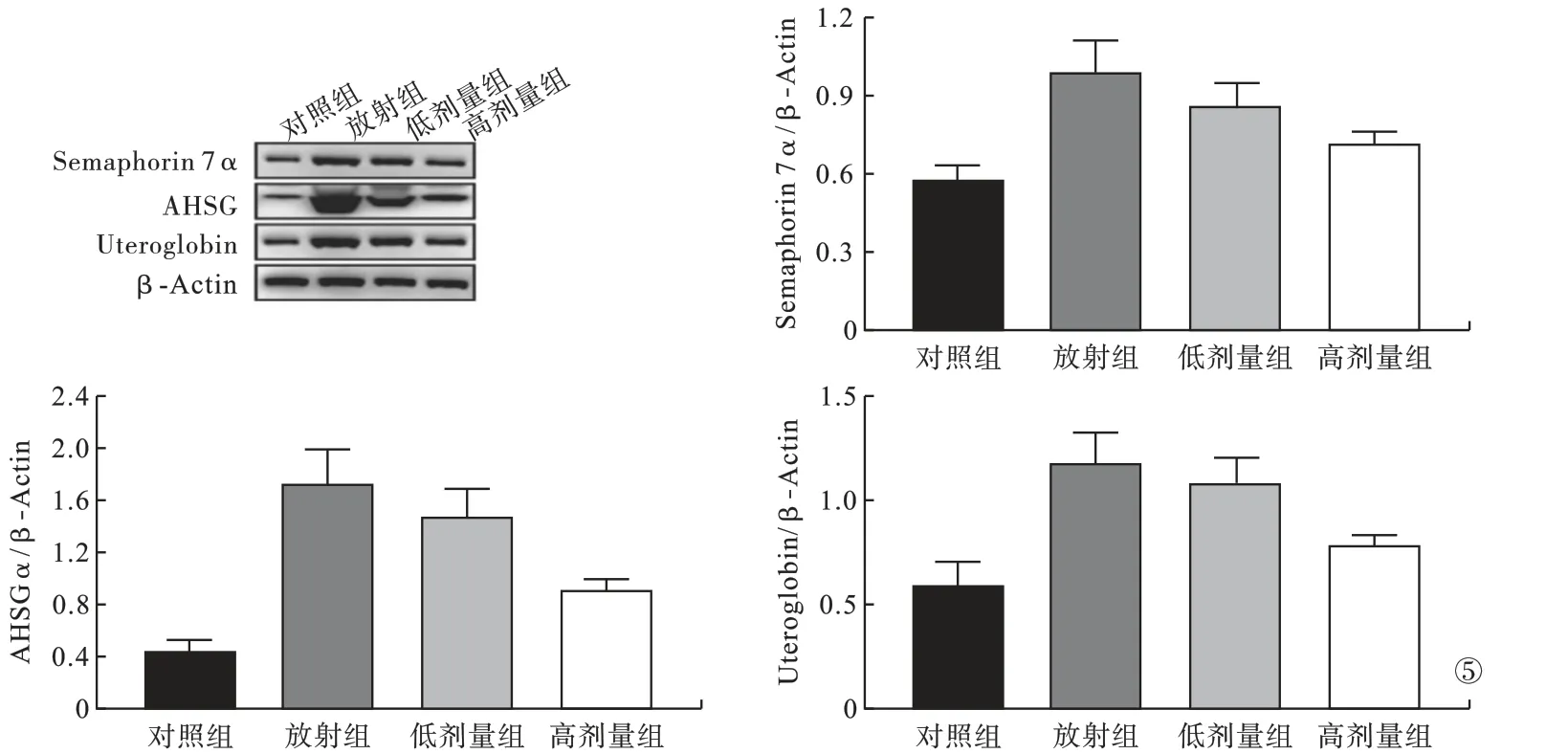
图5 各组大鼠炎症浸润调控关键蛋白表达水平
CBD 作为非甾体类抗炎药,通过刺激多种特异性介质被动停止促炎介质,增加了免疫炎症细胞的细胞程序性死亡,阻止信号激活,刺激炎症消退。有研究报道,CBD 可抑制牙龈假单胞菌诱导的IL-12p40、IL-6、IL-8 和TNF-α 的释放,同时提高抗炎细胞因子IL-10 水平[15]。 而另有研究发现,CBD可降低足底注射弗氏完全佐剂诱导炎症反应大鼠模型血清IL-1β、IL-10 和IFN-γ 水平,提高IL-6 表达[16]。 这提示,CBD 对不同动物模型的抗炎效果并不完全一致。 此外,CBD 可抑制脂多糖诱导的BV-2 细胞中NF-κB 的激活,但不能抑制MAPKs 的激活,从而阻断脂多糖诱导的神经炎症[17]。 本研究发现,放射可以造成肺组织氧化应激蛋白IREα、MDA5 和CHOP 表达增高,炎症浸润调节蛋白Semaphorin7α、AHSG 和Uteroglobin 表达增高,而CBD 可以显著降低放射导致的氧化应激,并改善炎症浸润蛋白表达。 有研究发现,CBD 直接针对线粒体并保护关键的线粒体功能,包括氧化还原调节、钙摄取、膜电位和生物能量学调节,这些功能在催产素/铁死亡诱导后被破坏。 CBD 的这些保护作用部分通过促进内源性抗氧化防御和激活AMP 激活的蛋白激酶信号实现[18]。 而CBD 类似物在抑制中性粒细胞渗透方面发挥了与强的松龙相当的有效抗炎作用[19]。 此外,在Thp-1 巨噬细胞中,CD36仅被CBD 上调,与αTan 或αTAR 共同作用可降低CD36 的表达。 这些结果提示,CBD 可以改善放射性导致的急性肺损伤,可能与其抗炎和抗氧化活性有关。
综上所述,CBD 对放射性急性肺损伤有保护作用,其作用可能通过降低炎症反应、抗氧化应激以及改变炎症调控蛋白表达密切相关。
