天麻种质资源及其与双菌共生分子机制研究
2022-08-24张照宇孙建华陈士林董林林
张照宇 孙建华 陈士林 董林林
(1 中国中医科学院中药研究所,北京,100700; 2 山东中医药大学药学院,济南,250300; 3 陕西汉王略阳中药科技有限公司,汉中,724300)
兰科(Orchidaceae)为与真菌形成典型菌根共生关系的高等植物类群,是探究植物-真菌相互作用的模式植物[1]。天麻(GastrodiaelataBl.)为应用广泛的兰科植物,又名“赤箭”“定风草”“鬼督邮”等,其生命周期高度依赖萌发菌与蜜环菌[2-4]。天麻干燥地下块茎具有息风止痉、平抑肝阳、祛风通络的功效,广泛用于降血脂、降血压、改善失眠、缓解疲劳、镇静镇痛、保护神经细胞、治疗风湿痹痛和调节人体免疫,是临床疗效显著且无明显不良反应的传统中药材[4-6]。国家卫生健康委员会协同国家市场监管总局已将天麻列入药食同源类中药材名录,使其成为深受广大消费者喜爱的药食同源品,具有药用价值、保健价值和经济价值[7]。
天麻野生种质经人工多代繁殖常出现品种退化、产量低而不稳、药效降低等问题,难以满足现阶段市场需求[8]。随着人工栽培与品种选育技术的推进,我国已培育出一批品质优良的天麻新品种[9-12]。然而,传统育种方式周期长且随机性大,天麻新品种培育工作面临发展瓶颈。利用现代分子生物学技术进行分子育种将实现药材的快速、精准改良,为种质资源优化提供启示[13]。天麻的生活史、生长发育过程、共生时期营养关系及细胞功能分化等研究已较为深入[2-3,14]。随着组学技术的发展,学者们已利用转录组学、蛋白组学等技术对天麻-真菌共生时期的分子机制进行了初步探究[15-16]。然而,目前的研究多仅局限于天麻全生育期的一个发育阶段或2种共生真菌的一个共生时期,缺乏系统性的研究与总结,对现有天麻分子调控机制进行整合,将为从分子层面揭示天麻异养生活模式的机制提供启示。
本文综述了天麻种质资源的分布、种类以及新品种培育现状,并对天麻-双菌共生时期促进种子萌发、维持共生动态平衡体系、增强共生效率、物质贮存等分子机制进行了系统梳理,以期为天麻遗传信息解析、品种选育、遗传改良和综合开发利用提供支撑与参考。
1 天麻本草考证
天麻在我国已有2 000多年的入药历史,主要为“治风”“补益”两大功效,其用药部位也随着朝代的变迁有所不同。早在秦汉时期,《神农本草经》将其以“赤箭”为名列为上品,始载其功效:“气味辛、温,无毒,主杀鬼精物,治蛊毒恶气。久服益气力,长阴,肥健,轻身,增年……功同五芝,力倍五仙,为仙家服食上品。”但未言明其药用部位[17]。魏晋时期《名医别录》以“三、四、八月采根”言明天麻以块茎作为药用部位[18]。宋代《本草衍义》中记载:“赤箭,天麻苗也。然与天麻治疗不同。”将天麻与赤箭分名别录,言明天麻药用部位为块茎,赤箭为其花茎[19]。《太平惠民和剂局方》中记载,天麻常通过与麝香、全蝎、僵蚕等息风药配伍治疗肝风内动所致疾病[20]。明代李时珍所著的《本草纲目》又云:“根、茎并皆可用。”将天麻的根、茎并为一物,并通过“天定乃定风草,治风之神药”“上品五芝之外,补益上药,赤箭为第一”等对天麻的分类、分布、药性、应用详细记载[21]。清代的《本草备要》载:“天麻,治小儿癫痫……天麻益气强阴,通血脉,强筋力,疏痰气。”可见天麻既是息风止痉常用药,又为补益良方[22]。
随着时代发展,目前天麻多以块茎入药。天麻饮片广泛应用于医疗保健领域,传统的天麻钩藤饮、半夏白术天麻方等复方制剂在临床上疗效显著,天麻果脯、天麻赤砂糖饼干等保健食品深受广大消费者喜爱[6,23-24]。天麻产业的持续完善将创造更多的药用价值、保健价值与经济价值。
2 天麻种质资源及新品种
中国是世界上野生天麻资源分布最广泛的国家,具有丰富的种质资源[25]。然而,天麻的真菌异养型生存机制以及市场需求量的逐渐升高使其野生资源处于濒危状态,且野生种质经数代繁殖后多出现种群退化、病虫害侵袭和品质下降等问题,栽培价值降低[26]。为保障天麻产业持续发展,我国以现有种质为基础培育了一批品质优良、产量稳定的新品种[8,27]。
2.1 天麻种质资源及分布 植物学研究显示,全球天麻属植物共30余种,但中药材天麻的基原仅为天麻(G.elata)一个物种[1,25]。该物种的分布遍及亚洲,南至尼泊尔、不丹,东至日本、朝鲜半岛,北至西伯利亚地区,西至中国西藏的错那[25]。在中国境内,天麻在各省市均有分布,南起云贵山区,北至黑龙江省,东起台湾省,西至西藏,主要聚集在长江中游两岸的山区[25]。根据花色、茎秆颜色以及块茎形状和含水量的不同,天麻下分6个不同变型(变种),其形态特征及分布情况见表1。红天麻(G.elataBl.f.elata)为原变型,花与茎皆呈橙红色,根茎呈哑铃形,主要分布于黄河及长江流域诸省;绿天麻(G.elataBl.f.viridisMakino)花呈淡绿色至白色,茎呈淡蓝色,根茎为长椭圆形或倒圆锥形,产于东北至西南诸省;乌天麻(G.elataBl.f.glaucaS.Chow)花呈蓝绿色,茎为灰棕色带白色纵条纹,主产于我国西南部的贵州省、云南省;黄天麻(G.elataBl.f.flavidaS.Chow)花与茎均呈淡黄色,根状茎卵状长椭圆形,主产于我国河南、湖北、贵州及云南诸省;松天麻(G.elataBl.f.albaS.Chow)花呈白色或淡黄色,茎为黄白色,根状茎常为梭形或圆柱形,主产于云南西北部;卵果天麻(G.elatavar.obovataY.J.Zhang)的花色、茎秆颜色及块茎形状与红天麻相似,区别在于其花呈螺旋排列,果实相对较短,分布于陕西省[25,28]。
2.2 天麻新品种 培育高品质新品种是天麻产业持续发展的保障。天麻6种变型(变种)在全国均有驯化栽培(表1)。其中,红天麻为原变型,因生长速度快、适应性强、产量高等特点而广泛栽培,为目前种植面积最大的天麻品种;乌天麻折干率较高、麻型较好且药性较强,为目前公认品质较好的天麻品种[8,27]。红天麻和乌天麻分别因高产和品质优良的特点成为育种的常用亲本植物材料。见表2。1997年,宜昌市林校以宜昌红天麻与云南乌天麻为亲本,通过正反交培育出我国第一代杂交天麻——“鄂天麻1号”和“鄂天麻2号”,并于2002年通过湖北省品种审定[9,29]。杂交后的品种生长速度快、适应性强、药用价值高,为我国常规天麻品种的更新换代开拓了光明前景。杨文权等[30]通过将天麻不同变型杂交证实乌天麻与红天麻的杂交后代品质最佳。西南交通大学对川西南天麻野生混合种质的自然变异株进行系统选育,得到适宜四川及相似生态区种植的新品种——“川天麻金乌1号”,该品种平均亩产较其基原乌天麻增加超过70%,推动了我国天麻的育种工作[10]。夏守平等[11]采集长白山地区的野生绿天麻,经人工驯化栽培,选育出适宜吉林省栽培的高产、优质、抗逆性强的新品种——“翡翠1号”,挖掘了长白山地区天麻产业的发展潜能。红天麻为陕西省道地药材且有自然分布,陈士林课题组通过将野生红天麻自交选育出品质优良、分生速度快、抗逆性强的新品种——“略麻-1号”(ZYXP-2020-006),目前已在陕西略阳、湖北武夷山等地区广泛种植,取得了显著的经济、社会和生态效益[12]。

表1 天麻种植资源形态特征及分布情况
将天麻经典品种的优良性状结合是现阶段天麻育种的主要思路,然而传统育种方式的周期性和随机性使育种工作面临瓶颈,利用现代分子生物学技术实现分子育种将精准调控天麻性状,指导天麻良种繁育的快速发展。
3 天麻-双菌共生分子调控机制
天麻是与真菌共生的异养草本植物,其无根无叶,无法进行光合作用,也不能从土壤中吸收大量水分和营养物质[8]。天麻生活史为:种子→原球茎→米麻→白麻→箭麻→种子[2]。见图1。种子至原球茎阶段为种子共生萌发阶段,此过程天麻需小菇属(Mycena)真菌与其共生并提供营养物质,此阶段共生真菌统称为萌发菌[14];原球茎后期,蜜环菌(A.mellea)逐渐取代萌发菌成为天麻的主要营养来源,并与天麻共生至再次结种[3]。这种先后与不同真菌共生的生存机制成为天麻区别于其他兰科植物的特征,为天麻-双菌共生研究提供了生理学依据。

表2 天麻新品种培育现状
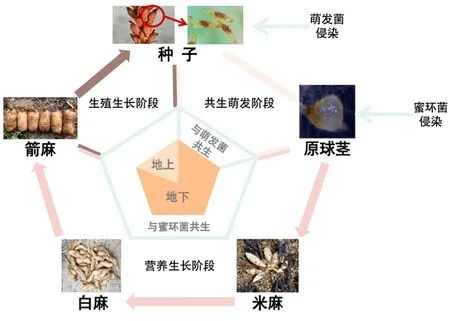
图1 天麻生活史
采用天麻全基因组测序对天麻真菌异养模式的分子机制进行初步探究。天麻基因组(1.06 Gb)通过假基因化与基因重排淘汰大量基因,仅有187 969个蛋白编码基因被注释,是迄今为止最小的理论蛋白质组。光合作用相关基因在缺失基因中占比极高,标志着天麻光合系统的严重退化;而线粒体基因组显著扩张,并主要富集于代谢功能。此研究结果表明,天麻利用基因可塑性调整全基因组结构,使其在无法自身进行光合作用的情况下能够进行正常生理活动,为天麻-双菌共生研究提供了分子依据[31]。
3.1 天麻-萌发菌共生时期分子机制 天麻种子由种皮、分生细胞、原胚细胞、柄状细胞及已退化的胚柄残迹构成,因无胚乳而缺乏营养供应,小菇属(Mycena)真菌为其萌发提供信号与营养,此机制称为共生萌发[32-33]。萌发菌以菌丝形态由柄状细胞侵入种子并使胚分生细胞分化为天麻与菌丝共生的主要场所——菌丝结细胞,以及水解菌丝并为天麻提供营养的场所——消化细胞[14]。种子由消化细胞水解菌丝获得营养,胚分生细胞旺盛分裂,膨胀的胚突破种皮形成原球茎[34]。
共生萌发前期,天麻与萌发菌为保证种子萌发均产生分子调节机制。天麻种皮由木质素形成疏水屏障,限制水分而导致种子发育不良[35]。Ren等[34]的转录组学研究结果显示,与纯菌丝比较,共生菌丝中降解木质素的锰依赖性过氧化物酶(Manganese-dependent Peroxidase,MnP)与漆酶(Laccase)表达均显著上调,协助降解天麻种皮并促进水分吸收。植物激素脱落酸(Abscisic Acid,ABA)为种子萌发抑制剂,在种子至原球茎阶段,5种参与ABA生物合成的基因表达显著下调,30个参与ABA信号转导的基因表达水平较低且无显著变化,降低了ABA对天麻种子萌发的抑制。因此,共生体系建立后,宿主与真菌均通过调整基因表达量促进种子萌发。
天麻与萌发菌共生是建立信号转导与物质运输途径的复杂过程。内吞作用又称入胞作用,该过程多依赖网格蛋白,是宿主与真菌建立共生关系的桥梁,具有激活共生信号通路、环境沟通、物质运输等作用[36-38]。转录组学结果表明,原球茎中有16个(共26个)网格蛋白介导的内吞作用相关基因较种子时期显著上调表达,此结果与该团队蛋白组学结果一致[32-33]。原球茎后期,促进信号复合物形成并诱导防御素表达的丝氨酸与苏氨酸激酶高度表达,提高了信号转导效率[33]。在共生萌发过程中,天麻通过调节信号转导与物质运输途径促进天麻-萌发菌共生体系的建立并增强了二者的共生效率。
在长期进化过程中,天麻建立了抵御菌丝过度侵染的多重机制。真菌细胞壁主要由多糖构成,其水解产物寡糖可作为激发子诱导宿主细胞产生防御与免疫反应[39]。转录组学结果显示,在种子至原球茎阶段,天麻编码多糖水解酶的基因显著上调[32]。这一机制促进了菌丝细胞壁降解,产生寡糖,并诱导防御与免疫相关基因的表达上调[34]。根据多项转录组学结果,抗病相关蛋白在种子萌发后显著上调,共生萌发关系建立后,原球茎中的上调基因数目远高于下调基因数目,且多聚集于植物防御、能量代谢、次生代谢等途径,而共生菌丝下调基因数目始终高于上调基因数目[31-33,40]。这标志着共生关系的建立,使宿主开始随着消化菌丝获得营养物质,并随着旺盛的生命活动生长,而萌发菌则受到限制和消化,生理活性与生命活动较共生关系建立前显著降低,二者处于动态平衡状态。
共生萌发后期,蜜环菌开始侵染天麻并伴随活性氧(Reactive Oxygen Species,ROS)的产生[41]。蛋白组学结果表明,与早期原球茎比较,天麻于原球茎后期上调植物防御、代谢、分子信号相关基因。其中,增强真菌抗性的致病相关蛋白,保护组织免受氧化损伤的过氧化物相关酶高度表达,这表明蜜环菌的侵染触发了天麻的代谢与防御反应[33]。共生萌发后期天麻-萌发菌共生平衡状态被打破,蜜环菌将逐渐取代萌发菌与天麻形成新的共生体系。
综上所述,天麻-萌发菌共生时期主要有促进种子萌发、提高共生效率、维持共生平衡,以及共生后期打破动态平衡4类调控机制。见表3。天麻种子-萌发菌建立共生关系后,宿主与真菌分别通过降低种子萌发抑制剂的合成与协助降解种皮以促进种子萌发形成原球茎。形成稳定共生体系后,天麻-萌发菌通过建立信号转导与物质运输途径提高天麻-真菌共生效率,天麻将菌丝限制于皮层区域并不断消解菌丝以维持菌-麻动态平衡状态。共生萌发后期,蜜环菌的侵染使天麻产生应激与防御反应并打破共生体系动态平衡,为下一阶段天麻-蜜环菌共生体系的建立创造条件。

表3 天麻-萌发菌共生阶段分子机制
3.2 天麻-蜜环菌共生时期分子机制 天麻-萌发菌共生后期,编码器官形态变化的相关基因高度表达,原球茎顶端的分生组织逐渐分化出新生麻[31]。此阶段仅依靠萌发菌已无法满足天麻分化生长出新生麻的需求,蜜环菌侵染并取代萌发菌为天麻的生长发育提供营养。见图1。萌发菌与蜜环菌均为天麻与其共生期间的唯一营养来源,然而二者在侵染方式及侵入位置等方面有所不同[14]。见图2。

图2 萌发菌、蜜环菌与天麻共生期间的异同
蜜环菌菌丝通过机械力量和分泌化学物质突破表皮,直达大型细胞层外的一层皮层细胞并形成菌丝流细胞层。菌丝由菌丝流细胞层向外侵染并消化宿主细胞的细胞器,菌丝缠绕形成天麻与蜜环菌共生的场所——菌丝结细胞,向内侵染被消化细胞层彻底水解。天麻由消化细胞层水解菌丝获得营养,进而发育为箭麻[2-3,14]。经过低温休眠越冬,箭麻抽薹出土,形成花茎并开花、结种。至此,天麻完成由种子到种子的生活史[8]。
与萌发菌相似,天麻-蜜环菌共生体系需多种机制共同调节。宿主可通过Ca2+激增过程调节真菌定殖,独脚金内酯对菌丝具有分枝诱导作用[42]。根据全基因组结果,与近缘物种比较,天麻扩张了参与Ca2+激增过程的钙调素依赖蛋白相关基因和用于合成、分泌独脚金内酯的关键基因[31]。组织特异性实时定量PCR分析结果表明,独脚金内酯相关基因在菌丝定殖的皮层中表达量最高,线粒体基因组中37个代谢相关基因中的36个在皮层中高度表达,这与宿主细胞与菌丝在皮层处建立共生关系的功能需求高度相关[14,31]。天麻利用其基因可塑性扩张菌丝调节相关基因,并通过组织特异性表达调节菌-麻共生区域的代谢过程,增强了天麻-蜜环菌共生关系的效率。
为抵御蜜环菌过度侵染,天麻于共生阶段产生自我保护机制。代谢产物分析表明,4-羟基苄基醇(4-Hydroxybenzyl Alcohol,p-HA)仅分布于宿主,然而天麻通过向共生菌丝运输具有p-HA骨架的植物抗毒素S-(p-HA)-glutathione抵御菌丝进一步侵染[31]。通过转录组学将共生菌丝与纯菌丝转录物进行比较,结果显示共生菌丝中93.16%的差异基因表现为下调;其中与蜜环菌生命活动高度相关的纤维素酶、木聚糖酶等胞外酶相关基因全部呈下调表达[43-44]。天麻通过向菌丝运输植物抗毒素、抑制共生菌丝生命活动等自我保护机制减弱菌丝的侵入能力,抵御了蜜环菌对宿主的过度侵染并不断消化菌丝,使天麻-蜜环菌呈动态平衡状态。
共生天麻能否合成并累积足够营养贮存物质及能量物质是箭麻品质的关键。刘云霞等[45]通过转录组学比较共生天麻与商品箭麻的生长代谢差异,并选择了植物生长过程中至关重要的氮、碳和能量代谢过程中的关键酶进行差异基因分析。氮素代谢是植物生长发育的关键生理过程[46]。在共生天麻中,谷氨酰胺合成酶(Glutamine Synthetase,GS)与天冬酰胺合成酶(Asparagine Synthetase,ASNS)编码基因表现为显著上调,分解氨基酸的谷氨酸脱氢酶(Glutamate Dehydrogenase,GDH)与精氨酸酶编码基因均表现为下调,为天麻积累了氮素营养[47-49]。淀粉是高等植物的营养贮存形式[50]。转录组分析结果显示,共生天麻中的可溶性淀粉合成酶(Soluble Starch Synthase,SSS)、提供淀粉底物的蔗糖合成酶(Sucrose Synthase,SuSy)与淀粉合成的限速酶——腺苷二磷酸-葡萄糖焦磷酸化酶(ADP-glucose Pyrophosphorylase,AGPase)编码基因均表现为上调,而具有水解功能的淀粉酶(Amylase,AMS)相关基因表现为下调[43,51-52],为天麻的生长发育贮存了营养物质。糖酵解与柠檬酸循环为产能途径。基于转录组数据分析结果,共生天麻的己糖激酶(Hexokinase,HK)、丙酮酸脱氢酶(Pyruvate Dehydrogenase,PDH)、苹果酸脱氢酶(Malate Dehydrogenase,MDH)、异柠檬酸脱氢酶(Isocitrate Dehydrogenase,IDH)基因表达均上调。这表明在天麻-蜜环菌共生期间,糖酵解与柠檬酸循环代谢旺盛,由此产生大量腺苷三磷酸(Adenosine Triphosphate,ATP)并通过显著上调的ATP酶(Adenosine Triphosphatase,ATPase)水解,为共生天麻的成熟提供大量能量[18]。共生阶段天麻大分子物质的合成及累积,为其生长发育提供了足够的营养与能量。
综上所述,天麻-蜜环菌共生体系具有提高共生效率、维持共生平衡、物质贮存3类共生机制。见表4。天麻与蜜环菌共生时期可通过组织特异性表达及物质运输等途径调节共生体系以提高共生效率并维持菌-麻体系动态平衡;同时,宿主可通过调节代谢相关基因贮存营养及能量物质以保障箭麻的成熟。
4 展望
天麻为我国传统的珍贵药材,其悠久的药用历史和显著的临床疗效吸引着学者们的逐渐关注。目前天麻种质资源、遗传信息与菌-麻共生体系的分子调控机制相关研究已初见成果。为充分发挥天麻药用价值与经济价值,天麻物种相关研究应重点关注以下几点。
4.1 遗传信息的合理利用 天麻的遗传信息是天麻分子育种的宝贵资源。对不同天麻种质进行遗传多样性分析,建立天麻DNA种质资源库,为不同种质资源的区分鉴定与优良品种遗传特质的确定提供可靠的分子依据。在此基础上高效利用优良性状的控制基因,通过分子设计与全基因组分子标记辅助选育,可助力培育优良新品种。
4.2 组学技术的整合利用 当前天麻的分子生物学研究多基于基因组、转录组、蛋白组等单一组学技术进行,应采用多组学技术,从多层次、多因素的全局性角度进行整合研究,建立并完善基因-表型组数据库,系统阐述天麻共生体系的调控机制。

表4 天麻-蜜环菌共生阶段分子机制
4.3 天麻产业的持续完善 目前,天麻产业已逐渐由粗加工饮片向精细加工产品转变。通过加强优良品种选育、种植基地建设确保天麻的产量和质量,并以此为基础开展产品多元化研究,将天麻产业拓展到除食品、药品、保健品以外的烟、酒、茶、化妆品各领域,将助力天麻产业创造更多的经济效益、社会效益。
