植物中花色苷来源及提取方法研究进展
2022-08-24宋毓晔王渝朱千林聂泽坤杨荣玲赵祥杰
宋毓晔,王渝,朱千林,聂泽坤,杨荣玲,赵祥杰
(淮阴工学院生命科学与食品工程学院,江苏 淮安 223003)
花色苷属于类黄酮类化合物,是植物中产生的一类常见的次级代谢产物,不同的花色苷受不同因素影响时的颜色变化很大,在植物中可以呈现红、黄、绿、蓝、紫、黑等颜色,是自然界中的一类常见天然色素,广泛存在于多种植物的花、果实、茎、叶和根器官的细胞液中[1-2]。目前已报道的花色苷类化合物有约700余种[3],但主要衍生自6种基本的花青素:矢车菊素(cyanindin,Cy)、飞燕草素(delphinidin,Dp)、矮牵牛素(petunidin,Pt)、芍药素(peonidin,Pn)、天竺葵素(pelargonidin,Pg)和锦葵素(malvidin,Mv),已知的花青素有23种,但自然界中游离花青素极少,多以花色苷形式存在,种类繁多的花色苷赋予植物以绚丽的颜色[4]。
花色苷具有多种生物活性,因其安全无毒、来源天然和功能优异,引起研究者们的广泛研究兴趣,大量研究结果表明:植物花色苷具有抗炎、抗氧化、抗肿瘤、保护视力、预防糖尿病、保护心血管、降脂减肥等诸多作用[2,5],在食品、医药、化工、化妆品等领域都有潜在利用价值。花色苷来源十分丰富,除了茎叶和花朵之外,大量的植物果实也是花色苷的重要来源,这些来源的花色苷易于被采收和加以利用,为花色苷的规模化应用提供了充足来源保证。近年来,国内外研究者对大量植物花色苷进行了研究,特别是关注于花色苷的提取方法[2]、生物活性[6]以及功能应用[7]等,但由于不同提取方法可能对来源各异的花色苷在结构和性质方面带来一定的影响,因此有必要对不同提取方法以及不同来源花色苷的类型和性质进行分析。本文综述了植物中花色苷的主要来源及分布,并梳理了近年来在花色苷提取方法上的创新应用,旨在为花色苷资源的开发利用和工业化生产制备提供参考。
1 植物花色苷的来源
花色苷广泛存在于被子植物的花、果实、茎、叶、根器官的细胞液中,分布于27个科,72个属的植物中,按照水果类、蔬菜类、粮谷类、鲜花及药用植物类进行分类[2,8]。
1.1 水果类
水果是天然花色苷的重要来源,按果实形态结构分为浆果、核果、仁果、橘果等,花色苷主要存在于果皮、果肉、花、树叶等组织中。
1.1.1 浆果类
浆果中花色苷种类较为丰富,是花色苷的主要来源。常见富含花色苷的浆果:葡萄、桑椹、蓝莓、草莓、红树莓、黑莓、黑加仑、黑果腺肋花楸、乌饭果、覆盆子、智利酒果、醋栗、山竹、黑果枸杞等。Kim等[9]研究发现桑椹以矢车菊素-3-O-葡萄糖苷为主,黑果腺肋花楸以矢车菊素-3-O-半乳糖苷为主,进行体外消化模拟试验证明矢车菊素-3-O-半乳糖苷较矢车菊素-3-O-葡萄糖苷不稳定,但具有较高生物活性。Acevedo等[10]使用高效液相色谱质谱联用和核磁共振波谱鉴定出葡萄中存在的33种花色苷结构。Dzhanfezova等[11]测定18种草莓品种的花色苷,发现各品种中主要的花色苷是天竺葵素-3-O-葡萄糖苷(50% ~90% ),其次是矢车菊素-3-O-葡萄糖苷(1% ~47% ),野生草莓在供试品种中具有最高的抗氧化活性。
1.1.2 核果类
常见富含花色苷的核果类水果有樱桃、杨梅、红毛丹、三华李、欧李、粗梗稠李、芒果、荔枝、唐古特白刺果等。Mugwagwa等[12]研究发现红色芒果果皮中主要花色苷为矢车菊素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷。Blackhall等[13]确定了甜樱桃中花色苷95% 以上是矢车菊素-3-芸香糖苷和芍药素-3-芸香糖苷,而矢车菊素-3-葡萄糖苷和天竺葵素-3-芸香苷占5% 左右。
1.1.3 仁果类
常见富含花色苷的仁果类水果有梨、苹果、山楂、莲雾、温柏果等。随着对不含人工添加剂的天然食品需求的增长,山楂色素正成为一种重要的着色剂,Liu等[14]对山楂品种“Zirou”中的花色苷进行结构鉴定,确定86.5% 为矢车菊素-3-半乳糖苷,且首次从山楂果实中分离到矢车菊素3,5-二己糖苷、天竺葵素-3-芸香糖苷和锦葵素-3-葡萄糖苷,试验结果表明热处理可提高山楂饮料中花色苷含量和色密度,使山楂饮料的色泽更具吸引力,但对山楂饮料的抗氧化能力没有显著影响。
1.1.4 橘果类
Carmona等[15]研究血橙中的花色苷主要是矢车菊素-3-葡萄糖苷和矢车菊素-3-(6′-丙二酰葡萄糖苷),血橙更适合低温贮藏,与4℃贮藏相比,9℃贮藏的血橙果实呈现更深的紫红色,果肉和果汁中的花色苷含量更高。
1.2 蔬菜类
蔬菜也是天然花色苷的主要来源,蔬菜中的花色苷主要存在于其表皮组织、叶或块茎中,按所存在的植物器官可以分为叶菜类、根茎类、果菜类等。
1.2.1 叶菜类
常见富含花色苷的叶菜有紫结球甘蓝、紫叶野芥、红叶芥菜、紫包菜、紫背天葵、红凤菜、红菜薹、菊苣、洋葱、花椰菜等。Strauch等[16]采用超高效液相色谱-二极管阵列检测器-质谱的方法鉴定出红甘蓝的29种花色苷主要是酰化和糖基化的花青素衍生物。酰化花色苷比未酰化花色苷更稳定,更耐热、耐光、耐碱,因此具有更高的加工稳定性能。
1.2.2 根茎类
常见富含花色苷的根茎类蔬菜有黑胡萝卜、芜菁甘蓝、紫薯、马铃薯、黑土豆等。Sampaio等[17]研究7个有色马铃薯品种花色苷,在红色和紫色品种中主要是酰化的糖苷、天竺葵素和矮牵牛素,其花色苷提取物均具有体外抗氧化、抗菌和抗真菌活性,未检测到毒性作用。选定红肉品种“迷迭香”、紫肉品种“紫色”的花色苷水提取物在软饮料配方中作为着色剂与商业着色剂E163进行对比测试,在30 d货架期内均表现出良好的感官特征和较高的颜色稳定性。
1.2.3 果菜类
常见富含花色苷的果菜有番茄、紫色线茄、黑豆、黑芸豆、野豌豆、蝴蝶豌豆、紫皮豇豆等。Chen等[18]通过高效液相色谱-质谱联用鉴定了黑大豆种皮提取物的花色苷为矢车菊素-3-O-葡萄糖苷、飞燕草素-3-O-葡萄糖苷和芍药素-3-O-葡萄糖苷,研究表明矢车菊素-3-O-葡萄糖苷参与了黑豆种皮提取物对2型糖尿病(type 2 diabetes mellitus,T2DM)的降糖、降脂作用,可能是治疗T2DM的一种有前景的功能食品或药物。
1.3 粮谷类
粮谷类的植物花色苷主要存在于种皮、叶、须、颖穗等组织中。花色苷研究中常见的包括黑青稞、紫青稞、黑小麦、紫粒小麦、大麦、荞麦、高粱、紫玉米、红米、黑米等。侯方丽等[19]研究黑米花色苷调节脂质代谢作用,体内外研究结果表明其作用机制在于调节脂肪酸合成和氧化以及改善胆固醇合成和转运等相关酶及其基因的表达。Ferron等[20]检测到意大利紫色玉米中的3种花色苷,主要是矢车菊素-3-O-葡萄糖苷、天竺葵素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷及其丙二酰化形式,通过体外试验证明其具有降血糖作用,具有良好的抑制α-葡萄糖苷酶活性的能力,可阻断肠道碳水化合物消化酶活性。
1.4 鲜花及其他植物类
花色苷主要存在于叶、茎、花、果实组织中。以植物茎的形态主要分为草本类、木本类。
1.4.1 草本类
矢车菊、玫瑰茄、郁金香、紫花苜蓿、二月兰、万寿菊花、百合、红三叶草、荷花、茜草、冬凌草、马齿笕、铁皮石斛、紫苏、鸡冠花、藏红花、向日葵等的花朵中均含有大量花色苷。Arici等[21]研究发现富含飞燕草素类郁金香可以呈现黑色、黑紫色、紫罗兰色和紫色,该花色苷含量占总花色苷含量的50% 以上;而富含矢车菊素类郁金香中该花色苷则可以呈现红紫色、粉红色、黑红色、深红色、深橘红色和橘红色等,废郁金香花瓣可以作为天然食用着色剂的一种新来源,废花瓣可以作为提取花色苷的一种经济环保的原料资源。
1.4.2 木本类
木本类常见的有玫瑰、美洲合欢花、薰衣草、一品红、红叶石楠、红花羊蹄甲、山茱萸、木槿、插田泡、刺五加、云南小粒咖啡、甘蔗、三叶木通、忍冬等。已有研究表明木槿花中主要花色苷为飞燕草素-3-O-桑布双糖苷和矢车菊素-3-O-桑布双糖苷[22]。Jiang等[23]鉴定三叶木通中的9种花色苷,主要是矢车菊素-3-O-(对香豆酰基)芸香糖苷、矢车菊素-3-O-(6″乙酰基)葡萄糖苷和天竺葵素-3-O-阿拉伯糖苷,试验表明三叶木通花色苷具有较高的自由基清除活性、还原力、酪氨酸酶抑制活性和显著的α-淀粉酶抑制活性。
植物中花色苷资源十分丰富,其中水果类中的浆果为花色苷的主要来源,如葡萄、桑椹、蓝莓和草莓等中均含有丰富的花色苷。但不同植物来源花色苷种类各不相同,有的仅含有几种花色苷,如桑椹[9],主要花色苷为矢车菊素-3-O-葡萄糖苷及矢车菊素-3-O-芸香糖苷;有的则含多种花色苷,如葡萄果皮中含有33种花色苷[10]以及红甘蓝中含有29种花色苷[16]等。从植物花色苷的资源分布来看,矢车菊素类花色苷是植物中最主要的花色苷组分;酰化花色苷比未酰化花色苷更稳定,更具有耐热、耐光、耐碱性等优势,蔬菜类中叶菜及根茎类中酰化花色苷较为常见,如紫甘蓝、马铃薯、黑胡萝卜等,在食品添加剂、着色剂等领域具有良好的开发潜力;半乳糖苷较葡萄糖苷不稳定,但生物活性更高,如黑果腺肋花楸、山楂、黑胡萝卜等花色苷主要为半乳糖苷,在医药、功能性食品等领域具有良好的开发利用价值。花色苷不仅是天然的着色剂,更是未来功能性食品添加剂的重要资源,进一步开发经济环保的花色苷资源,优化提取纯化应用等技术,不断加大我国丰富花色苷资源的利用率。
2 植物花色苷的提取方法
花色苷的高效提取是进行产业化应用的重要前提,不同植物来源花色苷在结构和性质上存在差异,其提取方法也不尽相同,提取效率成了其规模制备的难点之一。近年来有关花色苷提取方法研究的报道较多,是花色苷研究领域的热点问题,多种新技术应用于花色苷的提取中,同时,传统方法也与多种辅助手段联用提高了花色苷的得率。不同溶剂提取花色苷条件、提取率、花色苷来源及种类见表1。
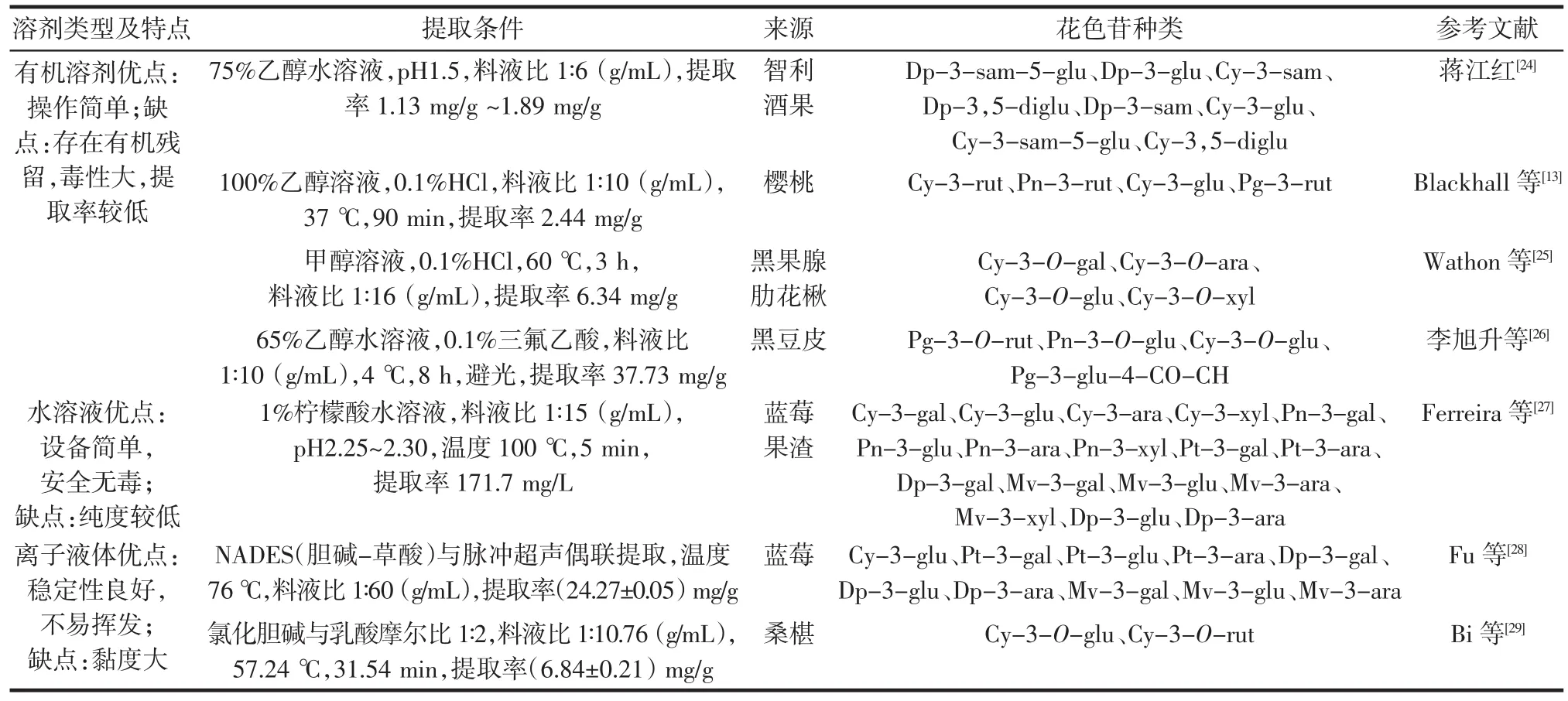
表1 不同溶剂提取花色苷条件、提取率、花色苷来源及种类Table 1 Different solvents extraction conditions of anthocyanins,extraction yield and source and types of anthocyanins
2.1 溶剂提取法
溶剂提取法是提取花色苷的常用方法,其原理是根据植物中各种成分在溶剂中的溶解性质,选择对花色苷溶解度大,对其他杂质溶解度小的溶剂。常用溶剂包括水、甲醇、乙醇、丙酮等,常通过加酸来调节体系pH值以防止花色苷的降解[2]。溶剂提取法成本低,工艺简单,但提取时间较长,溶剂消耗高,存在溶剂残留问题。
2.1.1 有机溶剂提取
有机溶剂提取法是应用最广泛的提取方法之一,方法简单,关键是选择合适的溶剂提取,要求既能很好地溶解被提取的有效成分,又能避免溶解杂质。何丹等[30]以60% 的酸性乙醇溶液为溶剂于黑暗环境下提取西番莲果皮中的花色苷,共鉴定出12种花色苷。Dzhanfezova等[11]使用70% 乙醇溶液提取酸化草莓匀浆中的花色苷,测定了18种草莓品种的花色苷含量。Mugwagwa等[12]使用67.45% 酸化乙醇溶液提取芒果中的花色苷,测定了其花色苷含量为0.223 mg/g。该法简单易行,常用甲醇、乙醇、丙酮以及其混合溶剂作为提取溶剂,甲醇和丙酮提取效果良好,丙酮可以较好地保持花色苷结构,便于液相色谱结构分析,但常因其毒性而使用较少,酸性乙醇溶液应用最广泛[2,14],通常选择HCl调节至pH2.0~3.0的60% ~80% 乙醇溶液作为提取溶剂。该法应用较为普遍,但相对产物提取率低且存在有机溶剂残留等缺点。
2.1.2 水溶液提取
水是花色苷类物质的良好溶剂,而且不存在有机溶剂的残留问题,具有安全易得的特点,通常是在大气压或高压下使用热水浸泡原料,用非极性大孔树脂吸附或直接使用脱氧热水提取,再采用超滤或反渗透得到粗提物。Valencia-Arredondo等[31]提出了从红甘蓝叶中分离和纯化花色苷的两个阶段的整合。第一阶段花色苷提取过程,以酸化水(0.05 mol/L,H3PO4)作为提取剂,保持 pH1.0~3.0,提取温度 22℃~26℃,料液比为1∶10(g/mL),提取 12 h,经过微滤、超滤和吸附过程后,矢车菊素-3-葡萄糖苷含量为32.05 mg/mL。温春燕等[32]优化仙人掌果花色苷提取工艺,最佳条件:pH7.5的水溶液,料液比 1∶20(g/mL),30 ℃下,浸提 10 min,提取率可达7.75% 。水溶液提取法设备简单,产品无毒,但纯度相对较低,目前工业化大规模生产中较为推荐使用柠檬酸酸化的水溶液作为提取溶剂,经济环保且安全无毒。
2.1.3 离子液体提取
有机溶剂的毒性和易燃易爆性限制溶剂提取法的应用,因此最大限度减少危险化学品使用的新产品、新工艺和新技术的开发成为当前研究的方向。离子液体是近年来被人类发现的新型介质,为常温下呈液态的盐,常由有机阳离子如1,3-二烷基咪唑、烷基铵、烷基膦或烷基吡啶以及小的无机阴离子,如PF6-、AlCl4-、ClO4-、BF4-、NO3-或有机阴离子如 CH3COO-、CF3COO-、CF3SO3-等构成,因其具有化学稳定性、热稳定性良好、不易挥发且可以重复使用等优点,常作为辅助剂被用于萃取分离领域。王菲菲等[33]研究了离子液体(1-丁基-3-甲基咪唑(1-n-butyl-3-methylimidazolium,[BMIM]),pH6) 辅助乙醇法提取山楂花色苷,[BMIM]为疏水性离子液体,而山楂红色素是亲水性的,易溶于乙醇,优化获得最佳工艺条件:离子液体用量为 15% ,料液比 1∶4.3(g/mL),溶液 pH1.1,60 ℃下提取59 min,得到山楂红色素提取含量的吸光度为1.279。离子液体具有极性可调控、热稳定性好、液态范围宽、蒸汽压小等特点,最常用作溶剂的中性离子液体有1-丁基-3-甲基咪唑四氟硼酸盐(1-n-butyl-3-methylimidazolium tetrafluoroborate,[BMIM][BF4])和 1-丁基-3-甲基咪唑六氟磷酸盐(1-n-butyl-3-methylimidazolium hexafluorophosphate,[BMIM][PF6]),但溶剂体系中离子液体含量越高,疏水性越强,会增加提取剂的黏度,从而减小花色苷的扩散能力,进而导致提取率下降,因此用量不宜过高。
近年来,低共熔溶剂(deep eutectic solvent,DES)因具有非挥发性、不可燃、稳定和可再生利用等优点成为溶剂工程研究中的热点,作为一种新型的离子液体,DES溶剂在花色苷提取中具有多种优势。DES溶剂通常与微波辅助提取和超声辅助提取相结合并用于花色苷的提取。糖、糖醇、有机酸和氨基酸等天然初级代谢物是制造天然低共熔溶剂(natural deep eutectic solvents,NADES)的丰富来源,Guo 等[34]采用 NADES 结合高速均质和负压空化技术对桑椹中的花色苷进行了高效萃取,根据提取产物的理化性质、花色苷回收率和稳定性等指标,从8种不同的NADES中筛选出氯化胆碱-柠檬酸-葡萄糖以1∶1∶1的摩尔比形成的最佳NADES,含水量30% (质量比),并研究了多模微波、低频超声单独或联合使用对花色苷提取率的影响。Da silva等[35]采用单纯形质心设计法对NADES提取蓝莓花色苷的工艺进行了优化,以氯化胆碱、甘油和柠檬酸为原料,确定最佳溶剂摩尔比为0.5∶2∶0.5,研究表明NADES产生的蓝莓生物相容性提取物能选择性地富集阿拉伯糖苷花色苷,是一种比有机溶剂更经济更绿色的替代品。Bosiljkov等[36]开展了利用NADES溶剂并结合超声辅助方法提取酒糟中花色苷的研究,结果表明氯化胆碱-苹果酸为最佳NADES,含水量为35.4% (质量比),较酸化乙醇可以更有效地提取酒糟花色苷。NADES提取通常选择氯化物为基础,柠檬酸等作为氢键供体,含水量在30% (质量比)左右,NADES目前已被用作提取食品香精、香料和染料、药物、化妆品的绿色溶剂,广泛应用于制药、食品和化妆品等行业。
2.1.4 其他非常规溶剂
杨三维等[37]采用改良十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB) 法提取紫粒小麦麸皮花色苷,CTAB 23 g,乙二胺四乙酸二钠3 g,蔗糖5 g,柠檬酸6 g,定容至1 L,结果表明,料液比为1∶3(g/mL)时,花色苷得率为 3.20 mg/g,其花色苷体外抗氧化活性高,在抗氧化功能性食品或添加剂方面具有极大的应用潜力。CTAB法可温和高效地破除植物细胞壁,多用于植物DNA的提取,改良CTAB提取法易于操作,提取过程中添加多糖和淀粉可大大提高花色苷的纯度,重金属含量低,符合国家食品药品相关标准,目前在花色苷提取方面应用较少,有巨大的开发应用价值。
Zuleta-Correa等[38]评价和比较了常用的酸化溶剂和模拟生物质发酵的非常规丙酮-丁醇-乙醇混合物对紫薯中花色苷的提取性能。结果表明,不同的溶剂导致提取物的花色苷组成不同,特别是与其他溶剂相比,富含丁醇的提取物芍药苷/花色苷比值更高。考虑到通过发酵生物质衍生的糖来生产花色苷的可能性,溶剂混合物可能是花色苷提取的一种可持续的替代品。
2.2 超声波辅助提取
超声波辅助提取是经典提取技术之一,其原理为利用超声波产生空化气泡,碰撞产生具有更高温度和压力的热点/微喷射,从而更有效地提取花色苷。花色苷超声辅助提取条件、提取率、花色苷来源及种类见表2。
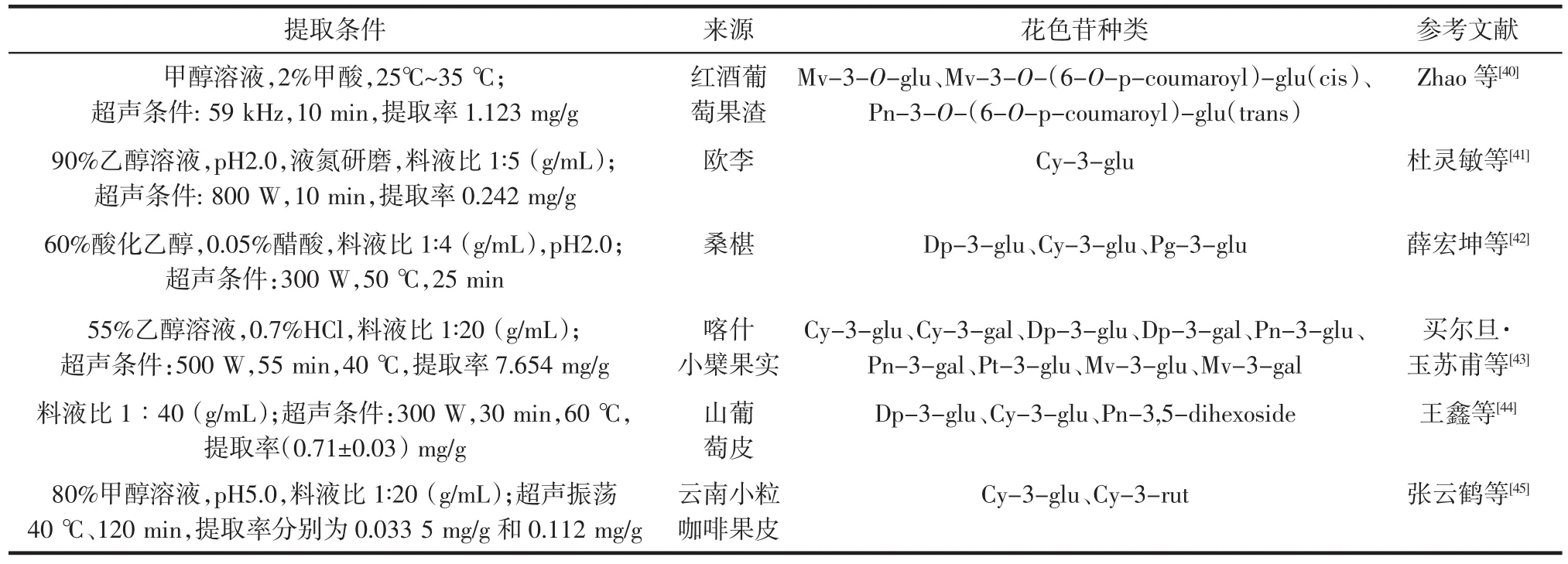
表2 花色苷超声辅助提取条件、提取率、花色苷来源及种类Table 2 Anthocyanins ultrasonic assisted extraction conditions,extraction yield and source and types of anthocyanins
Chen等[3]利用响应面法优化了茜草果实的总花色苷的超声辅助提取工艺,最佳提取条件:30% 乙醇溶液,pH3.0,超声功率 400 W,料液比 1∶20(g/mL),55 ℃,提取 20 min,总花色苷提取率(22.50±0.89)mg/g。 Ochoa等[39]研究了温度、提取时间、振幅和醇水比对紫薯花色苷提取效果的影响,确定最佳提取条件为80% 乙醇溶液、振幅60% 、60℃提取10 min。结果表明,超声波辅助法提取效果优于传统的低压溶剂萃取和索氏萃取提取工艺。超声辅助提取溶剂使用量少,提取效果较好,能耗低,易于扩大规模,适用于食品行业,但提取过程中温度易升高,植物花色苷对温度敏感,高温易降解,因此应注意超声处理时间不宜过长,一般为10min~30 min,目前该法广泛应用于各种植物花色苷的提取。
2.3 微波辅助提取法
微波辅助提取原理是在微波加热过程中,原材料细胞中的小分子随着吸收热量,细胞温度升高,细胞中液态水汽化产生水蒸气,细胞内部压力增加而发生破裂,通过细胞的破裂作用使提取溶剂更易进入到细胞内部,便于细胞内花色苷溶出,从而提高花色苷提取效率。Liu等[46]提出了一种两级输入功率的变功率微波辅助提取方法,第一阶段微波功率为700W~1100W,第二阶段微波功率为100 W~500 W,从第一阶段到第二阶段的过渡温度为30℃~46℃。第一级高功率破碎蓝莓细胞壁,第二级低功率保持较高的花色苷得率,最佳条件下的花色苷提取率达84.82% 。张帅等[47]研究红凤菜花色苷,对比微波辅助、超声波辅助和传统水浴提取的不同影响,传统水浴法成本低,工艺简单,产品色价高,而微波辅助提取速度优势显著。超声波辅助法提取率最高,但色价最低,品质低,与微波辅助法相比提取效率并无优势。袁媛等[48]对比桃金娘花色苷3种提取方法,结果表明提取花色苷的含量顺序:微波辅助>超声波辅助>浸提,且微波辅助提取法能更好地提取桃金娘果实中的抗氧化物质。该法省时、高效、节能,适合工业化放大生产,但因其具有明显热效应,较适用于受温度影响较小的物料。花色苷微波辅助提取条件、提取率、花色苷来源及种类见表3。

表3 花色苷微波辅助提取条件、提取率、花色苷来源及种类Table 3 Anthocyanins microwave assisted extraction conditions,extraction yield and the source and types of anthocyanins
2.4 超临界、亚临界流体萃取法
超临界流体具有良好的溶剂性质,是一种介于气、液体间的既非气体又非液体的状态,具有类似于气体的强穿透力和类似于液体的高密度和溶解度,是一种极具潜力的花色苷提取方法。亚临界水萃取利用处于亚临界状态的水进行萃取,亚临界状态代表100℃~374℃之间的液态水,水的加压方式使其保持液态,水在较高压力和温度下(低于临界点)的这种状态称为亚临界状态,这有利于所需化合物在溶剂中的溶解度和扩散性。Babova等[54]研究以乙醇为溶剂,使用超临界/亚临界CO2分步萃取法提取越桔中的花色苷,采用超临界CO2对越桔进行预处理提高花色苷提取率,再用极性溶剂进行亚临界CO2选择性提取富含花色苷的官能团,所得花色苷具有较高的抗氧化活性,其生物活性在医药和营养食品中具有重要的应用价值。秦公伟等[55]采用超临界CO2萃取技术提取蓝莓果渣中的花色苷,最佳条件:萃取压力34.7 MPa,CO2流率 4.5 L/min,40℃,萃取 1.86 h,花色苷得率 1.48 mg/g。超临界二氧化碳萃取安全无毒,化学性质稳定,有利于花色苷生物活性和功效的保持,二氧化碳能循环利用,降低成本,为可持续应用的高效萃取技术,在食品、医药、日化等领域均能广泛应用。
2.5 加压液体萃取法
近年来,随着高压设备的应用不断增多,采用加压液体萃取植物活性物质的研究也越来越多。加压液体萃取是最佳提取技术之一。其原理是利用高压提高萃取溶剂沸点,降低水的极性,增大提取物质在溶剂中的溶解度,进而促使花色苷被更有效的萃取出来,提升萃取效率。Truong等[56]优化加压液体萃取法从紫肉甘薯中提取花色苷的工艺条件,在醋酸∶甲醇∶水=7∶75∶18(体积比)、样品重量<0.5 g、温度 80 ℃~120℃的条件下,花色苷得率最高。该法需要溶剂较少,提取率高,可快速萃取化合物,提取时间短,但成本相对较高。
2.6 其他辅助提取法
液态高静压辅助提取法和高压脉冲电场辅助提取法属于新兴的食品工业技术,原理都是利用高压的作用使细胞的通透性增加,以此加快细胞内花色苷的释放,以便于有机溶剂的进入,从而提升花色苷的提取效率。马懿等[57]采用高压脉冲电场辅助法提取紫薯酒渣中的花色苷,得到最佳提取条件为电场强度18.3kV/cm、脉冲数9.3,花色苷提取含量0.64 mg/g,该法操作简单,提取剂用量小,提取时间短,能有效降低活性物质的损失。
为了提升植物来源花色苷的提取率,将植物细胞壁破坏,促使更多的花色苷物质溶出的酶提取法是目前常用的提取方法,一般采用果胶酶、纤维素酶等。Zhang等[58]采用酶处理结合超声波辅助法进行了桑椹酒渣中花色苷的提取工艺研究,通过优化设计确定了最佳工艺条件:提取温度52℃,超声波功率315 W,果胶酶和果胶复合酶加酶量0.22% ,提取时间94 min,此时花色苷产率可达5.98 mg/g。Jiang等[23]提出了一种射频加热辅助酶法提取三叶木通花色苷的新工艺,最佳提取条件:纤维素酶与果胶酶质量比1∶1,酶浓度1.0% ,pH4.0,乙醇浓度 50% ,料液比 1∶50(g/mL),电极间距5 cm,40℃射频预处理10 min。结果表明与热水、酸化乙醇和酶(果胶酶、纤维素酶)提取相比,射频辅助酶法提取的花色苷含量最高。酶提取法快速高效,能有效去除果胶、淀粉等杂质,但酶活性条件苛刻,较难应用到实际生产中。
随着科技不断发展,花色苷提取技术越来越先进,不同的提取方法各有所长,但日常应用最广泛的仍是溶剂提取法。花色苷提取方法相关研究主要围绕开发更加绿色高效的良好溶剂以及不断创新提取辅助手段两个方面,目前多种方法联合辅助提取的相关研究较多,各方法取长补短,以期使提取质量和效率最大化。
3 总结与展望
我国拥有丰富的植物花色苷来源,如葡萄、桑椹、玫瑰茄、紫甘薯、黑米、黑果枸杞等,由于受到传统提取方法限制,许多花色苷资源没有得到规模化开发和利用。近年来,随着对人工合成色素为人体健康带来风险的认识越来越重视,加上人们对天然色素的功能性价值的认可和选择偏好,天然来源的花色苷等色素深受消费者青睐,国内外在天然植物花色苷的保健与医药研究中的发展非常迅速,越来越多的植物花色苷被分离鉴定和开发利用。目前,多种新兴分离设备和技术手段不断应用于花色苷的提取分离,如亚临界水溶液提取法、超高压辅助提取法、高压脉冲电场辅助提取法等,多种提取技术的联合使用也显著提升了花色苷的提取效率,为花色苷资源的进一步开发利用奠定了基础。
花色苷种类及其含量因不同植物类别和提取方法等而有所不同,对现有花色苷植物资源及分布和花色苷种类进行全面综述,比较分析不同来源花色苷的提取方法,可为进一步资源挖掘利用和提升植物花色苷的提取提供有益参考。未来花色苷研究的主要思路:一是花色苷提取所需原料的创新,我国富含花色苷的植物资源异常丰富,但不同来源植物的花色苷种类和含量存在显著差异,花色苷种类的差异影响其保健功能的发挥,含量的差异影响其工业化提取成本,因此有必要通过研究寻找适合规模化提取的原料,并通过园艺性状改良和田间种植管理等措施进一步提升植物中花色苷含量,提高其经济价值;二是原材料预处理技术的创新,通过高效破壁技术、酶解技术、高静水压处理等方法对植物细胞壁进行深度破坏,有利于植物花色苷物质的释放和溶出,提升花色苷的提取效率;三是花色苷提取手段的创新,一方面对现有提取设备和技术手段进行工艺优化和技术提升,创新合成新型溶剂体系、探索不同提取条件、构建环境友好模式,提高花色苷得率,另一方面是多种新型技术的联合使用,显著提高花色苷稳定性,并降低提取过程中花色苷降解和转化带来的损失,各种提取技术应有利于后期分离纯化,从而使其满足更多领域的需求,开发出更加高效、环保、节能、经济的花色苷提取分离方法,从而使花色苷得到更加广泛的应用,为人们的健康生活带来更多助益。
