基于超声法通透化处理提高静息细胞转化苯丙氨酸合成苯乳酸产量
2022-08-24侯颖刘洋王浩源刘杨韬孙宇婷张荣飞周中凯张守庆谭之磊贾士儒
侯颖,刘洋,王浩源,刘杨韬,孙宇婷,张荣飞,周中凯,张守庆,谭之磊,贾士儒*
(1.天津科技大学生物工程学院,天津 300457;2.天津天隆农业科技有限公司,天津 300457;3.天津科技大学食品科学与工程学院,天津 300457;4.中科蓝海测试(天津)科技有限公司,天津 300457)
苯乳酸(phenyllactic acid,PLA)被认为是一种有效的抗菌化合物,对细菌和真菌具有广谱抑菌作用,因此被用作抗菌剂、食品防腐剂和风味化合物[1]。PLA的生物合成方法主要包括微生物发酵和酶促/静息细胞转化。多种乳酸菌均具有PLA合成能力,Lactobacillus plantarum AB-1、Lactobacillus plantarum UN-30 和 Lactobacillus plantarum BLPC002在Man-Rogosa-Sharpe(MRS)培养基中发酵,PLA产量分别达到(252.44±2.63)mg/L[2]、2 930 mg/L[3]和 1.67 g/L[4]。 但是由于代谢路线较长,关键酶活性低,发酵法产量较低,难以工业化生产。
与纯酶催化法相比,静息细胞转化法具有无需进行酶的纯化、酶稳定性高、细胞可重复使用、产品易于分离等优点[5]。然而,静息细胞的细胞结构阻碍了细胞催化剂的快速反应。如,大肠杆菌的细胞膜分为外膜和内膜,外膜约为6.7 μm2,含有3.5×106个脂多糖分子,占据细菌表面的四分之三,密集组装的脂多糖是底物和产物转运的重要屏障[6],导致游离酶催化比细胞催化速率高10倍~100倍。因此,必须制备通透性提高的静息细胞,以增加细胞膜的通透性,降低细胞的屏障效应及传质阻力,在保持细胞活性的同时提高催化反应速率。
超声波是频率大于20 kHz的声波,具有波动和能量的双重特性。低频超声一般在20 kHz~50 kHz之间,高频超声一般大于50 kHz[7]。在生物领域,高频高强度超声一般会造成细胞结构发生剧烈的不可逆破坏,用于细胞破碎等高强度处理过程;而低频低强度超声借助超声波的传输引起细胞膜和细胞壁附近介质的振动,因此会对细胞结构造成轻微可逆性改变,可用于增强酶活性、代谢效率、细胞传质效率。有研究表明用20 kHz低频率超声处理使酵母细胞生长停滞期减少1 h[7]。Ewe等[8-9]对豆浆中的乳酸杆菌属进行超声处理(30 kHz、100 W),促进了乳酸杆菌的生长,β-葡萄糖苷酶活性提高了10% 。
前期研究中,我们构建了共表达L-氨基酸脱氨酶(L-amino acid deaminase,L-AAD)、乳酸脱氢酶(lactate dehydrogenase,LDH)和甲酸脱氢酶(formate dehydrogenase,FDH)的重组 Escherichia coli静息细胞,催化底物苯丙氨酸(phenylalanine,PHE)生成中间体苯丙酮酸(phenylpyruvic acid,PPA),然后最终合成PLA。通过定向进化和定点突变结合高通量筛选,得到了底物结合能力和催化效率显著提高的Proteus mirabilis来源的L-AAD突变体[10];通过共线性分析及系统生物学的方法对LDH进行筛选,确定Lactobacillus CGMCC 9967来源的乳酸脱氢酶为最佳LDH[11];通过消除PPA降解副反应,敲除E.coli胞内存在的3种催化PPA降解的转氨酶[12],辅酶合成和再生途径改造[13],及在转录水平和翻译水平调节3种酶的表达量,PLA产量提高至43.8 g/L,这是现有报道中静息细胞催化合成PLA的较高产量[14]。但是难以进一步提高PLA产量和底物转化率,距离工业化仍有很大差距。
根据文献报道,LDH和FDH均位于细胞质中[15-16]。根据预测软件 TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM-2.0),P.mirabilis来源的 L-AAD是一种II型单次跨膜蛋白,氨基酸残基1-6位于胞质,残基7-29形成单跨膜螺旋穿过细胞膜,残基30-471位于胞外。此外Hossain等[17]为了确定L-AAD的C末端还是N末端位于细胞膜外侧,分别构建了含有外侧向外和内侧向外囊泡的重组静息细胞催化剂,发现只有外侧向外囊泡的重组静息细胞具有脱氨酶活性,这一结果初步证明了软件预测结果的正确性。因此推测,静息细胞催化过程中底物PHE、中间体PPA和产物PLA 3种物质跨膜转运过程:在细胞外,膜蛋白酶L-AAD催化底物PHE合成中间体PPA,PPA在膜上转运蛋白作用下转运进入胞内;在细胞内,LDH和FDH催化PPA合成PLA;胞内的PLA在膜上转运蛋白作用下转运到胞外。底物和产物的转运可能是影响静息细胞催化的限制性因素,难以进一步提高PLA产量和底物转化率。
为了提高底物和产物转运速率,本研究首先对超声破碎条件进行优化,得到细胞通透能力显著提高的静息细胞,然后对静息细胞催化条件进行优化,最后研究催化过程中胞内PHE、PPA和PLA浓度变化,确定超声对底物和产物转运速率的影响。
1 材料与方法
1.1 材料
前期研究中构建的重组E.coli BL21(pRSFDuet-2ldh-rbs2aad-fdh)作为静息细胞催化剂[18]。胰蛋白胨、酵母粉、琼脂:赛默飞世尔科技公司;氯化钠(分析级):国药集团化学试剂有限公司。
LB(Luria-Bertani)液体培养基:胰蛋白胨 10 g/L,酵母提取物 5 g/L,NaCl 10 g/L, 卡那霉素 100 μg/mL,pH7.4,121 ℃灭菌 20 min;TB(Terrific Broth)培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,磷酸盐缓冲液(phosphate buffer saline,PBS)100 mmol/L, 无氨基酵母氮源13.4 g/L,生物素4×10-4g/L,甲醇1% (体积分数),pH7.4,121 ℃灭菌 20 min;PBS 缓冲液:NaCl 8 g/L,KCl 0.2 g/L,Na2HPO41.44 g/L,KH2PO40.24 g/L,pH7.4。
1.2 仪器与设备
JY88-IIN超声破碎仪(总功率为1 000 W):中国新芝公司;TZ9S紫外可见分光光度计:上海精科实业有限公司;DNP-9162微生物恒温培养箱:苏州威尔实验用品有限公司;CR21G高速冷冻离心机:日本Hitachi公司;UV-2550紫外-可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 静息细胞催化剂制备
从甘油管中吸取少量菌液置于LB摇菌管中,37℃,220 r/min的条件下培养10 h,以1% (体积分数)的接种量接种于100 mL TB培养基(含100 μg/mL卡那霉素),37℃,220 r/min培养至OD600为0.5左右,添加诱导剂异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG) 至终浓度为 0.04 mmol/L,于 20℃、220 r/min诱导表达 10 h~12 h。 8 000 r/min、4℃离心10 min并弃掉上清液。用PBS缓冲液对菌体细胞进行洗涤和重悬,8 000 r/min离心10 min弃掉上清液。根据具体试验需求重悬并调整OD600。
1.3.2 超声通透化处理优化
选择操作频率为20 kHz~25 kHz的超声破碎仪对培养好的静息细胞催化剂进行超声处理。所有超声试验均保证使用Φ6的超声探头深入到PBS静息细胞催化剂中悬液液面以下3 cm处。为防止超声时产生的热量破坏细胞催化剂,超声试验在冰盒中进行。
超声通透化处理过程中主要影响因素有超声波功率、处理时间和占空比等。为了得到最佳的超声处理条件,以超声波功率(1% 、10% 、20% 、30% 、40% )、处理时间(30、60、120 s)和占空比(50% 、60% 、70% 、80% 、90% )作为考察因素,以苯乳酸浓度作为试验指标进行优化试验。
1.3.3 细胞催化条件优化
在超声通透化处理条件得到优化的基础上,以温度(25、30、35、40、45 ℃)、pH 值(5、6、7、8、9)、缓冲液种类(PBS、生理盐水、水)为考察因素,同样以苯乳酸产量作为试验指标,逐步减小试验梯度,进行细胞催化条件的优化试验。
1.3.4 细胞蛋白及核酸透性检测
细胞核酸增强率(R1)按式(1)计算。
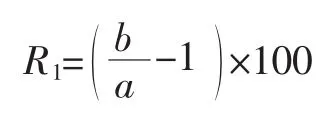
式中:a为260 nm波长下未超声波处理的细胞悬液上清液的吸光值;b为260 nm波长下超声处理后的细胞悬液上清液的吸光值。
细胞蛋白增强率(R2)按式(2)计算。
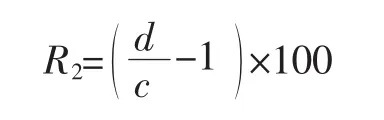
式中:c为280 nm波长下未超声波处理的细胞悬液上清液的吸光值;d为280 nm波长下超声处理后的细胞悬液上清液的吸光值。
1.3.5 PHE、PPA和PLA的检测方法
参考Valerio等[19]的方法,适当修改。HPLC条件:选用安捷伦反相色谱柱ZORBOX SB-C18,进样量为10 μL,流动相为水(A)和甲醇(B),梯度洗脱程序为 0~20 min由10% B线性变化至100% ,20 min~23 min保持 100% B,23 min~25 min由 100% B 线性变化至10% 。流速为1 mL/min,检测波长210 nm,柱温30℃。
1.4 数据处理
采用PASW Statistics 18、Origin和Excel对数据进行统计分析。
2 结果与分析
2.1 超声通透化处理条件优化
超声通透化处理占空比、功率对PLA浓度的影响如图1所示。
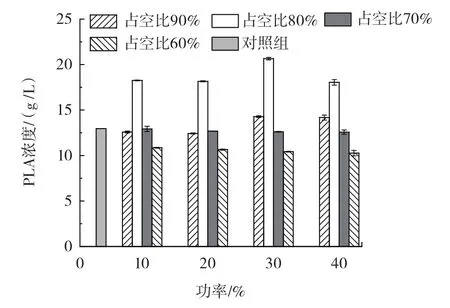
图1 占空比、功率对PLA浓度的影响
设定处理时间为1 min,未超声处理对照组PLA浓度为12.96 g/L,首先对超声通透化占空比和功率进行优化。由图1可知,当占空比为80% 时,PLA浓度普遍高于其他的占空比的组别。当功率为30% ,占空比为80% 时PLA浓度最高,为20.65 g/L,是占空比60% 、70% 和90% 的1.96倍、1.61倍和1.47倍,比对照组提高了37.53% 。当占空比低到60% 时,PLA浓度低于对照组。
由于功率和占空比对于细胞通透性的重要性,基于上述优化的初步结果,将超声功率范围缩小到30% 附近,占空比范围缩小到80% 附近进一步优化这两个条件。结果见图2。
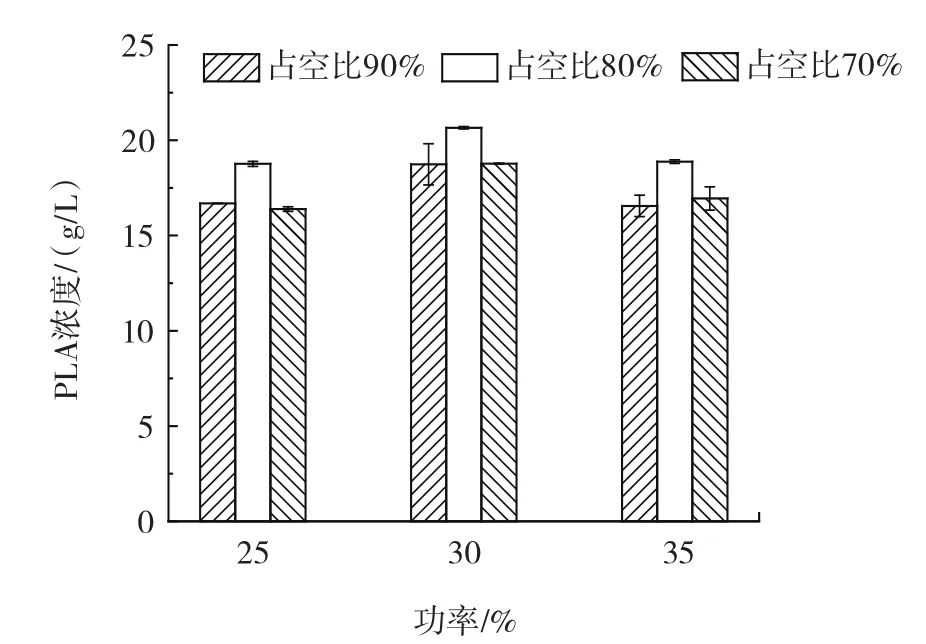
图2 功率和占空比对PLA浓度的影响Fig.2 Effect of power and duty cycle on PLA concentration
如图2所示,占空比为80% 时,功率30% PLA浓度是功率25% 和35% 的1.1倍和1.08倍。功率为30% 时,占空比80% PLA浓度是占空比70% 和90% 的1.09倍和1.1倍。
同时改变功率和超声时间对PLA浓度的影响如图3所示。
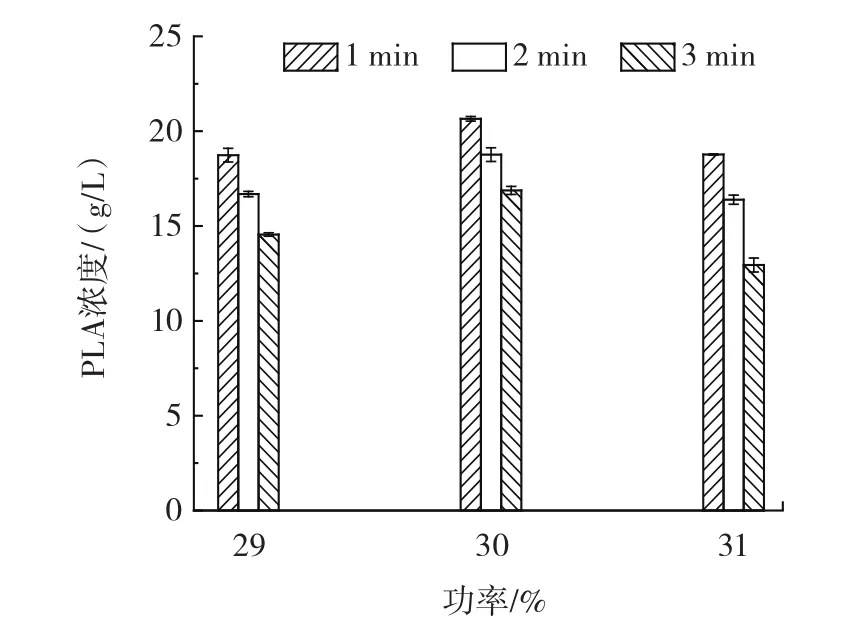
图3 功率和时间对PLA浓度的影响Fig.3 Effect of power and time on PLA concentration
由图3可知,功率为30% ,超声时间为1 min时PLA浓度相较于功率为29% 和31% 分别提高9.5% 和9.1% 。且超声处理时间越长PLA浓度越低,功率为30% 时延长处理时间至2 min和3 min时PLA浓度是超声1 min的93.2% 和91.6% 。因此,超声通透化处理最佳条件为处理时间1 min、占空比80% 、功率30% 。在此最优条件下,PHE初始浓度为30 g/L,PLA浓度达到20.65 g/L,底物转化率为68.4% ,是未超声处理的1.59倍。
2.2 通透化细胞催化条件优化
通过超声通透化处理后,静息细胞结构发生变化,其催化条件也可能发生改变。因此以未超声处理为对照组,对催化条件(pH值、温度、缓冲液)进行优化,结果见图4~图6。
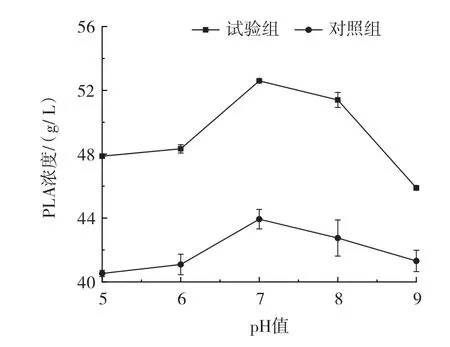
图4 pH值对PLA浓度的影响Fig.4 Effect of pH value on PLA concentration

图5 温度对PLA浓度的影响Fig.5 Effect of temperature on PLA concentration
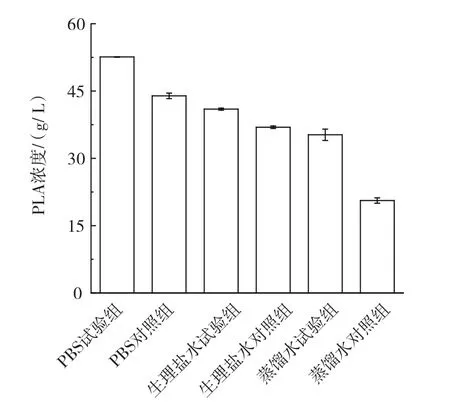
图6 缓冲液对PLA浓度的影响Fig.6 Effect of buffer on PLA concentration
由图4可知,不同pH值下经最优超声条件处理的试验组PLA浓度均高于相应对照组,且在pH7时试验组和对照组PLA浓度达到最大,分别为52.59 g/L和43.93 g/L。以试验组为例,随着pH值提高,PLA浓度先升高后降低,pH7时PLA浓度达到最高,是pH6时的1.09倍。进一步提高pH值为9时,PLA浓度降低为最高浓度的87.3% 。结果表明,试验组和对照组在不同pH值条件下PLA浓度变化趋势相同,且超声通透作用并未改变通透化静息细胞的较佳pH值,其较适pH值为7。
如图5所示,试验组和对照组PLA浓度随温度变化趋势相同,且不同温度下超声处理的试验组PLA浓度均高于相应对照组。随着催化温度提高,PLA浓度先升高后降低,35℃时,试验组和对照组PLA浓度达到最高,试验组PLA浓度(52.59 g/L)是对照组(43.93 g/L)的1.2倍;试验组和对照组35℃时PLA浓度是30℃时的1.16倍和1.25倍。随着催化温度进一步提高,PLA浓度降低,40℃时试验组和对照组PLA浓度比35℃分别降低4.9% 和9.1% 。结果表明,超声通透作用并未改变通透化静息细胞的最适温度,较适温度为35℃。
如图6所示,使用PBS缓冲液洗涤细胞并作为超声组催化缓冲液时PLA浓度最高,是使用生理盐水和蒸馏水时PLA浓度的1.28倍和1.49倍。说明缓冲液类型也会影响静息细胞催化状态。因此PBS是最合适的静息细胞洗涤和催化缓冲液。
综上,最优通透化细胞操作和催化条件:在PBS缓冲液(pH7,35℃)中洗涤并重悬细胞,然后加入底物,在pH7,35℃下催化。在最佳催化条件下,PLA浓度从43.93 g/L提高到52.59 g/L,是原来的1.2倍,底物转化率从78.70% 提高到94.59% 。
2.3 超声处理对静息细胞底物和产物转运速率的影响
根据超声处理对PLA浓度和底物转化率的影响,推断超声处理影响了静息细胞底物和产物转运速率。为了验证推断,检测催化过程中3种物质在胞内胞外的浓度变化情况并分别进行比较。以未超声处理为对照组,以最优超声条件处理为试验组,在相同最优静息细胞催化条件下进行催化,结果见图7、图8。

图7 静息细胞催化过程中胞外PHE、PPA和PLA浓度变化Fig.7 Changes in the concentrations of extracellular PHE,PPA and PLA
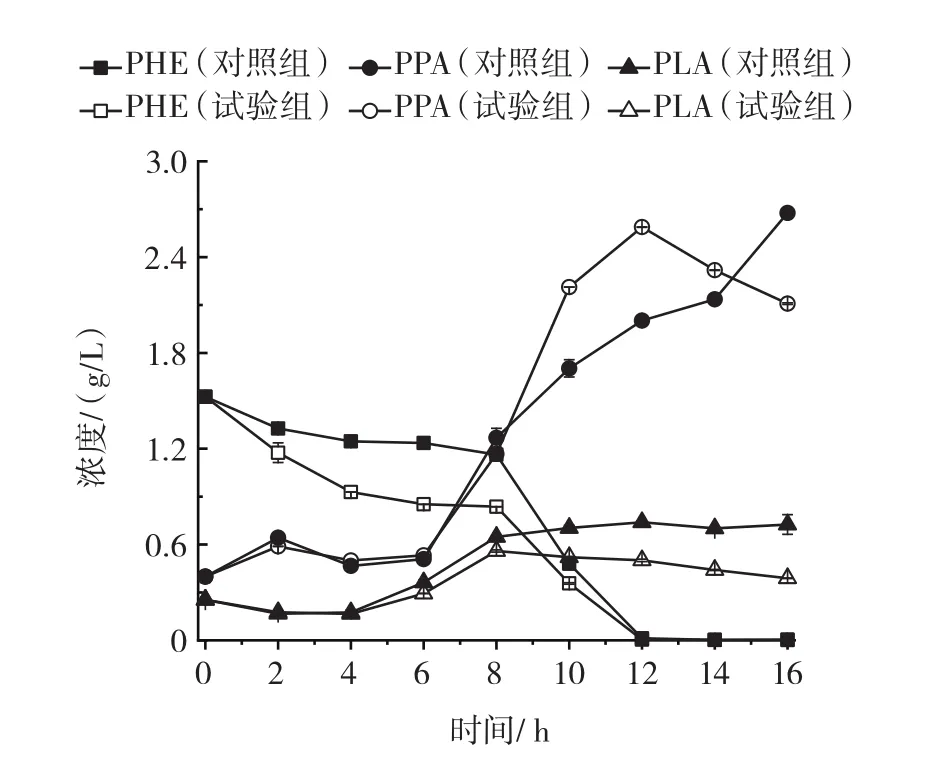
图8 静息细胞催化过程中胞内PHE、PPA和PLA浓度变化Fig.8 Changes in the concentrations of intracellular PHE,PPA and PLA
如图7所示,胞外PHE初始浓度为60 g/L,0~8 h,PHE浓度迅速降低,此期间试验组胞外的PHE浓度一直低于对照组,6 h时试验组和对照组胞外的PHE浓度差距最大,6 h时试验组胞外的PHE浓度是对照组的56.8% ,说明超声处理提高了胞外PHE的消耗速率。如图8所示,0~8 h期间试验组胞内的PHE浓度一直低于对照组,6 h时试验组和对照组胞内的PHE浓度差距最大,6 h时试验组胞内的PHE浓度是对照组的58.9% 。结合胞内外PHE浓度变化趋势结果,又由于低频超声对蛋白结构影响可能性不大,说明超声处理提高了底物PHE由胞外向胞内的转运速率。
如图7所示,0~8 h,PPA浓度升高较快,此期间试验组胞外的PPA浓度一直低于对照组,12 h时试验组和对照组胞外的PPA浓度差距最大,12 h时试验组胞外的PPA浓度是对照组的40% 。如图8所示,随时间延长胞内PPA浓度逐渐提高,催化前期0~8 h内,试验组和对照组胞内PPA浓度基本相同,可能是由于催化前期L-AAD氧化脱氨基反应速率是反应限制性因素,胞外积累的PPA浓度较低,向胞内转运的PPA较低,因此试验组和对照组PPA浓度差距不大。10h~14h,试验组胞内PPA浓度明显高于对照组,12 h时,试验组和对照组胞内的PPA浓度差距最大,12 h时试验组胞内PPA浓度是对照组的1.29倍。结合胞内外PPA浓度变化趋势结果,说明超声处理提高了中间体PPA由胞外向胞内的转运速率。
如图7所示,0~8 h,PLA浓度迅速提高,14 h时,对照组PLA浓度达到最高,为43.93 g/L;12 h时,试验组PLA浓度达到最高,为52.59 g/L。6 h时,对照组和试验组PLA浓度差距最大,试验组PLA浓度是对照组的1.49倍。如图8所示,0~8 h,对照组和试验组胞内PLA浓度差距不大,可能是由于催化前期LDH反应速率是反应限制性因素,胞内积累的PLA浓度较低,向胞内转运的PLA较低,因此试验组和对照组PLA浓度差距不大。结合胞内外PLA浓度变化趋势结果,说明超声处理提高了终产物PLA由胞内向胞外的转运速率。
为了进一步研究细胞通透化处理对细胞的影响及量化细胞通透化的程度,进行了催化过程中细胞蛋白及核酸透性检测,结果见图9、图10。

图9 细胞蛋白质通透性(R1)检测Fig.9 Detection of cellular protein acid permeability(R1)

图10 细胞核酸通透性(R2)检测Fig.10 Detection of cellular nucleic acid permeability(R2)
如图9和图10所示,静息细胞超声通透化处理后,R1和R2分别为19.48% 和19.69% 。在静息细胞转化过程中,随着催化时间的延长,R1和R2逐渐提高,10 h时R1达到最大值,是催化初始时的1.87倍;12 h时R2达到最大值,是催化初始时的1.84倍。说明超声处理提高了细胞膜通透性,导致细胞内物质外泄,催化过程中机械搅拌等作用也会加剧细胞通透性。0~4 h,R1和R2从初始19% 左右迅速提高到30% 以上,4 h~12 h R1和R2的增加速率明显放缓,分别从30.26% 和32.46% 提高到35.16% 和36.23% 。这说明细胞膜通透性不会无限增加,可能是由于细胞自身具有某种修复机制,可以控制细胞通透程度,Avhad等[20]利用超声处理球形芽孢杆菌MTCC 3672增加了细胞渗透性,改善了底物摄入并促进了微生物细胞的新陈代谢,进而促进纤溶酶的合成,这与本研究结果类似。然而,利用扫描电子显微镜观察发酵后期菌体结构时,未发现菌体表面出现大面积的孔洞与间隙,研究人员认为这与细胞膜自我修复机制有关。这说明合理适当程度的超声通透化处理使静息细胞细胞膜产生可逆的孔洞和间隙,这些“通道”的存在使细胞膜通透性提高。但是细胞膜具有自我修复的能力,细胞膜膜通透性不会一直提高,细胞不会一直向外泄露蛋白质和核酸。
3 讨论与结论
超声处理在强化生物技术过程(包括发酵、提取、生物催化和废物处理)方面具有巨大潜力,Behzadnia等[21]发现超声处理(25 kHz)能将植物乳杆菌ATCC 8014生产生物表面活性剂产量提高30% 。Dong等[22]发现超声处理60 min能将重组大肠杆菌生产D-酒石酸的转化效率提高两倍。Huang等[23]发现超声[(28±2)kHz]处理60 min能使热带假丝酵母的膜渗透性和细胞生长率提高142.5% 。Sun等[24]发现超声处理(40 kHz)可以强化真菌细胞生物量,使得竹红菌甲素产量提高77.2% 。总之,超声波对微生物代谢的有利影响包括:(1)消除微生物细胞团,提高微生物的表面积/体积比,进而提高胞内外物质交换;(2)增加细胞膜的渗透性,从而提高通过细胞膜的营养吸收,促进细胞生长和增殖;(3)改变微生物酶表面结构,提高酶催化能力[25]。
超声处理效果受到多种不同因素影响。其中,革兰氏染色性质在超声处理效果中起着重要作用。一般革兰氏阳性菌由于具有由磷壁酸和肽聚糖组成的更坚固的细胞壁,比革兰氏阴性菌更能抵抗超声波。此外,细菌的形状也会影响超声处理效果。长杆状的杆型菌由于具有更大的表面积/体积,比球型菌更容易受到超声波的影响。因此,大肠杆菌作为一种杆状的革兰氏阳性菌,是进行超声处理的很好选择。
正确使用超声参数,如超声功率、占空比和超声时间,对控制其催化能力至关重要。盲目增加超声功率和时间会导致细胞内物质扩散,局部加热,产生自由基,导致细胞失活或死亡。因此应在超声处理产生结构上的改变并维持静息细胞催化能力两者之间找到平衡。
本研究使用超声破碎仪对静息细胞进行通透化处理,优化得到最佳超声处理条件:处理时间1 min、占空比80% 、功率30% ;对通透化细胞催化条件进行优化,得到较佳催化条件:pH7、35℃、缓冲液为PBS。此条件下最终PLA的浓度从43.93 g/L提高到52.59 g/L,底物转化率从78.7% 提高到94.59% 。最后,研究发现超声处理可以提高PHE、PPA和PLA 3种物质转运速率,从而提高整个反应的催化效率。
