河北地区鸡传染性支气管炎病毒的遗传变异分析
2022-08-24何云凤赵鸿洁郭霄慧贾青辉李蕴玉李佩国
何云凤,赵鸿洁,郭霄慧,贾青辉,李蕴玉,李佩国
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛 066004)
鸡传染性支气管炎(Infectious bronchitis,IB)是由鸡传染性支气管炎病毒(IBV)引起的高度传染性的家禽疾病,IBV 属于冠状病毒科、γ 冠状病毒属,有囊膜的单股正链RNA 病毒,可在呼吸道、肾、生殖和消化系统的各种组织上皮细胞中复制,从而侵害呼吸、消化道和泌尿生殖系统[1]。IBV 是首个被发现的冠状病毒,Hawn 于1931 年首次报道了该病毒,并认为其是引起鸡呼吸急促、精神沉郁的“一种新的鸡呼吸道疾病”[2]。1956 年Jungherr 等报道感染IBV 的Conn 株与Mass 株的病鸡表现出相似的症状,但两者之间不能提供交叉保护,由此证明IBV 存在多种血清型[3]。1972 年邝荣禄等首次报道我国广东省存在IBV[4],随后IB 在我国开始流行并对我国养禽业造成重大经济损失。
IBV 编码纤突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)、小膜蛋白(E)及15 个非结构蛋白。S 蛋白又称纤突蛋白,可裂解为S1 和S2 两个亚基。S1 亚基携带受体结合位点,决定S 蛋白的主要抗原决定簇,影响病毒的组织嗜性与毒力[5]。S1 蛋白是中和性抗体和特异性抗体的主要诱导剂,同时在保护性免疫中发挥重要作用[6]。此外S1 基因的突变及重组对IBV新基因型、血清型及突变株的出现起决定性作用[7],因此主要基于S1 基因分析IBV 变异的遗传、变异等[8]。目前多采用Valastro 等制定的IBV 分型系统[9],基于全长IBV S1 基因分为GI~GVII 7 个基因型,涉及36 个分支,其中GI 基因型包括GI-1~GI-29 共计29个分支,GI-1 基因型又称为Mass 型(H120、M41、Ma5 株),GI-13 基因型又称为793B 型(4/91、CR88株),GI-19 基因型又称为QX 型(LX4 株);GII 基因型包括GII-1 和GII-2;GIII~GVII 分别包括GIII-1、GIV-1、GV-1、GVI-1、GVII-1。
研究显示,国内主要流行QX 型、4/91 型、LDT3型、Mass 型IBV[10-11],且病毒间的重组现象非常普遍,因而导致病毒的不断进化[12]。为此,本研究通过对河北省主要养鸡地区疑似IB 的病例进行病毒的分离及鉴定,并对分离病毒的S1 基因序列进行同源性及其编码氨基酸序列的比对分析,为了解河北地区IBV 的遗传演化特征及IB 的防控和疫苗的选择提供科学参考。
1 材料与方法
1.1 主要实验材料SPF 鸡胚购自北京勃林格殷格翰维通生物技术有限公司;2×EsTaqMasterMix 购自康为世纪生物科技有限公司;病毒基因组DNA/RNA提取试剂盒购自北京艾德莱生物科技有限公司;IBV、新城疫病毒(NDV)、禽白血病病毒(ALV)、传染性喉气管炎病毒(ILTV)核酸由本实验保存;琼脂糖凝胶DNA 回收试剂盒、质粒小提试剂盒均购自北京天根生化科技有限公司;pMD18-T 载体、DNA 连接酶、大肠杆菌DH5α 感受态细胞均购自宝生物工程(大连)有限公司;第一链cDNA 高效合成(反转录)试剂盒购自亚太恒信(北京)生物科技有限公司。
1.2 样品的来源和处理118 份疑似IBV 感染病鸡的气管、肺、肾、法氏囊等组织样品来自河北石家庄、邢台、承德、秦皇岛等地区的养鸡场。将组织样品剪碎并与无菌PBS 混合后,利用组织匀浆机充分匀浆,匀浆液反复冻融3 次后,4 ℃12 000 r/min离心2 min,取上清液,无菌检测后加入双抗(青链霉素)至终浓度100 U/mL,置于-80 ℃保存。
1.3 引物的设计与合成以GenBank 中已登录的IBV S1 基因(AF193423)、ILTV gD 基因(MK894999)、NDV NP 蛋白编码基因(KY076039)、ALV gp85 基因(Z46390)为参考,利用Primer 5.0 设计相应引物(表1),并由上海生工生物工程技术服务有限公司合成。

表1 PCR扩增引物序列Table 1 Sequence of PCR amplification primer
1.4 病毒的分离取上述病料样品的匀浆上清液分别接种9 日龄SPF 鸡胚尿囊腔,0.2 mL/胚,并设阴性对照,置孵化器内孵育。弃去24 h 内死亡鸡胚,72 h 后取出鸡胚于4 ℃过夜。收集鸡胚尿囊液后再接种9 日龄SPF 鸡胚,连续盲传3 代。收获每一代的鸡胚尿囊液,并观察鸡胚病变情况。
1.5 分离病毒的PCR 鉴定及序列分析分别提取第3 代尿囊液的DNA 和RNA,RNA 反转录为cDNA。以上述DNA 和cDNA 为模板,采用表1 中的相应引物,PCR 扩增IBV、NDV、ALV、ILTV 的相应基因,并以实验室保存的相应病毒株作为阳性对照,用等量超纯水作为阴性对照。将IBV 阳性样品S1 基因的扩增产物纯化回收后连接pMD18-T 载体,构建的重组质粒经PCR 鉴定后由上海生工生物工程技术服务有限公司测序。
以GenBank 中的IBV 疫苗株、国内外部分流行株共计53 株作为参考病毒,利用DNAStar 7. 1 软件和MEGA 7. 0 软件分析S1 基因序列的同源性和遗传进化特征;利用RDP4 软件对S1 基因进行重组分析,采 用7 种 统 计 方 法(RDP、 Chimaera、 BootSscan、3Seq、GENECONV、MaxChi、SiScan)筛选出可能提供重组片段的病毒及重组事件,并利用SimPlot 将重组事件可视化分析。
2 结果与讨论
2.1 病毒的分离结果将病料样品的匀浆上清液接种9 日龄鸡胚后,初次传代的鸡胚在接种后120 h 内无死亡,但取出胚体后可见胚体小于对照组。收集尿囊液并用滤膜过滤除菌,继续接种鸡胚,传至第3 代时,鸡胚在接种后48 h 开始出现死亡,打开鸡胚气室可见鸡胚绒毛尿囊膜增厚,胚体取出后可观察到胚体蜷缩、双脚抱头、死亡胚体表面可见明显出血点,符合IBV 致鸡胚病变的表现,而对照胚体无肉眼可见病变,初步表明在鸡胚尿囊液中分离到IBV。
2.2 分离病毒的PCR 鉴定结果分别以病料样品第3 代鸡胚尿囊液的DNA 和cDNA 为模板,采用IBV、NDV、ALV、ILTV 特异性引物进行PCR 扩增。结果显示,病料样品仅IBV 扩增结果为阳性,扩增出约1 700 bp 的目的条带(图1,仅展示IBV 的鉴定结果),其余病毒均为阴性结果。表明经鸡胚尿囊液分离出了IBV,且共分离到11 株IBV,分别命名为HB.XT.1、HB.CD.2、HB.SJZ.8、HB.XT.9、HB.SJZ.21、HB.CD.23、HB.SJZ.24、HB.SJZ.WJ.1、HB.QHD.2、HB.SJZ.WJ.3、HB.QHD.5。

图1 IBV分离株S1基因的PCR鉴定结果Fig.1 PCR identification of S1 gene of IBV isolates
2.3 IBV S1 基因序列的同源性分析利用DNAMAN软件对S1 基因测序结果进行分析,结果显示11 株分离株S1 基因序列长度为1 609 bp~1 619 bp,编码536~539 个氨基酸。利用DNAStar 7.1 软件中的MegA-lign 程序分析分离IBV S1 基因的同源性,结果显示,11 株分离株S1 基因序列间的同源性为92.8%~99.9%,与53 株国内外IBV 参考株S1 基因序列的同源性为73.0%~96.7%,其中和国内GI-19 基因型参考株S1 基因序列的同源性为92.9%~96.7%,与国内常用疫苗株的同源性为74.7%~96.1%。上述结果表明河北IBV 流行株之间S1 基因序列的同源性较高,与国内GI-19 基因型参考株相比发生了部分变异。除GI-19 基因型疫苗株以外,11 株分离株与H120、Ma5、M41、W93、Mass 等GI-1 基因型常用疫苗株的同源性均普遍较低。该结果与尹丹等的研究结果一致[13],表明IBV S1 基因的变异性较大,且与常用疫苗株同源性较低。
2.4 IBV S1 基因的遗传进化分析利用MEGA7.0 软件中的Neighbor-Joining 方法绘制IBV 分离株及参考株S1 基因的进化树,重复次数为1 000。结果显示,所有参考株共形成4 个不同的进化分支,其中11 株分离株与17 株国内流行株、2 株QX 型疫 苗 株(MH743141、HC455885)以 及8 株 国 外 参考株形成GI-19 基因型进化分支(图2),表明GI-19型IBV 是河北省流行的主要基因型,上述结果与王旭贞等报道的山西晋中地区IBV 流行基因型一致[14]。11 株分离株与H120、M41、Ma5、W93、4/91 等常用疫苗株遗传进化关系较远,变异较大,可能是在长期使用活疫苗的免疫选择压力下造成了IBV 主要基因的变异,使得传统疫苗产生的保护效力已经不能完全抵抗流行株对鸡体的攻击[15]。
2.5 IBV S1基因编码氨基酸序列的比对利用MEGA7.0 软件对分离株与参考株S1 基因编码的氨基酸序列进行比对,结果显示,与国内现用GI-19 基因型疫苗株相比,分离株HB.SJZ.8、HB.SJZ.21 以及HB.WJ.3 和HB.QHD.5 在两个相同位点发生了相同的氨基酸突变,分别是G38R、R66C;分离株HB.SJZ.8、HB.WJ.3 和HB.QHD.5 在多个相同位点均发生了相同的氨基酸突变,分别是L97F、R113W、C122S、I290T、 H350P、 F351Y、 K352R、 K353R、 S357N、 M368T、M373K、A384F;分离株HB.XT.1、HB.CD.2、HB.XT.9、HB.SJZ.21、HB.CD.23、HB.SJZ.24、HB.SJZ.WJ.1、HB.QHD.2 在多个相同位点均发生了相同的氨基酸突变,分别是C130R、L279P、I285V、V325G、F359S、Q364P、R365L、P369L、T370I、L371H、A374V、K379R、I382T;HB.XT.9 株在3 个位点处均发生了突变,分别是C52R、S309N、V315M;分离株HB.SJZ.21、HB.SJZ.24、HB.QHD.2、HB.QHD.5 在不同位点也发生了突变,分别是L317V、I288V、C304F、V335E。突变位点均位于aa38~aa67、aa 91~aa141 和aa 274~aa387,这与S1 蛋白含有的与血清型特异性和病毒中和表位相关的高变区(HVR)一致。IBV 基因组在复制过程中极易发生基因突变、缺失、插入及重组等,从而使IBV不断发生变异,造成不同血清型IBV之间的交叉保护性低。研究表明S1基因仅有5%的变化就可以使得疫苗的保护力改变[16]。上述结果表明,2019年~2021 年河北地区IBV 的流行株与疫苗株相比出现了不同程度的变异。
2.6 IBV S1基因的重组分析结果利用RDP4 软件分析11 株分离株S1 基因中可能存在的重组事件,结果显示,有两株分离株存在符合7 种算法的重组事件,分 别 为HB.SJZ.21 株=HB.XT.9 株+HB.SJZ.8 株、HB.XT.1 株=HB.SJZ.8 株+智利株MF043938,由此初步判定IBV 分离株HB.SJZ.21 和HB.XT.1 为两株重组病毒。为了验证RDP4 软件鉴定的重组事件,利用SimPlot软件对重组事件可视化分析,结果显示,为HB.SJZ.21 株提供重组片段的主要亲本株为HB.XT.9 株,次要亲本株为HB.SJZ.8 株,在nt253 处存在重组断点(图3A);为HB.XT.1 株提供重组片段的主要亲本株为HB.SJZ.8 株,次要亲本株为智利株MF043938,在HB.XT.1 株S1 基因有两个重组断点,形成一段重组区域nt1 059~nt1 225(图3B)。重组分析结果表明HB.SJZ.21 株可能是由HB.XT.9 株和HB.SJZ.8 株重组而成,HB.XT.1 株可能是由HB.SJZ.8 株和智利株MF043938 重组而成。已经报道了许多IBV 的重组事件,不仅在野生型病毒和疫苗株之间,而且在野生病毒之间也存在许多重组事件[17],从而产生了新的IBV 基 因 型[18]。
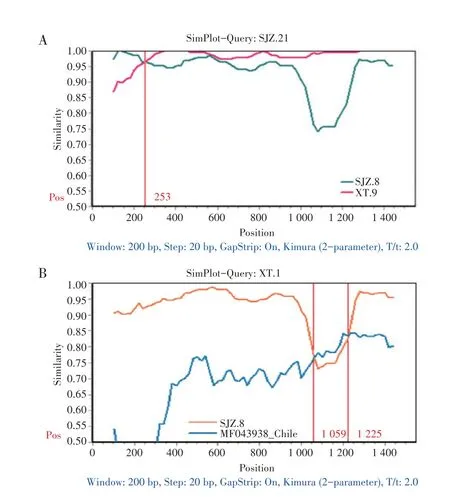
图3 HB.SJZ.21(A)和HB.XT.1(B)分离株S1基因的Simplot重组分析Fig.3 Recombination analysis of S1 gene of HB.SJZ.21(A)and HB.XT.1(B)isolates by Simplot
目前世界范围内主要流行GI-19 基因型IBV,与其他型IBV 相比表现出严重的致病性[19]。因此,选择合适的疫苗株和正确的免疫程序是有效控制IB 的关键[20],反之可能会导致新型变异株的出现。同时还需对IBV 进行持续的流行病学监测,尤其应注意不同基因型IBV 的混合感染、共同流行的情况,为IB 的防控和新疫苗的开发提供参考。
