宿主蛋白核仁素与病毒基因组相互作用对牛肠道病毒复制影响的研究
2022-08-24魏丹丹常继涛
魏丹丹,孙 超,常继涛,于 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/牛羊传染病创新团队,黑龙江 哈尔滨 1550069)
肠道病毒(Enterovirus)属于微RNA 病毒科(Pi-cornaviridae),其包含12 个肠道病毒种(EV-A~EV-L)及3 个鼻病毒种(RV-A~RV-C)。牛肠道病毒(Bo-vine enterovirus,BEV)属于E 和F 种肠道病毒[1],其中BEV-E 可以引起牛以发热、咳嗽、腹泻等呼吸道和消化道症状为主要特征的传染病,对畜牧业造成严重的危害[2]。目前尚无F 种肠道病毒致病的报道,但由于其可诱导机体产生良好的黏膜免疫反应,常用于疫苗载体的开发[3]。1959 年,Moll 首次分离得到BEV[4],随后许多国家也相继报道该病毒。本实验室于2011 年分离到我国首株F 种肠道病毒,获得了其全基因组序列[3],并建立了该病毒株的反向遗传系统。由于F 种BEV 无明显的致病性,适合作为微RNA 病毒科的模式病毒研究病毒的复制机制。
BEV 为无囊膜的单股正链RNA 病毒,基因组全长约7.5 kb,包括5'非编码区(5'UTR)、开放阅读框(ORF)及3'非编码区(3'UTR),其中5'UTR 含有内部核糖体进入位点(Internal ribosome entry site,IRES)[5],可以起始病毒蛋白的翻译。
核仁素(Nucleolin,NCL)是真核细胞中的一种多功能磷蛋白,主要位于核仁中,也存在于核质、胞质和胞膜中[6]。NCL 由707 个氨基酸组成,预测的分子量为77 ku,由于N 端的磷酸化,其实际分子量为100 ku~110 ku。该蛋白包含3 个结构域,分别是N 端结构域、中心结构域(RRM)和C 端结构域,可与多种蛋白质或RNA 相互作用发挥其功能,如参与核糖体的形成、RNA 的代谢、应激反应等[7]。在病毒感染时,NCL 发生核-质迁移并与病毒蛋白或基因组结合,介导病毒的感染[8]。有研究表明,NCL可在脊髓灰质炎病毒(PV)感染时发生重定位,以促进PV IRES 介导的翻译[9-10];NCL 也可促进口蹄疫病毒(FMDV)IRES 介导的翻译过程,对翻译起始复合物的组装起辅助作用[11];此外,NCL 也可作为一些病毒的胞膜受体,介导病毒的进入[12]。近年来,NCL 已成为研究热点,但NCL对微RNA 病毒复制作用的研究较少,目前其在BEV生命周期中的调控作用尚不清楚。
因此,本研究分别将BEV 感染过表达和下调NCL表达的BHK-21 细胞,研究NCL 对BEV 复制的影响,通过RNA 免疫共沉淀试验检测NCL 与BEV 基因组的相互作用,并采用激光共聚焦试验分析BEV 感染细胞中NCL 与BEV RNA 的共定位,采用双荧光素酶报告试验检测NCL 对BEV IRES 翻译活性的影响,为进一步研究NCL 在BEV 感染和复制中发挥的生物学功能奠定基础,也为微RNA 病毒感染机制的研究提供参考。
1 材料与方法
1.1 主要实验材料乳仓鼠肾细胞(BHK-21)由本实验室保存;BEV BHM-26 株由本实验室分离并保存[3];真核表达载体pCAGGS-HA(简写为pHA)、双荧光素酶报告载体pmirGLO 购自Addgene 公司。
大肠杆菌DH5α 感受态细胞、PrimerScript Ⅱ反转录酶及In-Fusion®HD Cloing Kit 均购自TaKaRa 公司;T4 DNA 连接酶、各种限制性内切酶均购自NEB公司;KOD FX Neo DNA 聚合酶、KOD SYBR®qPCR Mix 均购自TOYOBO 公司;PEI 转染试剂购自poly-sciences 公司;Protein A/G 磁珠和4',6-二脒基-2-苯基吲哚(DAPI)购自上海碧云天生物技术有限公司;DMEM 购自Gibco 公司;胎牛血清(FBS)购自PAA 公司;质粒小提试剂盒、胶回收试剂盒均购自Axygen 公司;Simply P Total RNA 提取试剂盒购自Bio Flux 公司;Dual-luciferase repoter assay kit 购 自Promage 公 司;蛋白酶抑制剂cocktail购自Roche公司;RIPA蛋白裂解液和多聚甲醛购自Sigma 公司;蛋白Marker、蛋白上样缓冲液购自Thermo Fisher 公司;硝酸纤维素膜(NC膜)购自Pall 公司。
鼠源BEV 阳性血清由本实验室制备并保存;鼠源HA 单克隆抗体(MAb)、鼠源β-actin MAb 购自Genescript 公司;鼠源双链RNA(dsRNA)MAb 购自SCICONS 公司;兔源NCL 多克隆抗体(pAb)购自Pro-teintech 公司;IRDye®800CW 羊抗鼠IgG、IRDye®800CW羊抗兔IgG 购自Licor 公司;Alexa Fluor 488 标记羊抗兔IgG、Alexa Flour 594 标记羊抗鼠IgG 购自北京中杉金桥生物技术有限公司。
1.2 引物及shRNA 的设计与合成参照GenBank中仓鼠源NCL 基因序列(NM_010880)、β-actin 基因序列(NM_009606.3)、BEV(BHM26、HQ917060.1)设计相应引物(表1),引物由库美公司合成。shRNA由吉玛公司合成(shRNA-NCL 序列为GCAGTTCCCA CACCAGCTAAG、shRNA-NC 序列为GTTCTCCGAAC GTGTCACGT)。
1.3 pHA-NCL 真核表达质粒的构建提取BHK-21细胞总RNA 并反转录为cDNA,将其作为模板,利用pHA-NCL-F/R 特异性引物(表1)PCR 扩增NCL 基因,经酶切后克隆至真核表达载体pCAGGS-HA 中,构建pHA-NCL 质粒,经PCR 及测序鉴定后保存备用。

表1 本研究使用的引物Table 1 Primers used in this study
1.4 NCL 的过表达及其对BEV 复制影响的检测利用PEI 试剂分别将pHA-NCL 和pHA(质粒:PEI=1 μg:3 μL)转染至BHK-21 细胞中,24 h 后收集细胞,采用RIPA 裂解细胞并离心,取上清经SDSPAGE 检测后,以鼠源anti-HA(1:1 000)为一抗,以IRDye®800CW 羊抗兔IgG(1:10 000)为二抗,利用western blot 检测BHK-21 细胞中的NCL 是否过表达;在确定NCL 已过表达的BHK-21 细胞中,即于转染pHA-NCL 后24 h 将BEV 以MOI 1 感染细胞,37 ℃、5% CO2条件下分别培养8 h、10 h 和12 h 时收集上清液和细胞。提取感染BEV 后不同时间点的细胞样品总RNA,反转录为cDNA 后作为模板,利用qP-CR-BEV-F/qPCR-BEV-R 引 物(表1)经 荧 光 定 量PCR(qPCR)检测病毒基因组RNA 的复制水平,以β-actin 作为内参。反应条件为:95 ℃30 s,95 ℃5 s、55 ℃30 s、72 ℃30 s,共40 个循环。
将收获的细胞经RIPA 裂解后离心取上清经SDSPAGE 电泳后,转移至NC 膜上,于5%脱脂乳封闭1 h后,以相应的抗体(anti-HA MAb:1:1 000,anti-NCL pAb:1:2 000,BEV 阳性血清:1:200,β-actin MAb:1:10 000)为一抗,IRDye®800CW 羊抗鼠IgG(1:10 000)、IRDye®800CW 羊抗兔IgG(1:10 000)为二抗,采用western blot 检测病毒结构蛋白VP1 的表达。
将收集的细胞上清液用无血清DMEM 培养基10倍倍比稀释后,取100 μL 各稀释度的上清液分别加至96 孔板中长满单层的BHK-21 细胞中,相同稀释度的病毒液对应4 个重复孔,置于37 ℃、5% CO2条件下培养3 d~4 d,观察细胞病变程度,采用Kärber法计算病毒TCID50/100 μL。
1.5 NCL 的下调表达及其对BEV 复制影响的检测分别将shRNA-NCL 和shRNA-NC(质粒:PEI=1 μg:3 μL)转染至BHK-21 细胞中,转染24 h 后收集细胞,采用1.4 中的western blot 方法检测NCL 下调表达的效果。在确定NCL 已下调表达的BHK-21细胞中,将BEV 以MOI 1 感染细胞,37 ℃、5% CO2中培养8 h、10 h 和12 h 后分别收集上清液和细胞。采用1.4 中的qPCR、western blot 和病毒滴度检测病毒的复制情况。
1.6 NCL 和BEV 基因组相互作用的RNA 免疫共沉淀试验NCL 的中心结构域含有4 个RNA 识别基序,可与病毒RNA 结合并发挥其功能[6]。为了探究NCL 是否通过与BEV 基因组的相互作用促进病毒复制,将BEV(MOI 1)感染已长满单层的BHK-21 细胞,6 h 后收集细胞并裂解,取裂解液上清加入20 μL Protein A/G 磁珠,置于4 ℃摇床中孵育1 h 以去除非特异性结合。去除磁珠后,保留部分上清做Input 阳性对照,剩余上清均分至2 个离心管中,其中一个上清中加入2 μg 兔源NCL pAb,另一个加入同源IgG 作为阴性对照,细胞裂解物与抗体的混合物继续置于4 ℃孵育2 h 后再次加入20 μL Protein A/G 磁珠以沉淀抗体-NCL 蛋白-病毒RNA 复合物(免疫复合物),4 ℃孵育1 h,弃上清,用Wash buffer 洗涤5次。提取该免疫复合物的RNA 并反转录为cDNA 作为模板,利用BEV 基因组特异性引物RIP-BEV-F/R经PCR 扩增,并设置ddH2O 为阴性对照,检测NCL与BEV 基因组RNA 是否存在相互作用。
1.7 BEV 感染细胞中NCL 与BEV RNA 共定位的激光共聚焦试验将BHK-21 细胞铺于共聚焦小皿,置于37 ℃、5% CO2培养至合适密度后接种BEV(MOI 1),分别培养5 h 和10 h 后弃去培养液,以5%多聚甲醛室温固定细胞30 min,0.5% Triton X-100 透膜15 min,5% 脱脂乳封闭1 h。加入鼠源dsRNA MAb(1:1 000)和兔源NCL pAb(1:1 000)分别孵育1 h,然后分别以Alexa Flour 594 标记羊抗鼠IgG(1:200)和Alexa Fluor 488 标 记 羊 抗 兔IgG(1:200)避光孵育1 h,并用DAPI 避光染核15 min。在激光共聚焦显微镜下观察NCL 的亚细胞定位及与BEV 基因组RNA 的共定位情况。
1.8 NCL 对BEV IRES 翻译活性影响的检测已有研究表明,微RNA 病毒进入宿主细胞后,通过其基因组IRES 元件起始病毒蛋白的翻译,这是启动病毒复制的一个关键步骤[11]。根据1.6 中NCL 蛋白与BEV 基因组互作对BEV 复制影响的检测结果推测,NCL 也可能是通过提高BEV IRES 介导的翻译起始活性而促进BEV 的复制。为了验证该推论,本实验以pmirGLO 质粒为模板,利用引物pmirGLO-F/R 将其经PCR 线性化;同时以BEV cDNA 为模板,采用引物IRES-F/R 经PCR 扩增BEV IRES 基因序列,利用In-Fusion 试 剂 盒 将 线 性 化 的pmirGLO 及BEV IRES 同源重组构建双荧光素酶报告质粒pmirGLO-BEV IRES,并测序鉴定。分别于过表达和下调表达NCL的BHK-21 细胞中(操作方法同1.4 和1.5)转染pmir-GLO-BEV IRES 双荧光素酶报告质粒,并均以转染pmirGLO 质粒的BHK-21 细胞作为对照。每组3 个平行孔,转染12 h 后弃去细胞培养液,采用Dual-lu-ciferase reporter assay kit 分别检测荧火虫荧光素酶FLuc 和海肾荧光素酶RLuc 的活性,分析NCL 对BEV IRES 翻译活性的影响。
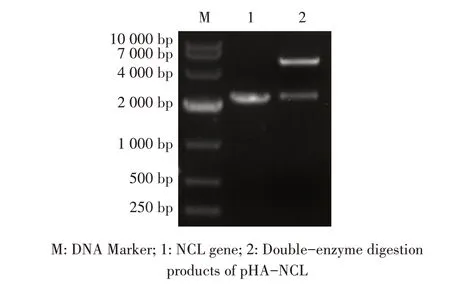
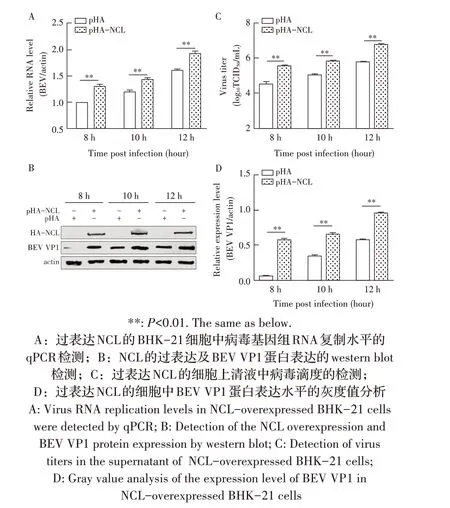
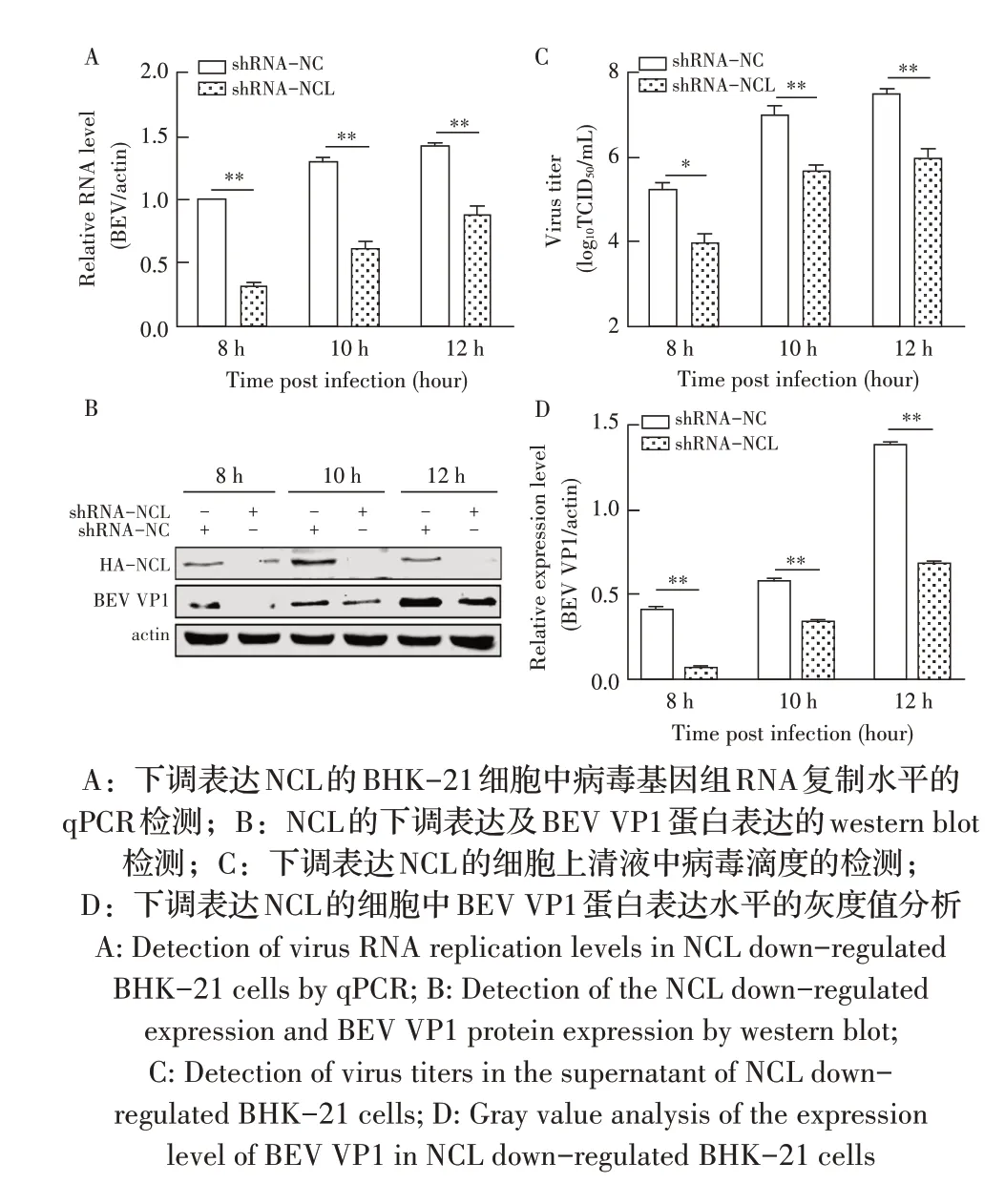
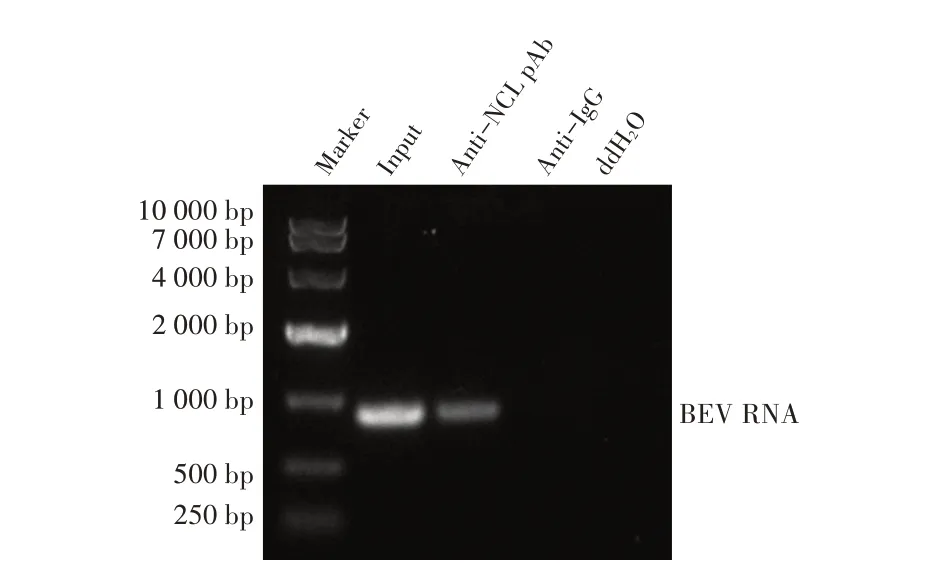
1.9 数据分析本研究中所获得的数据均采用GraphPad Prism 软件进行分析。数据的统计学分析采用Studentt检验,0.01 2.1 真核表达质粒pHA-NCL的鉴定结果以BHK-21细胞cDNA 作为模板,经PCR 扩增到约2 000 bp 的NCL 基因(图1),将该片段克隆至pHA 载体中,构建的重组质粒经EcoR I 和NheI 双酶切鉴定,结果显示分别出现一条载体条带和约2 000 bp 的NCL 基因条带(图1),测序结果表明正确构建重组质粒pHA-NCL。 图1 NCL基因的PCR扩增及重组质粒pHA-NCL的双酶切鉴定结果Fig.1 PCR amplification of NCL gene and identification results of recombinant plasmid pHA-NCL 2.2 过表达NCL 及其对BEV 复制影响的检测结果将pHA-NCL 和pHA 分别转染至BHK-21 细胞中,24 h后采用western blot 方法检测BHK-21 细胞中NCL 的表达。结果显示,转染pHA-NCL 的BHK-21 细胞可检测到NCL 特异性条带,而转染pHA 的BHK-21 细胞无该条带(图2B)。表明NCL 在BHK-21 细胞中获得了过表达。在此基础上将BEV 以MOI 1 感染过表达NCL 的BHK-21 细胞,于感染后不同时间点分别取上清液和细胞样品,分别利用qPCR、western blot和测定TCID50的方法检测病毒复制情况。qPCR 结果显示,感染BEV 后各时间点,过表达NCL 的BHK-21 细胞中BEV 基因组的复制水平均极显著(P<0.01)或者显著(P<0.05)高于转染pHA 的对照细胞(图2A);对病毒结构蛋白VP1 进行western blot 检测,并对结果进行灰度值分析,结果显示在病毒感染后8 h、10 h和12 h,过表达NCL 的BHK-21 细胞中BEV 结构蛋白VP1 的表达量均极显著高于转染pHA 的对照细胞(图2B、图2D);BEV 的病毒滴度测定结果显示,过表达NCL 细胞上清液的病毒滴度极显著高于转染pHA的对照细胞(P<0.01,图2C)。这些结果表明,NCL的过表达显著促进BEV 的复制。 图2 NCL的过表达及对BEV复制影响的检测结果Fig.2 Detection results of the effect of NCL overexpression on BEV replication 2.3 NCL 的下调表达及其对BEV 复制影响的检测结果 为了进一步证实NCL 对BEV 复制的促进作用,将靶向NCL的shRNA转染至BHK-21细胞,24 h后采用western blot 检测BHK-21 细胞中NCL 下调表达的效果。结果显示,转染shRNA-NCL 的BHK-21 细胞中NCL 蛋白条带比转染shRNA-NC(NC)的对照细胞明显减弱(图3B),表明shRNA-NCL 可使BHK-21细胞内NCL 的表达下调。在此基础上,将BEV 以MOI 1 感染下调表达NCL 的BHK-21 细胞,于感染后不同时间点分别收集上清液和细胞样品,采用上述qPCR、western blot和病毒滴度检测方法检测。qPCR 结果显示,感染BEV 8 h、10 h 和12 h 后,NCL 下调表达的BHK-21 细胞中BEV 基因组RNA 的复制水平均极显著低于转染NC 的对照细胞(P<0.01,图3A)。病毒结构蛋白检测的western blot 及对其灰度值分析结果显示,NCL 下调表达的BHK-21 细胞中BEV VP1 的表达量均极显著(P<0.01)低于转染NC 的对照细胞(图3B、图3D)。病毒滴度测定结果显示,NCL 下调表达的BHK-21 细胞上清液中的病毒滴度均显著(P<0.05)或极显著P<0.01)低于转染NC 的对照细胞(图3C)。上述结果表明,NCL 蛋白的下调表达显著抑制BEV 的复制。 图3 NCL下调表达对BEV复制影响的检测结果Fig.3 Detection results of the effect of NCL downregulation on BEV replication 2.4 NCL 与BEV 基因组相互作用的RNA 免疫共沉淀结果 将BEV 感染BHK-21 细胞,6 h 后裂解细胞取上清经RNA 免疫共沉淀试验检测NCL 与BEV 基因组的互作。结果显示,仅Input 阳性对照组和NCL 抗体-NLC 蛋白-病毒RNA 免疫复合物扩增出约800 bp BEV 相应的目的基因片段(图4),而IgG 抗体对照则未能扩增出任何条带。表明在BEV 感染细胞的过程中,NCL 与病毒基因组RNA 之间存在相互作用。 图4 NCL与BEV基因组相互作用的RNA免疫共沉淀试验结果Fig.4 Results of RNA immunoprecipitation assay for the interaction of NCL and BEV genome 2.5 BEV 感染细胞中NCL 与BEV RNA 共定位的激光共聚焦试验结果NCL 作为一种核质穿梭的核仁蛋白,在正常的细胞中主要分布在核仁。已知在PV和FMDV 感染的细胞中,NCL 会发生核-质迁移[11]。本研究将BEV(MOI 1)感染BHK-21 细胞,培养5 h和10 h 再加入相应的一抗二抗后,利用激光共聚焦显微镜观察NCL 蛋白和BEV 基因组RNA 在病毒感染细胞中的定位。结果显示,未感染病毒的空白对照细胞的核仁发出绿色荧光(代表NCL 蛋白);而在BEV 感染的细胞中,核仁中的绿色荧光逐渐转到细胞质中,且随着感染时间的延长细胞质中的绿色荧光逐渐增多。同时随着感染时间的延长,细胞质中的红色荧光(代表BEV 基因组)逐渐增多,而且绿色荧光与红色荧光共定位于胞质内(图5)。结果表明,BEV 感染后NCL 从细胞核穿梭至细胞质,并与BEV基因组RNA 发生了相互作用。 图5 BEV感染的BHK-21细胞中NCL蛋白与BEV基因组共定位的激光共聚焦试验结果Fig.5 Co-localization of NCL protein and BEV genome in BEVinfected BHK-21 cells were visualized using confocal microcopy 2.6 NCL 对BEV IRES 介导的翻译活性影响的检测结果 以BEV cDNA 为模板,经PCR 扩增BEV IRES基因,并与线性化的pmirGLO 经同源重组构建双荧光素酶报告质粒pmirGLO-BEV IRES,测序鉴定结果表明该双荧光素酶报告质粒构建正确。FLuc 是帽依赖的,而RLuc 是BEV IRES 依赖的,即以FLuc 值作为内参,RLuc 值反映了BEV IRES 起始蛋白翻译的活性(图6A)。将该报告质粒分别转染NCL 过表达、下调表达及其各自的对照细胞中,转染后12 h 测定RLuc 与FLuc 的荧光值。结果显示,与转染pHA 的对照细胞相比,NCL 过表达的BHK-21 细胞中FLuc值无显著变化,而RLuc 值极显著升高(P<0.01),即NCL 过表达显著提高了BEV IRES的翻译起始活性(图6B);同时,与转染NC 的对照细胞相比,在NCL 表达下调的BHK-21 细胞中,FLuc 值无显著变化,RLuc 值极显著降低(图6C),即下调NCL 的表达则显著抑制了IRES 的翻译起始活性。结果表明,NCL 正调控BEV IRES 介导的翻译活性,从而促进BEV 的复制。 图6 NCL对BEV IRES介导的翻译活性影响的检测结果Fig.6 Detection results of the effect of NCL on the BEV IRES-mediated translation activity 自1973 年被Orrick 发现以来,NCL 已成为许多领域的研究热点。在真核生物的进化中,NCL 高度保守,它广泛分布于细胞的各部分,如核仁、细胞核、细胞质和细胞膜[8]。目前的研究报道显示,NCL 的功能多样,其参与核糖体的形成、DNA 或RNA 代谢、细胞增殖等生物学过程;NCL 在多种肿瘤细胞中过度表达[13],表明NCL 可参与肿瘤的形成;近年来有越来越多的研究发现,NCL 在病毒的生命周期中也发挥重要的调控作用,如作为人呼吸道合胞体病毒(RSV)的功能受体[14]、人肠道病毒-71 型(EV-71)的共受体[12]、促进FMDV[11]和抑制小反刍兽疫病毒(PPRV)的复制[15]等。 本研究结果显示,在BHK-21 细胞中过表达NCL可促进BEV 复制,而下调该蛋白的表达则可抑制BEV 的复制,这从正反两个方面证实NCL 是BEV 复制的正调控因子。而且双荧光素酶试验结果也证实,NCL 可以提高BEV IRES 的翻译起始活性,从而促进BEV 复 制。与 之 相 似,NCL 也 可 促 进PV[9]、FMDV 和塞内卡病毒(SVA)[11]IRES 介导的翻译起始过程,这表明NCL 对含IRES 结构的微RNA 病毒的复制均具有正调控作用。在微RNA 病毒感染细胞后,胞核蛋白穿梭至细胞质,参与病毒的复制过程,其原因大致包括胞核蛋白的核定位信号(NLS)被切割、核孔复合物(NPC)被破坏等[11]。本研究通过激光共聚焦试验发现,BHK-21 细胞感染BEV 后NCL 由核仁重新定位至细胞质,但是未发现NCL 被切割而降解的现象(数据未展示),由此推测,NCL 由核仁至胞质的重定位是在病毒感染中NPC 被破坏的结果。 在NCL 参与FMDV 复制的研究中,已有人发现,NCL 通过与FMDV IRES 结合并辅助其招募翻译起始因子和反式作用因子而促进翻译起始复合物的组装[11]。因此,本研究推测NCL 与BEV 基因组RNA 直接或间接结合,进而促进IRES 招募40S 和60S 核糖体亚基以及翻译起始复合物的形成,由此提高IRES的翻译活性、促进BEV 的复制水平。本研究通过RNA 免疫共沉淀试验,证实了NCL 与BEV 基因组的结合,但未探究其与基因组的结合部位,根据已有报道推测,NCL 应该与BEV 5'UTR 结合从而调控蛋白的翻译过程[11];在病毒复制过程中,除了非编码区,NCL 还可能通过与病毒非结构蛋白的相互作用,实现对BEV 复制的调控,这也是本研究室后续的研究重点。 病毒的感染过程是病毒与宿主相互博弈的过程。宿主细胞内的NCL 可以促进BEV 的复制,那么宿主也会通过某种机制调控NCL 的功能,如抑制NCL 蛋白的表达、翻译后修饰等[16]。NCL蛋白含有多个修饰位点,如磷酸化、泛素化和乙酰化等[8],发生翻译后修饰的NCL,其细胞定位及生物学功能可能发生变化。有研究显示,宿主通过泛素化降解NCL 从而拮抗其对兔出血热病毒(RHDV)的促进作用[16]。而感染BEV 后,宿主细胞可能通过调控NCL 的功能来抵抗病毒的侵染,其机制有待进一步研究。 本研究证实了NCL 是一种促进BEV 复制的宿主因子,进一步丰富了病毒-宿主互作的理论,也为深入探究BEV 的复制机制奠定基础。2 结 果
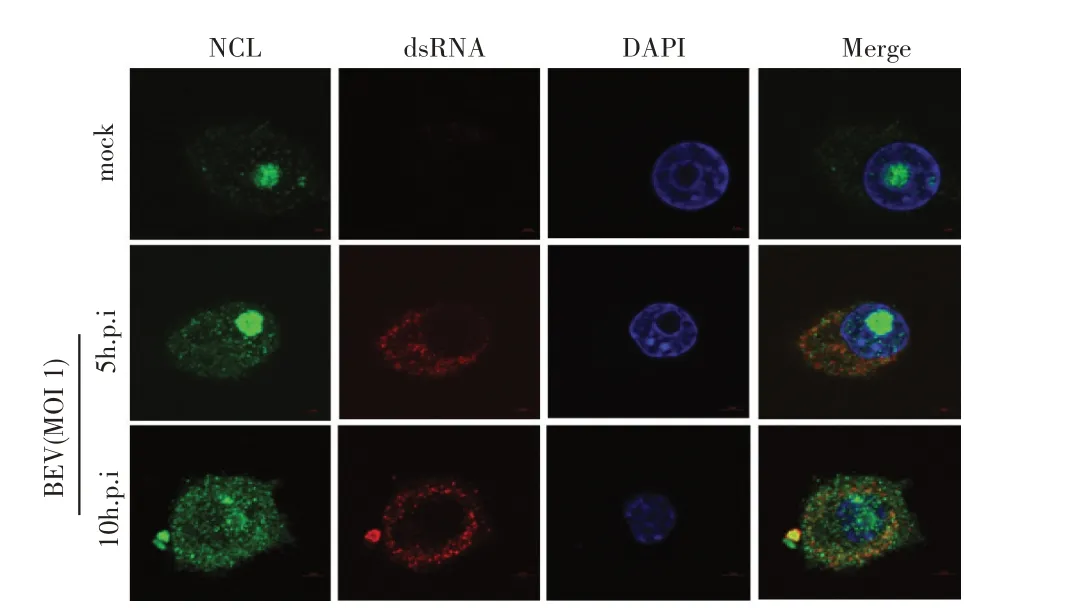
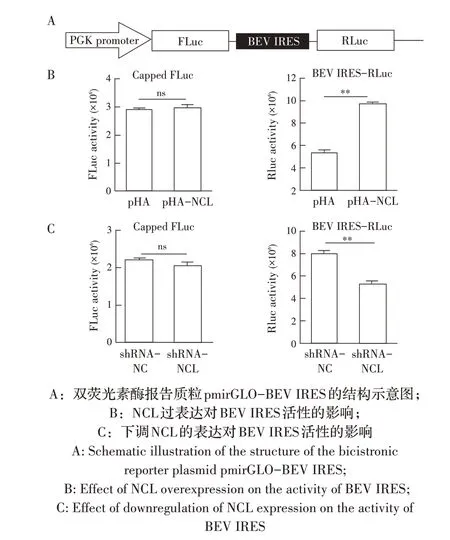
3 讨 论
