伪狂犬病病毒感染小鼠的背根神经节后天然免疫相关转录组测序及分析
2022-08-24吴红霞袁梦淇仇华吉
王 冰,吴红霞,李 淼,高 莹,袁梦淇,仇华吉,孙 元
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
伪狂犬病(Pseudorabies,PR)是由PR 病毒(PRV)引起[1]。PRV 是疱疹病毒科α 疱疹病毒亚科的成员,病毒粒子直径为150 nm~180 nm,由内至外分别为病毒基因组(Genome)、衣壳(Capsid)、基质(Tegu-ment)和囊膜(Envelope)[2]。PRV 的天然宿主是猪,但是也能够感染其他哺乳动物[3],包括感染人[4]。PRV感染动物后能够在外周神经系统(Peripheral nervous system,PNS)神经元的轴突末梢进行吸附、内化,并沿轴突逆向传导至神经胞体,从而完成病毒复制或潜伏感染[5]。研究发现,PRV 感染小鼠后会激活其机体的天然免疫反应,同时诱导小鼠产生严重的神经症状和神经炎症,但是其具体机制仍未知[6]。小鼠的背根神经节(Dorsal root ganglia,DRG)位于脊柱内脊髓两侧,是初级传入神经元胞体所在的位置,属于外周神经元[7],并且PRV 能够在小鼠DRG 内复制并建立潜伏感染[5]。因此,研究感染PRV 后小鼠外周神经系统内,尤其DRG 内基因表达水平变化,有助于深入研究PRV 的致病机制。
近年来,转录组测序(RNA-seq)技术已经广泛应用于多种疱疹病毒与宿主的相互作用研究,如研究人员通过对山羊疱疹病毒1 型(Caprine herpesvirus 1,CpHV-1)感染的MDBK 细胞进行RNA-seq,发现细胞内多种与天然免疫反应相关的基因转录水平发生了变化,如IFIT1、IFIT2和IFIT5[8];通过对爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)感染后不同时间的原代B 淋巴细胞进行RNA-seq,同样发现了大量转录水平发生改变的基因,这为深入研究EBV的致瘤机制奠定了基础[9]。为了探究PRV 感染小鼠的外周神经系统内基因转录水平的变化,本研究将PRV 接种小鼠后,在其濒死期分离DRG,进行RNAseq,并对差异转录基因进行分析,为深入研究PRV的致病机制提供线索。
1 材料与方法
1.1 主要实验材料PRV TJ 株由本实验室分离、鉴定和保存;6 周龄的BALB/c 小鼠购自辽宁长生生物技术有限公司。DMEM 培养基购自Sigma 公司;TRIzol 试 剂 购 自Invitrogen 公 司;HiScript II Q RT Su-perMix for qPCR(+gDNA wiper)、2×ChamQ SYBR qP-CR Master Mix 均 购 自Vazyme 公 司。
1.2 小鼠感染实验将6 只6 周龄健康BALB/c 小鼠随机分为2 组(n=3),其中实验组接种100 μL 107pfu/mL PRV,对照组接种100 μL DMEM,接种途径均为左腿肌肉注射,每组各作3 个重复(TJ-1~TJ-3、Mock-1~Mock-3)。本实验室前期研究结果显示,小鼠在接种PRV TJ 株后56 h 进入濒死期,临床症状也最严重,因此本研究选择接种病毒56 h 后迫杀小鼠,参照文献[10]方法分离DRG,-80 ℃保存于200 μL TRIzol 试剂中待用。
1.3 RNA-seq 及差异转录基因的功能分析各组小鼠DRG 样品由华大基因公司使用BGISEQ 平台进行RNA-seq,获得测序原始数据,去除其中低质量、接头污染以及未知碱基含量过高的reads,获得clean reads,利用HISAT 软件将过滤后的基因序列与小鼠参考序列比对。采用华大基因多组学系统(https://biosys.bgi.com/#/report/project/projectList)进行生物信息学和差异转录基因的功能分析。本研究利用DESeq2软件比较对照组与感染组小鼠DRG 内基因的转录水平,并利用clusterProfiler R 软件进行转录差异基因的基因本体论数据库(Gene Ontology,GO)功能富集分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
1.4 差异转录基因的荧光定量PCR(RT-qPCR)验证根据测序结果随机选择10 条转录水平上调或下调的基因,利用TRIzol 试剂提取各组DRG 样品总RNA,反转录为cDNA 后为模板,采用Premier 6.0 设计引物(表1),进行qPCR 检测,验证各基因的转录情况。PCR 反应程序为:95 ℃5 min;95 ℃10 s、60 ℃30 s、72 ℃1 min,共40 个循环;95 ℃1 min,55 ℃30 s,95 ℃30 s,共1 个循环。以GAPDH 为内参,采用2-ΔΔCt法计算各基因的相对转录水平。

表1 RT-qPCR所用的引物Table 1 Primers for RT-qPCR
2 结 果
2.1 PRV 感染小鼠后DRG 的转录组学分析根据小鼠DRG 的RNA-seq 结果,对PRV 感染组小鼠和对照组小鼠DRG 内mRNA 水平进行聚类分析(图1),计算PRV 感染组与对照组小鼠基因思转录水平的差异倍数(Fold change,FC),并绘制火山图(图2)。结果显示,对照组(Mock-1、2、3)和感染组(TJ-1、2、3)被聚为两大类(图1),符合感染组和非感染组的差异转录基因水平预期,表明PRV-TJ 感染后可引起小鼠DRG 内大量基因的差异转录。FC>2 且P≤0.05的差异转录基因共有6 502 条。其中,相对于对照组,PRV 感染组小鼠DRG 内有3 703 条基因转录水平升高,2 799 条基因转录水平降低(图2)。表明PRV 感染可导致小鼠DRG 的大量基因转录水平异常。

图2 PRV感染小鼠DRG内差异转录基因的火山图分析Fig.2 Volcano plot of differentially transcribed genes in DRG from the PRV-infected mice
2.2 差异转录基因的功能分析为了探究PRV 感染小鼠后可能造成的影响,本研究将差异转录的基因进行了GO 注释。结果显示,转录水平发生改变的基因广泛存在于细胞各组分中,如细胞质、胞外基质和轴突等(图3)。其中,细胞膜和细胞质中差异转录的基因数量最多。进一步对差异转录基因进行KEGG 富集分析,结果显示,差异转录的基因被富集到20 种KEGG 信号通路中(图4),表明PRV 感染小鼠会对其DRG 内多种生理过程产生影响。对上述结果汇总发现差异转录基因存在数量最多的5 条抗病毒信号通路分别为丝裂原活化蛋白激酶(Mitogenactivated protein kinase,MAPK)信号通路、核苷酸结合寡聚化结构域样受体(Nucleotide-binding oligomer-zation domain-like receptor,NLR)信号通路、肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路、细胞凋亡(Apoptosis)信号通路和信号转导及转录激活因子(Signal transducers and activators of transcription,JAK -STAT)信号通路。

图3 GO分析PRV感染小鼠DRG内差异转录基因的定位Fig.3 GO analysis for the location of differentially transcribed genes in DRGs from the PRV-infected mice

图4 PRV感染小鼠DRG内差异转录基因参与的信号通路的KEGG分析Fig.4 KEGG analysis for signaling pathways participated by differentially transcribed genes in DRG from the PRV-infected mice
2.2.1 MAPK 信号通路 MAPK 信号通路是细胞内重要的信号传递通路[11]。本研究对两组小鼠DRG 参与MAPK 信号通路的分子进行转录组分析,结果显示,实验组小鼠DRG 内在MAPK 信号通路中有124 个基因发生了差异转录,其中有53 个基因与天然免疫反应有关,其中转录水平上调及下调倍数最大的各5个基因,见表2。该结果表明,PRV 感染小鼠后可能通过调控MAPK 信号通路而影响机体炎症反应,且TNF、NTF5等基因的表达产物可能是影响该信号通路的关键接头分子。

表2 PRV感染小鼠的MAPK信号通路中转录水平升高及降低的各5条基因Table 2 Five relatively highly and lowly-transcribed genes in the MAPK signaling pathway in the PRV-infected mice
2.2.2 NOD 样受体信号通路 NOD 样受体信号通路在机体内受到广泛调控[12]。本研究对两组小鼠DRG内涉及NOD 信号通路分子的编码基因进行分析,结果显示,共有99 个基因差异转录,数量略低于MAPK 信号通路中差异转录的基因,其中转录上调及下调倍数最大的各5 个基因,见表3。该结果表明,PRV 感染小鼠后,可能通过NOD 样受体信号通路影响其体内各种信号调节因子的分泌,其中CXCL2、CCL5等可能是PRV 影响该信号通路的关键基因。

表3 PRV感染小鼠的NOD样受体信号通路中转录水平升高及降低的5条基因Table 3 Five relatively highly and lowly transcribed genes in the NLR signaling pathway in the PRV-infected mice
2.2.3 肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路 TNF 在炎症发生、细胞增殖和细胞凋亡方面具有重要作用[13]。本研究对两组小鼠DRG 内TNF受体通路中的差异转录基因分析,结果列举了转录上调及下调最显著的各5 个基因,见表4。表明PRV可能通过上述基因的转录产物调控TNF 信号通路影响机体的炎症发生、细胞增殖和细胞凋亡过程。
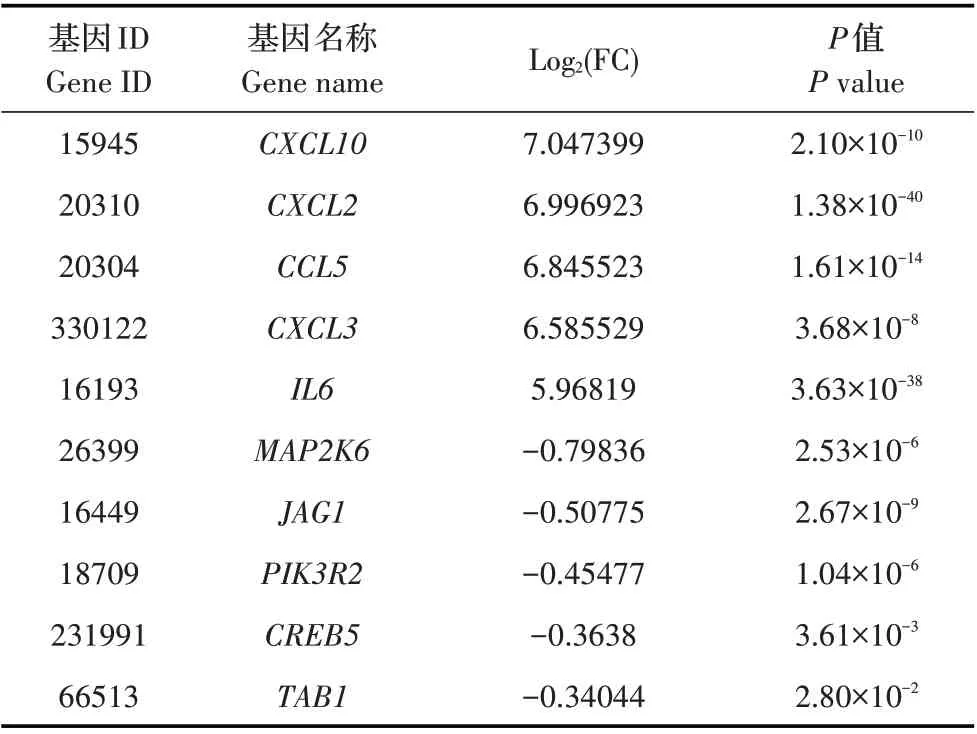
表4 PRV感染小鼠的TNF信号通路中转录水平升高及降低的5条基因Table 4 Five relatively highly and lowly transcribed genes in TNF signaling pathway in the PRV-infected mice
2.2.4 细胞凋亡信号通路 凋亡是一种细胞的程序性死亡,分为内源性凋亡和外源性凋亡[14]。本研究结果显示,PRV 感染小鼠DRG 内该通路转录水平变化的基因共有73 个,其中转录上调或下调最显著的各5 个基因,见表5。该结果表明,PRV 感染小鼠后可能通过影响上述基因的转录而影响其细胞凋亡信号通路的应答。

表5 PRV感染小鼠的细胞凋亡信号通路中转录水平升高及降低的5条基因Table 5 Five relatively highly and lowly transcribed genes in the apoptosis signaling pathway in the PRV-infected mice
2.2.5 JAK-STAT 信号通路 JAK-STAT 信号通路与炎症和自身免疫性疾病的产生有关[15]。本研究结果显示,PRV 感染小鼠后,其DRG 内JAK-STAT 通路内存在66 个基因转录水平上调或者下调,上调或下调转录水平最显著的各5 个基因,见表6。该结果表明,PRV 感染小鼠后,可能通过上述基因作为靶标而影响JAK-STAT 信号通路,进而影响其炎症反应。
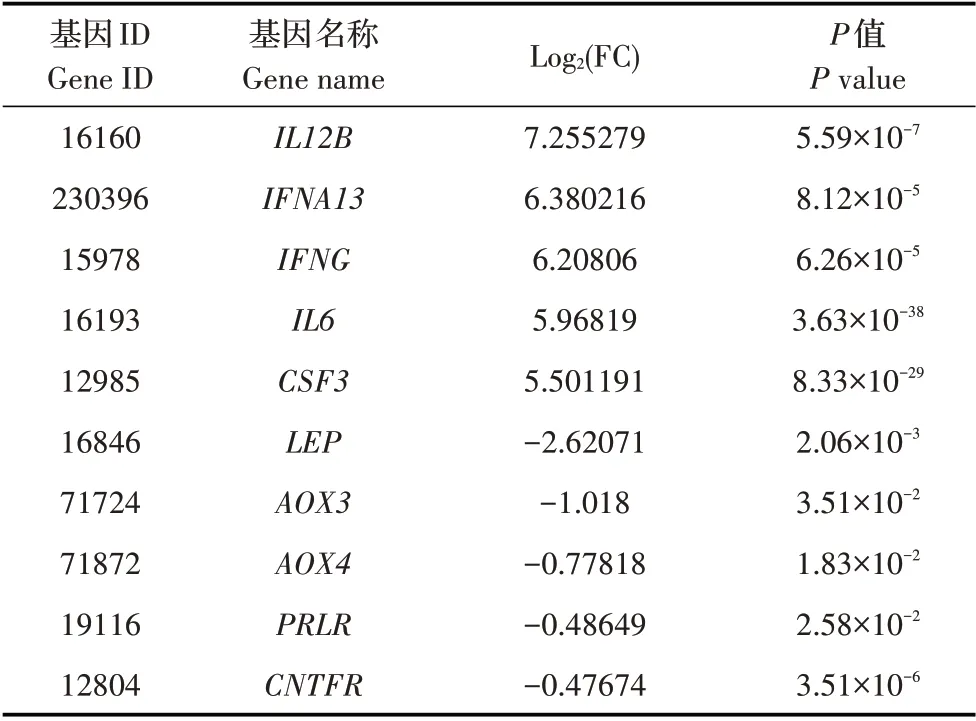
表6 PRV感染小鼠的JAK-STAT信号通路中转录水平升高及降低的5条基因Table 6 Five relatively highly and lowly-transcribed genes in JAK-STAT signaling pathway in the PRV-infected mice
2.3 差异转录基因验证根据RNA-seq 的结果,随机选取10 条差异转录的基因进行RT-qPCR 验证分析。结果显示,与对照组比较,在PRV 感染后的DRG 内CXCL1、CXCL2、CXCL9、LY6A、IFIT1、IFI44、OAS1A、MS4A6D的mRNA 转录水平上调,CRABP1、GKN3的mRNA 转录水平下调,变化趋势与转录组数据分析结果一致(图5)。表明本研究RNA-seq 测序数据具有较高的准确性和可信度。

图5 差异转录基因的RT-qPCR验证Fig.5 Verification of differentially transcribed genes by RT-qPCR
3 讨 论
PRV 是一种特殊的嗜神经性病毒[16-17],感染机体后能够进入外周神经系统并建立潜伏感染[17-19]。但是机体感染PRV 后PNS 神经元中基因的表达变化目前尚未可知。因此,本研究对感染PRV 小鼠的DRG进行了RNA-seq,并对基因的转录水平进行了分析。结果显示,DRG 中发生转录上调或下调的基因共有6 502 条,其中转录上调的基因有3 703 条,转录下调的基因有2 799 条。这些差异转录基因广泛存在于细胞膜、细胞质及其他细胞组分中,并参与细胞内的多种生物学过程。这说明PRV 感染宿主后,会对DRG 内的各种生理过程产生广泛影响。另外,差异转录的基因分布在20 种信号通路中,其中有12 条通路与天然免疫反应有关,这说明虽然PRV 的感染会对神经系统造成广泛的影响,但是主要引起天然免疫相关信号分子的变化。
天然免疫是机体抵抗外来病原侵入的第一道防线[20]。在病毒感染宿主后,机体内的天然免疫相关通路会被激活,从而发挥抗病毒作用,以清除病原并减轻自身损伤[21]。小鼠感染PRV 后,其DRG 内发生差异转录基因数量最多的前5 条天然免疫信号通路分别为MAPK 信号通路、NOD 样受体信号通路、TNF 信号通路、细胞凋亡信号通路和JAK-STAT 信号通路。MAPK 信号通路广泛参与细胞内信号转导过程,包括细胞发育、炎症发生等;NOD 样受体广泛存在于细胞质中,其在识别相应配体后能够激活NF-κB 信号通路并激活促炎性因子从而导致炎症发生;TNF 信号通路能够介导细胞凋亡;JAK-STAT 信号通路能够参与细胞的增殖、分化、凋亡以及免疫调节等生物学过程。目前,已有较多关于PRV 与宿主天然免疫信号通路相互作用的研究,如PRV 感染细胞后,TNF-α 能够通过活化p38 MAPK 和JNK/SAPK 信号通路而导致细胞发生自噬[22];另外,PRV还能通过蛋白酶体途径降解JAK 从而抑制干扰素刺激基因的表达等[23]。本研究结果与上述研究结果一致,并且还发现仍有其他天然免疫通路中的基因发生差异转录,如NOD 样受体信号通路。考虑到NOD样受体在天然免疫过程中发挥的作用,该通路中的CXCL2、CCL5 和CXCL3 可能与PRV 引起的神经炎症有关。除此之外,本研究还新发现了某些转录水平发生差异的基因,如参与细胞凋亡信号通路的GZMB基因和参与MAPK 信号通路的NTF5基因,前者能够调节炎症反应和修复细胞损伤[24],而后者是一种神经保护分子[25];上述基因在PRV 感染过程中的作用还尚见报道。
在PRV 感染过程中,宿主先天性免疫应答对于限制病毒复制和清除宿主体内病毒十分重要。本研究采用RNA-Seq 得到PRV 感染小鼠后DRG 内的详细转录组学数据,系统分析了PRV 感染机体后免疫相关基因参与的代谢途径与信号转导途径,为下一步研究机体抗PRV 反应及机体神经炎症产生的机制提供了基础。
