趋化因子CCL26 C端截短肽的抗菌活性及抗生物被膜作用的研究
2022-08-24张会会昝亚楠金明洁梁思宇刘思国
张会会,昝亚楠,金明洁,梁思宇,刘思国,谢 芳
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物细菌病研究创新团队,黑龙江 哈尔滨 150069)
耐药性致病菌的流行会严重影响养殖业的正常运转,给食品安全和生态环境带来严重危害,从而威胁人类的健康,制约经济的可持续发展[1-3]。因此,迫切需要研究和开发出针对耐药菌感染的抗菌治疗药物,来对抗日益流行的细菌耐药现象。趋化因子是一类参与多种免疫功能的低分子量蛋白质。近年来发现,许多趋化因子具有抗菌活性。趋化因子CXCL9、CXCL10 和CXCL11 能有效地杀死大肠杆菌和单核细胞增生李斯特菌[4]。随后,Yang 等对人源趋化因子进行了系统的筛选,发现45 种人源趋化因子中,有23 种(10 种CXC 型和13 种CC 型趋化因子)表现出抗菌活性[5]。其中趋化因子CCL26 具有抗菌肽在中性pH 中带正电(pI=10.85)的特性,此外其二级结构由N 端的无规则卷曲,反平行的β-链和C端的α-螺旋组成,这与抗菌肽中防御素的结构非常相似,甚至其C 末端结构域也与抗菌肽LL-37 具有高度的结构相似性[6]。研究发现,CCL26 在低盐浓度下对耐甲氧西林金黄色葡萄球菌(MASA)能够达到80%抑菌效果[7]。因此,本研究以人源抗菌趋化因子CCL26 完整序列为模板,合成具有与传统抗菌肽结构高度相似的C 末端区域的截短肽26C 作为研究对象,探究26C 的体外生物学活性,以期为新型抗菌肽的研发提供思路,为治疗耐药菌感染的临床用药奠定基础。
1 材料与方法
1.1 主要实验材料肠道外致病性大肠杆菌K1 为耐多粘菌素B(PxB)的临床分离菌株,铜绿假单胞菌ATCC 27853、人表皮角质形成细胞HaCaT 由本实验室保存;CCL26 C 端截短肽(26C,KKWVQKYISLLK-TPKQL),由上海吉尔生化有限公司合成,经过高效液相色谱纯化后纯度>98%;LB 固体和液体培养基购自美国BD 公司;胰蛋白大豆肉汤培养基(TSB)和胰蛋白大豆琼脂培养基(TSA)购自英国OXOID 公司;磷酸盐缓冲液(PBS)购自北京Coolaber 公司;MEM 培养基、胰蛋白酶、胎牛血清(FBS)、链霉素和青霉素购自美国Gibco 公司;结晶紫、DMSO、3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐(MTT)购自哈尔滨市牧乐生物试剂有限公司;1-N-苯基萘胺(NPN)、PxB 购自上海麦克林生化科技有限公司;细胞凋亡诱导剂(CCCP,50 mmol/L)购自北京索莱宝生物科技有限公司;Triton X-100、HEPES、Adenosine 5'-triphosphate(ATP)Bioluminescent Assay Kit 购 自 美国Sigma-Aldrich 公司。
1.2 26C 对大肠杆菌K1 的浓度-杀菌曲线的测定待大肠杆菌K1 株培养至对数生长期时收集菌体,用PBS 清洗3 次并调整为2×105cfu/mL,加入终浓度分别为0、1 μmol/L、2 μmol/L、4 μmol/L 的26C,置于37 ℃孵育3 h。取100 μL 菌液,10 倍倍比稀释后涂板。待干燥后倒置放入37 ℃孵育24 h 后,参照De Breij 等的方法测定26C 在不同浓度下对大肠杆菌K1的杀菌效率[8],绘制浓度-杀菌曲线。
1.3 26C 对大肠杆菌外膜通透性影响的测定将培养至对数期的大肠杆菌K1 重悬于含有5 μmol/L CCCP、5 mmol/L 葡萄糖的HEPES 缓冲液中,调整OD600nm约为0.5 后,于96 孔板中每孔加入100 μL 菌液,然后加入10 μmol/L NPN 平衡30 s,再加入终浓度为2 μmol/L的26C,在37 ℃条件下使用多功能酶标仪每隔30 min检测一次荧光强度,以相同浓度的PxB 作为阳性对照,采用NPN 测定26C 对细菌外膜的通透性[9]。试验重复3次,根据多功能酶标仪测定的荧光值绘图。
1.4 26C对大肠杆菌ATP泄露影响的测定取对数生长期的大肠杆菌K1,收集菌体后用PBS 和50 mmol/L的HEPES各洗一遍,采用HEPES重悬至OD600nm约为1,加入0.2%的glucose 活化10 min,立即用26C 处理细菌悬液,每孔加入100 μL的ATP检测液,静置3 min,将80 μL DMSO 透化加入20 μL 上述细菌悬液,稀释于4.9 mL 无菌水中,利用ATP Bioluminescent Assay Kit检测ATP 总量;同时将80 μL 无菌水加入20 μL 大肠杆菌K1 细菌悬液中后稀释于4.9 mL 无菌水中,利用ATP Bioluminescent Assay Kit 测定胞外ATP(ATP EC)的含量,通过多功能酶标仪读取荧光值,并计算胞内ATP(ATP IC)的含量,胞内ATP=ATP 总量-胞外ATP,通过比较胞外ATP 和胞内ATP 的差异绘图。
1.5 通过透射电镜观察26C 对大肠杆菌细胞膜的影响细菌处理方法如1.2,将重悬菌液与2 μmol/L 的26C 作用,37 ℃孵育1 h 后用PBS 洗涤2 次后离心弃上清,收集菌体,2.5%戊二醛4 ℃静止过夜。PBS 缓冲液冲洗3 次。2%的四氧化二锇固定2 h,PBS 缓冲液冲洗2 次。分别利用50%、70%、90%和100%乙醇各脱水10 min。100%丙酮处理20 min,再用丙酮(1:1)树脂(1:3)混合液处理1 h 后用纯树脂包埋过夜。将其制成超薄切片并用醋酸铀酰和柠檬酸铅染色,以不加26C 的大肠杆菌为对照室温干燥后采用透射电镜观察26C 对大肠杆菌细胞膜的影响并拍照。
1.6 26C 对铜绿假单胞菌生物被膜(BF)形成影响的测定于96 孔板中分别加入浓度为8 μmol/L、4 μmol/L、2 μmol/L、1 μmol/L、0 的26C 后,各孔分别 加 入50 μL 浓 度 为2×106cfu/mL 铜 绿 假 单 胞 菌 菌液,混匀后置于37 ℃孵育36 h,弃去浮游细菌,PBS 洗3 遍,甲醇固定晾干后加150 μL 结晶紫,作用5 min,纯水洗3 遍,晾干后加150 μL 33%冰醋酸溶液溶解,轻轻混匀,测定OD490nm值,参考Rajasek-aran 等的方法测定26C 对细菌BF 形成的影响[10]。
同时将500 μL 浓度为2×106cfu/mL 铜绿假单胞菌菌液加入共聚焦小皿,加入26C 使其终浓度为2 μmol/L、1 μmol/L、0,37 ℃静置培养36 h,PBS 洗涤2 次后,利用细菌活力检测试剂盒染色,通过激光共聚焦显微镜观察26C 对BF 形成的影响。
1.7 26C 对红细胞溶血活性影响的测定静脉采集人的新鲜血液,制备成4%的人红细胞悬液。将200 μL 浓度分别为2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L 和128 μmol/L 的26C 或0.2% Triton X-100 与200 μL 的 红 细 胞 悬 液 在37 ℃孵育1 h后,室温800 r/min离心10 min,取100 μL上清测定OD415nm值。设等体积的PBS(pH7.4)处理组作为阴性对照,以0.2% Triton X-100 处理组作为阳性对照。根据式(1)计算溶血率后作图。
式(1):%溶血率=100×[(A-A0)]/[(AT-A0)],式中:A 为加肽样品OD415nm值;A0和AT分别代表阴性值和阳性值。
1.8 26C对HaCaT细胞毒性的测定HaCaT细胞采用1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L 的26C 在MEM 培养基中37 ℃、5%CO2孵育24 h后,采用MTT法评价26C的细胞毒性[9]。试验以无肽处理的细胞作为空白对照组,并按式(2)计算抑制率后作图。式(2)抑制率(%)=(对照组OD570nm均值-给药组OD570nm均值)/对照组OD570nm均值×100%。
1.9 统计学分析采用GraphPad Prism 8.0 软件对实验结果进行数据统计,采用t检验法进行组间显著性分析并作图,P>0.05 为差异不显著;P≤0.05 为差异显著。
2 结 果
2.1 26C 浓度-杀菌曲线的测定结果为探究26C在不同浓度下的杀菌能力,本研究将不同浓度的26C与大肠杆菌菌株K1 共同孵育3 h,根据杀菌效果绘制浓度-杀菌曲线。结果显示,与对照组相比,1 μmol/L 的26C 与K1 菌株作用3 h 具有一定的杀菌效果(P<0.05),2 μmol/L 和4 μmol/L 的26C 与K1 菌株作用3 h 后可以有效地杀灭细菌(P<0.001),抗菌效果呈剂量依赖性,且在4 μmol/L 时即可完全杀灭细菌,使得细菌活菌数降低4log(图1)。结果表明,26C 在不同浓度下均可有效杀灭细菌。
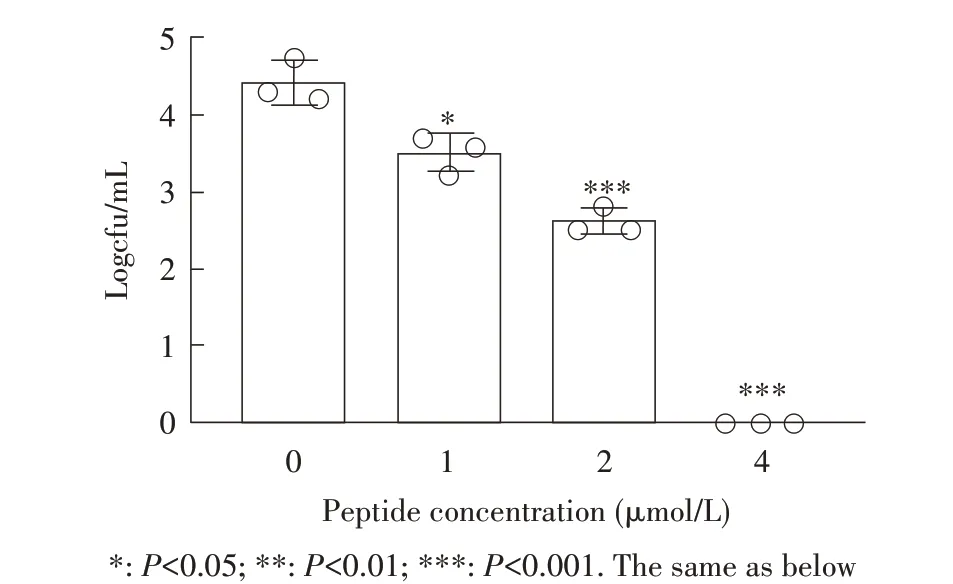
图1 26C对E.coli 菌株K1的浓度-杀菌曲线Fig.1 Concentration-kill curve of 26C to E.coli K1
2.2 26C 对大肠杆菌外膜通透性影响的测定结果疏水探针NPN 在非极性或疏水环境中会发出强烈的荧光,因此常用来检测细胞膜的完整性。本研究通过NPN 摄取量检测26C 对细菌的损伤程度,并以对大多数革兰氏阴性杆菌具有杀菌作用的多肽分子PxB作为研究细菌外膜通透性的阳性对照。结果显示,与阳性对照组相比,26C 作用细菌30 min 后观察到荧光强度显著增加(P<0.01),在作用后60 min~240 min内荧光强度极显著增加(P<0.001),并且随着26C 作用时间延长,NPN 的荧光强度逐渐增加,说明细菌外膜的通透性逐渐变大,且呈现时间依赖性。阳性对照PxB 也改变了细菌外膜通透性,但其效果明显不如26C(图2)。结果表明,随着作用时间的延长,26C 可有效改变大肠杆菌细胞膜的通透性。

图2 26C对大肠杆菌的外膜通透性影响的检测结果Fig.2 The effect of 26C on the permeability of the outer membrane of E.coli
2.3 26C 对大肠杆菌ATP 泄露影响的测定结果当细菌细胞膜损伤后,会导致菌体内容物泄露,继而杀死细菌。因此,ATP 泄漏分析可用于评估26C干扰细菌的能力。本研究利用ATP 泄露实验测定了26C对大肠杆菌的干扰能力,结果显示,在2 μmol/L时大肠杆菌胞外ATP 显著增加(P<0.05),4 μmol/L 时胞外ATP 极显著增加(P<0.001),说明细胞膜被严重破坏,导致菌体内容物及代谢产物泄露;在较低浓度时(1 μmol/L),观察到胞外ATP的泄露有限,说明细胞膜未被完全破坏或存在其他作用靶标(图3)。结果表明,2 μmol/L 的26C 作用于大肠杆菌即可显著破坏细菌细胞膜,导致菌体内ATP外泄,降低细菌存活率。
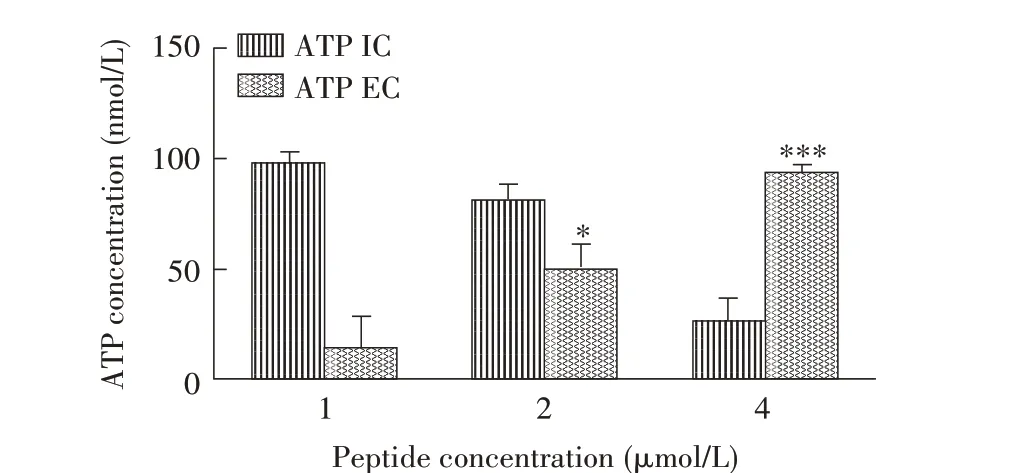
图3 26C处理细菌细胞后细胞内(IC)和细胞外(EC)ATP的测定Fig.3 Measurement of intracellular(IC)and extracellular(EC)of level ATP after 26C treatment
2.4 26C 对细菌细胞膜的损伤作用将2 μmol/L 26C 与大肠杆菌共孵育1 h 后,制成超薄切片并在透射电子显微镜下观察细菌细胞膜形态。结果显示,对照组菌体保持完好的细胞形态,胞质均匀,内容物充实,无胞浆外泄现象。经26C 作用后,菌体出现明显的质壁分离并伴有不同程度的膜损伤(箭头所示),导致菌体内容物泄露(图4)。结果表明,26C可破坏细菌细胞膜,从而有效地杀伤细菌。
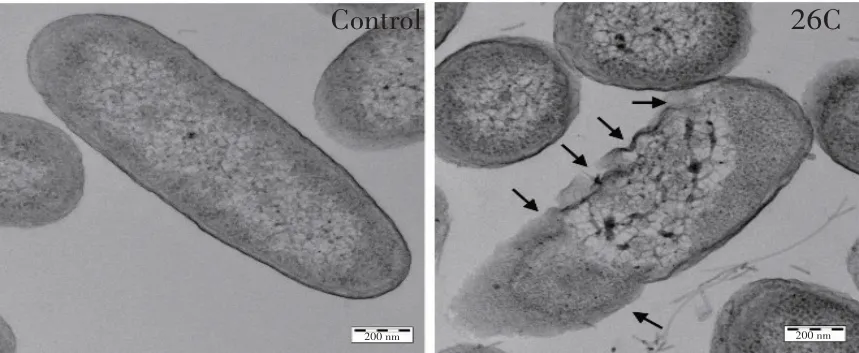
图4 透射电镜观察26C对细菌细胞膜的损伤作用Fig.4 Effects of 26C on bacterial cell membrane by TEM
2.5 26C 对铜绿假单胞菌BF 形成能力影响的测定铜绿假单胞菌为适应环境所形成的BF 大大削弱了抗生素的杀菌效果,本研究测定了不同浓度水平下26C抑制BF形成的能力。通过结晶紫染色法检测发现,26C在1 μmol/L~2 μmol/L 可有效抑制铜绿假单胞菌BF 的形成(P<0.01),在4 μmol/L~8 μmol/L 时26C 抑制BF 形成的能力极显著高于对照组(P<0.001)(图5A)。采用激光共聚焦显微镜观察发现,26C 在1 μmol/L 浓度下即可显著抑制铜绿假单胞菌的BF 的形成(图5B)。结果表明,26C 在低浓度即可显著抑制铜绿假单胞菌BF 的形成,且抑制效果呈现剂量依赖性。

图5 利用结晶紫法(A)和激光共聚焦显微镜(B)观察26C抑制细菌BF形成的能力Fig.5 The antibiofilm ability of 26C was observed by crystal violet method(A)and laser confocal microscope(B)
2.6 26C 对人红细胞的溶血活性及细胞毒性测定结果天然抗菌肽因易溶解红细胞引起全身毒性而限制了其用于临床治疗,为测定26C对红细胞的溶血活性,本研究将不同浓度的26C 分别与人红细胞孵育1 h后测定上清OD415nm值,计算抗菌肽对人红细胞的溶血活性(%)。结果显示,与阳性对照相比,在最高浓度下,26C 对人红细胞溶血活性极低(P<0.001),仅为0.85%(图6)。结果表明,26C对人红细胞无溶血活性,有作为临床用药开发的潜力。为明确26C对哺乳动物细胞的毒性,采用MTT 法检测26C 对HaCaT 的细胞毒性。结果显示,与空白对照组相比,1 μmol/L~16 μmol/L 26C对HaCaT细胞无毒性,32 μmol/L~64 μmol/L 26C有较低的细胞毒性(P<0.05)(图7)。此时肽浓度已远远高于其杀菌浓度。结果表明,26C 对哺乳动物细胞 无毒性,有作为临床用药开发的潜力。

图6 26C对人红细胞的溶血活性的测定Fig.6 Hemolytic activity of 26C on human red blood cells

图7 26C对人表皮角质形成细胞HaCaT的细胞毒性的测定Fig.7 The cytotoxicity of 26C to human epidermal keratinocyte cells HaCaT
3 讨 论
过去几十年抗生素滥用造成细菌多重耐药菌大量出现[11],而养殖业这种现象尤为严重。据保守估计,2010 年~2030 年我国养殖业抗生素的消耗量至少还将增加一倍,达到全球总量的近1/3,给公共卫生安全带来极大的威胁[12]。随着我国减抗无抗政策的制定和实施,新型抗菌制剂的研制迫在眉睫。
趋化因子不仅在调节白细胞迁移方面发挥关键作用,而且在天然免疫和适应性免疫反应方面也发挥重要作用,与趋化因子相关的新功能之一是其作为抗菌药物应用的能力[7]。许多趋化因子的C 端结构域与阳离子的α-螺旋抗菌肽的相似性较高,可见C末端螺旋区域是趋化因子抗菌活性的主要区域。而在某些情况下,分子内的相互作用可能会中和带正电的C 末端α-螺旋,掩盖它的的抗菌活性,这表明或许需要对某些成熟的趋化因子进行截短,才能完整的保留其抗菌活性。研究发现,CCL26 在低盐浓度(10 mmol/L)下对MASA 具有一定的抗菌活性,而对其他细菌的抗菌活性还未报道[7],因此本研究合成了抗菌趋化因子CCL26 具有α-螺旋结构的C 端截短肽26C,并测定其对耐PxB 的大肠杆菌K1 菌株的抗菌活性,发现其在低浓度下即可有效杀灭大肠杆菌,表明26C 对耐PxB 的肠道外致病菌具有较强的杀菌活性。
抗菌肽大多具有阳离子表面和疏水表面的两亲性,这可能促进抗菌肽与带负电的微生物表面相互作用[13]。这种相互作用可能是通过插入脂膜和破坏细菌膜而杀死细菌,本研究NPN 和ATP 的测定结果均显示26C 在2 μmol/L 的浓度下具有显著干扰细菌通透性及代谢稳定性的能力,这表明26C 可能插入到细菌细胞膜中,增加了膜的通透性导致细菌内容物泄露而死亡。为了获得更多关于26C 潜在作用机制的信息,本研究对肽作用后的细菌表面进行透射电镜观察,结果显示26C 影响大肠杆菌的表面,可能是通过静电作用与细胞膜上带负电荷的成分结合,引起外膜通透性改变,导致细菌细胞内容物的泄漏而造成损伤,最终导致细菌死亡,这也印证了上述NPN 和ATP 的测定结果。
BF 内细菌对抗生素和其他药物耐受性强,并能逃避宿主的免疫杀伤,抗菌肽因其独特的膜作用杀菌机制能抑制BF 的形成或降解BF[8]。为了研究26C对细菌BF 的作用,本研究通过结晶紫染色法检测26C 对铜绿假单胞菌BF 的影响,结果显示26C 对铜绿假单胞菌BF 形成具有显著抑制作用,并且随着26C 浓度升高抑制作用也明显增强,这为预防医疗器械等医源性慢性感染提供了参考。本研究进一步通过激光共聚焦显微镜观察,结果显示与阳性对照相比,26C 在低浓度下能够显著抑制BF 的形成。该结果进一步支持本研究上述结论。此外,26C 对哺乳动物无溶血活性,且在1 μmol/L~16 μmol/L 对哺乳动物细胞无毒性,说明其具有作为新型抗菌肽开发的潜力。
综上所述,本研究中趋化因子CCL26 的C 端截短肽26C 具有显著的抗菌活性,可以有效地降低耐药大肠杆菌菌株的存活率;并能干扰细菌外膜通透性,造成细菌严重损伤而死亡;同时可以抑制铜绿假单胞菌BF 的形成;无溶血活性,对哺乳动物细胞毒性较低,具备作为临床药物开发的潜力。本研究为新型抗菌肽的研发提供了思路,也为趋化因子抗菌肽的临床应用奠定了基础。
