欧洲型PRRSV竞争ELISA抗体检测方法的建立及应用
2022-08-24相丽润张文立汤艳东龚邦俊李宛生彭金美周国辉冷超粮安同庆蔡雪辉张洪亮田志军
许 浒,相丽润,张文立,汤艳东,赵 静,李 超,龚邦俊,李宛生,付 军,彭金美,王 倩,周国辉,冷超粮,安同庆,蔡雪辉*,张洪亮*,田志军*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点猪病实验室,黑龙江 哈尔滨 150069;2.南阳师范学院,河南 南阳 473061)
猪繁殖与呼吸综合征(Porcine reproductive and re-spiratory syndrome,PRRS)是由PRRS 病毒(PRRSV)引起的以母猪流产和仔猪呼吸道症状为主要特征的高度传染性疾病[1]。之前,PRRSV 被定义为动脉炎病毒科、动脉炎病毒属成员,根据地理分布及遗传演化分析,PRRSV 被分为2 个基因型:PRRSV-1(欧洲型)和PRRSV-2(美洲型)[2]。2021 年3 月,国际微生物学会联合会病毒学组设立的国际病毒分类委员会(ICTV)正式批准将PRRSV 归于动脉炎病毒科,β-动脉炎病毒属(Betaarterivirus)。PRRSV-1 是Eurpo-bartevirus亚 属,Betaarterivirus suid 1种 成 员, 而PRRSV-2 是Ampobartevirus亚属,Betaarterivirus suid 2种成员。在重新分类后PRRSV-1 和PRRSV-2 不再属于同一种的两个基因型,而是属于不同的亚属和种。我国于1997 年首次分离到PRRSV-1 株并命名为B1株[3],自2011 年来,中国关于PRRSV-1 的报道逐渐增多,已有广东、辽宁等6 个省份报道出现了PRRSV-1[4-8]。目前国内对PRRSV-1 的检测主要是针对病原核酸,缺少特异性针对PRRSV-1 的血清学检测方法。由于PRRSV-1 和PRRSV-2 不再属于同一亚属,因此建立针对PRRSV-1 的特异性血清学检测方法,对了解PRRSV-1 在我国的流行情况和有效防控该病具有重要的意义。
在众多血清学检测方法中,酶联免疫吸附试验(ELISA)具有操作简便、试验时间短、易于标准化的特点,适合用于大范围流行病学调查。目前市场上常见的商品化抗体检测试剂盒主要是PRRSV N 蛋白和膜蛋白(M 蛋白、GP2、GP3、GP4、GP5)间接ELISA 试剂盒[9]。大多数试剂盒均可检测PRRSV-1 和PRRSV-2的抗体,仅有两个未获生产批号的PRRSV-1抗体试剂盒,它们分别以体外表达PRRSV-1 的GP5(试剂盒1)和部分膜蛋白(试剂盒2)为包被抗原,对试剂盒1 检测PRRSV-1 的抗体情况尚未报道,而国外多篇报道均证实了试剂盒2 并不能特异性检测PRRSV-1 抗体,且敏感性较差[10-11]。
本研究以特异性识别PRRSV-1 的单克隆抗体(MAb,EU-1)为竞争抗体,建立了一种快速检测PRRSV-1 抗体的竞争ELISA(EU-C-ELISA)方法,为我国PRRSV-1 的流行病学调查提供方法。
1 材料与方法
1.1 病毒、血清和抗体ZD-1株(PRRSV-1,经分子筛 纯 化 后 浓 度 为 455 ng/μL)[8]、 HNTZJ1341(NADC34-like)、HNTZJ1714(QYYZ-like)由本实验室分离并保存;116 份PRRSV-1 阳性血清、10 份阴性 血 清(PRRSV-1 和PRRSV-2 双 阴 性 血 清)、PRRSV-2 动物实验阳性血清共273 份,其中170 份为HuN4-F112 免疫及HuN4(HP-PRRSV)攻毒血清;60份SD-R 免疫血清及SD(NADC30-like)攻毒血清;12份WK108(NADC30-like)攻毒血清;6 份DZD32-1901(NADC34-like)攻毒血清;8份SD192(ATCC VR2332-like)攻毒血清;14 份CH-1R(经典PRRSV)免疫血清、PRRSV-1(DV 株)、副猪嗜血杆菌(HPS)、猪链球菌(SS)、胸膜肺炎放线杆菌(APP)、猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)、猪伪狂犬病毒(PRV)、猪瘟病毒(CSFV)、口蹄疫病毒(FMDV)等猪常见病毒和细菌的阳性血清样品均由哈尔滨兽医研究所保存;432 份临床血清于2020 年采自4 个省(黑龙江、辽宁、河北、山东)10 个猪场;PRRSV-1 MAb EU-1 及2C6、PRRSV-2 MAb 3F7 均由本实验室制备并保存。
1.2 主要试剂DMEM 培养基购自GIBCO 公司;胎牛血清购自CLARK 公司;FITC 标记山羊抗小鼠IgG(FITC-IgG)均购自Sigma 公司;山羊抗鼠IgG-HRP购自北京中杉金桥生物技术有限公司;TMB 显色液购自Sigma 公司;BCA 蛋白浓度定量试剂盒购自碧云天生物技术研究所;ELISA 包被板购自JET Bio star公司;牛血清白蛋白(BSA)购自Sigma 公司;PRRSV抗体检测试剂盒分别购自北京爱德士(IDEXX)、北京金诺百泰生物技术有限公司(金诺)、世纪元亨生物科技有限公司(试剂盒1)和北京天之泰生物科技有限公司(试剂盒2)。
1.3 PRRSV-1 MAb EU-1 特异性检测将野毒株ZD-1、HNTZJ1341、HNTZJ1714 及疫苗株HBL、SD-R、HuN4-F112、CH-1R、RespPRRS MLV 和DV 接种Marc-145 细胞。以500 μL MAb EU-1 上清为一抗, 37 ℃孵育30 min,PBS 洗涤3 次,以300 μL 山羊抗小鼠IgG-FITC(1:200)为二抗,采用间接免疫荧光试验(IFA)方 法 检 测MAb EU-1 与 各 类 型PRRSV 的交叉反应性。分别以本实验室已制备的MAb 2C6(PRRSV-1)和3F7(PRRSV-2)为IFA 方法的阳性对照。
1.4 EU-C-ELISA 方法的建立及反应条件的优化将纯化后的ZD-1 株全病毒分别用磷酸盐缓冲液(pH7.4)、Tris-HCL 缓冲液(pH8.5)和碳酸盐包被液(pH9.6)稀释(910 ng/孔、455 ng/孔、227.5 ng/孔),确定最优条件后100 μL/孔加样后置4 ℃包被,利用方阵法,对包被时间(8 h、12 h、15 h),300 μL BSA浓度(1%、2%、3%),37 ℃封闭时间(1 h、2 h、3 h),PRRSV-1 MAb EU-1 稀释倍数(1:2~1:16),37 ℃孵育时间(20 min、30 min、60 min),100 μL 山羊抗鼠IgG-HRP 抗稀释倍数(1:5 000、1:10 000、1:20 000),显色时间(10 min、15 min、20 min)进行优化。测定OD450nm值,计算抑制率(Percentage inhibition,PI),PI(%)=(阴性血清OD450nm值-阳性血清OD450nm值/阴性血清OD450nm值)×100%,选取PI值最大的反应条件为最优。
1.5 阴阳性临界值的确定将10 份阴性血清、273份PRRSV-2 阳 性 血 清(PRRSV-1 阴 性)、116 份PRRSV-1 阳性血清,按照优化的EU-C-ELISA 方法检测,测定OD450nm值后按PI(%)=(阴性血清OD450nm值-样品血清OD450nm值/阴性血清OD450nm值)×100 %转换为PI,用MedCalcv15.8 软件进行交互式点图分析,确定临界值。
1.6 特异性试验按照优化的EU-C-ELISA 条件检测HPS、SS、APP、TGEV、PEDV、PRV、CSFV、FMDV、PRRSV-2 NADC30-like 疫苗候选株SD-R、高致病性株HuN4-F112、NADC30-like 株WK108、ATCC VR2332-like 株SD192、NADC34-like 株DZD32、经典株CH-1R、PRRSV-1 株ZD-1、PRRSV-1 株WK14、PRRSV-1 株WG9 阳性血清,根据临界值判定检测血清样品的阴阳性;利用本研究建立的EU-C-ELISA方法和两种市售PRRSV-1 抗体试剂盒检测18 份PRRSV-2 实验动物血清(在各谱系实验动物血清中随机选取)。评估以上方法与PRRSV-2 抗体的交叉反应性。
1.7 敏感性试验将PRRSV-1 标准阳性血清2 倍倍比(1:1~1:64)稀释,按优化的EU-C-ELISA 条件进行检测,根据临界值判定阴阳性,评估该方法的敏感性。同时利用4 种试剂盒:IDEXX、金诺及市售两种PRRSV-1 抗体试剂盒对上述血清进行检测,比较5 种方法敏感性差异。
1.8 抗体产生时间检测将PRRSV-1 ZD-1 株以1×105.0TCID50/mL 感染5 头PRRSV 抗原抗体双阴性猪,感染后0、3 d、7 d、10 d、14 d、17 d、21 d采集猪血清样品,按照建立的EU-C-ELISA 进行检测,并与IDEXX试剂盒的检测结果进行比较,分析两种方法对PRRSV-1 感染猪后血清抗体阳转时间的差异。
1.9 重复性试验按照优化的EU-C-ELISA 方法,从同一批次包被的ELISA 板挑取3 块,分别检测上述5 份血清样品,进行批内重复性试验,对结果进行统计学分析。另外,按照优化的EU-C-ELISA 方法,从不同批次包被的ELISA 板中挑取3 块,分别检测上述5 份血清样品,进行批间重复性试验,对结果进行统计学分析。
1.10 临床样品的检测 采用本研究建立的EU-CELISA 方法对2020 年我国4 个省份10 个猪场收集的432 份猪血清样品进行检测,初步确定PRRSV-1 在我国部分地区的流行情况。
2 结 果
2.1 MAb EU-1 特异性检测结果EU-1 特异性检测结果显示,EU-1 与PRRSV-2 HuN4-F112、CH-1R、SD-R、 RespPRRS MLV、 HNTZJ1714、 HNTZJ1341 株均不反应,与PRRSV-1 ZD-1、DV 和HBL 株均反应良好(图1)。表明EU-1 仅与PRRSV-1 反应,而不与PRRSV-2 反应,特异性较强。
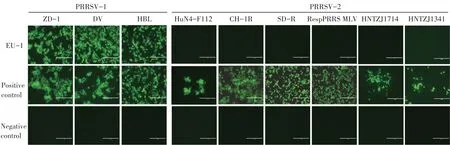
图1 MAb EU-1与各类型PRRSV的IFA结果Fig.1 IFA results between MAb EU-1 agains various types of PRRSV
2.2 EU-C-ELISA 方法的建立及反应条件的确定经方阵滴定法优化的EU-C-ELISA 方法的最佳包被液为碳酸盐缓冲液,其他最佳反应条件见表1。

表1 EU-C-ELISA 检测方法反应条件的优化结果Table 1 The optimized conditions of EU-C-ELISA
2.3 EU-C-ELISA 临界值的确定利用优化后的EU-C-ELISA 方法检测10 份阴性血清、 273 份PRRSV-2阳性血清(PRRSV-1阴性)及116份PRRSV-1阳性血清(PRRSV-2 阴性),经MedCalcv15.8 软件分析结果显示,当敏感性为97.7%,特异性为100%时,其最优的cut-off 值为45(图2)。因此,当血清样品的PI ≥45%时,判定结果为阳性,当血清样品的PI<45%时,判定为阴性。

图2 EU-C-ELISA 临界值确定Fig.2 Determination of the critical value of EU-C-ELISA
2.4 特异性试验结果利用该EU-C-ELISA 方法检测HPS、SS、APP、TGEV、PEDV、PRV、CSFV、FM-DV、PRRSV-2 NADC30-like 疫苗候选株SD-R、高致病性株HuN4-F112、NADC30-like 株WK108、ATCC VR2332-like 株SD192、NADC34-like 株DZD32、经典株CH-1R 、PRRSV-1 株ZD-1、PRRSV-1 株WK14、PRRSV-1 株WG9 阳性血清,结果显示该方法仅能与PRRSV-1 阳性血清特异性竞争包被抗原,PRRSV-2各谱系病毒株及其他猪常见猪病毒和细菌阳性血清PI 值均远低于临界值(图3),结果表明本研究建立的EU-C-ELISA 方法能够特异性识别PRRSV-1 抗体,特异性较强。

图3 EU-C-ELISA 特异性试验结果Fig.3 Specificity test results of EU-C-ELISA
将建立的EU-C-ELISA 方法与市售两种PRRSV-1 ELISA 抗体检测试剂盒进行比较,在273 份PRRSV-2各谱系动物实验阳性血清中随机选取18 份检测,结果显示两种市售试剂盒均与PRRSV-2 抗体存在明显交叉反应,试剂盒1 阳性率为44.4%,试剂盒2 阳性率为27.8%,而本研究建立的EU-C-ELISA 方法检测均为阴性(图4),结果表明本研究建立的EU-C-ELI-SA 特异性明显优于其他两种市售PRRSV-1 ELISA 抗体试剂盒。

图4 EU-C-ELISA 与其他PRRSV-1 ELISA抗体检测方法特异性的比较Fig.4 Specificity comparison between EU-C-ELISA and other PRRSV-1 ELISA antibody detection kits
2.5 敏感性试验结果利用建立的EU-C-ELISA 方法检测2 倍倍比稀释的PRRSV-1 ZD-1 株阳性血清,结果显示PRRSV 阳性血清稀释倍数为1:16 时PI 仍大于临界值;市售PRRSV-1 试剂盒1、2 分别能检出最高4 倍和2 倍稀释的PRRSV-1 标准阳性血清,IDEXX 试剂盒和金诺试剂盒分别能检出最高8 倍和2 倍稀释的PRRSV-1 标准阳性血清(图5),以上结果表明本研究建立的EU-C-ELISA 方法的敏感性更高。
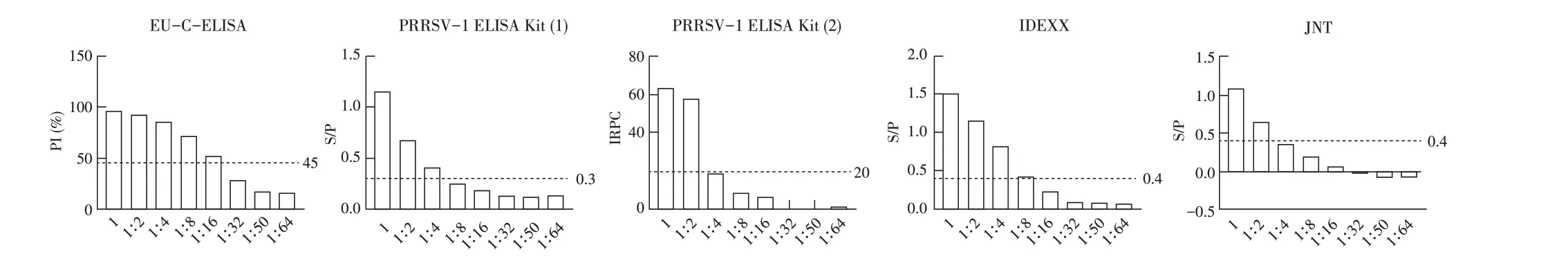
图5 EU-C-ELISA 与其他PRRSV抗体检测试剂盒敏感性的比较Fig.5 Sensitivity comparison between EU-C-ELISA and other PRRSV antibody detection kits
2.6 抗体产生时间的检测结果利用建立的EU-CELISA 方法及IDEXX 试剂盒检测了ZD-1 株感染后0、3 d、7 d、10 d、14 d、17 d、21 d 的血清,结果显示,EU-C-ELISA 及IDEXX 试剂盒均在猪感染后10 d检测出血清阳转(图6),因此本研究建立的EU-CELISA 方法可以在猪感染PRRSV-1 早期检测出抗体阳性,猪抗体的阳转时间与IDEXX 试剂盒检测的结果基本一致。

图6 EU-C-ELISA 与IDEXX试剂盒检测PRRSV-1抗体阳转时间的比较Fig.6 Comparison of PRRSV-1 antibody conversion time between EU-C-ELISA and IDEXX kit
2.7 重复性试验结果利用建立的EU-C-ELISA 方法进行重复性试验,结果显示批内和批间重复试验变异系数均小于5%(表2),表明该方法的重复性较好。

表2 EU-C-ELISA 方法批内和批间重复性试验结果(n=5)Table 2 The results of intra-and inter repeatability test by EU-C-ELISA(n=5)
2.8 临床样品的检测结果利用该EU-C-ELISA 方法对2020 年从黑龙江(3)、辽宁(3)、河北(2)、山东(2)省10 个猪场采集的432 份临床血清样品进行检测,结果显示共有2 个猪场检出PRRSV 阳性,猪场阳性率为20%,样品阳性率为15.0%。其中黑龙江省和河北省各有1 个猪场存在阳性样品,阳性率分别为45.5%和62.5%,其余8个猪场血清样品则均为阴性(图7)。以上结果表明PRRSV-1可能已在我国部分地区呈现一定的流行。

图7 EU-C-ELISA 检测部分地区猪场临床样品的结果Fig.7 The results of clinical samples in pig farms of some partial regions detected by EU-C-ELISA
3 讨 论
本实验室多年以来一直对我国PRRSV 进行监测,近5 年以来PRRSV-1 的检出数量明显增加[8]。由于抗原检测样品多为流产或死亡猪的组织病料,而我国流行的PRRSV-1 致病性普遍较低,抗原检测可能出现大量漏检情况。在中和试验(SN)、免疫过氧化物酶单层试验(IPMA)、IFA 及多种ELISA 抗体检测方法中,ELISA 是最为常用的PRRSV 抗体检测方法。IDEXX 间接ELISA 试剂盒,由于其高灵敏度、特异性和重复性,被作为检测抗PRRSV 抗体的行业标准[12],但其不能区分PRRSV-1 和PRRSV-2 的抗体。因此,为了了解PRRSV-1 在我国的流行情况,有必要建立一种能够特异性识别PRRSV-1 抗体的ELISA 试剂盒。
本研究通过超离纯化获得的PRRSV-1 型ZD-1 株全病毒作为包被抗原,相比于人工表达的抗原蛋白,其保留了抗原表位的天然构象,提高了抗体的结合准确度;以PRRSV-1 型MAb EU-1 为竞争抗体,特异性的PRRSV MAb 与阳性猪血清中PRRSV-1 抗体竞争结合抗原蛋白,比阻断ELISA 方法更简便省时,相比于市售大多数间接ELISA 方法可以明显减少假阳性的出现。该方法与我国流行的各谱系PRRSV-2阳性血清均无交叉反应,结果明显优于两种市售PRRSV-1 间接ELISA 试剂盒,特异性可以达到100%。 也印证了现有市售ELISA 方法无法对PRRSV-1 抗体进行鉴别检测的事实。通常间接ELI-SA 方法相比于C-ELISA 的敏感性更高,但在敏感性试验中,该方法能检测出16 倍稀释的标准阳性血清,在与4 种市售间接ELISA 比较时,不仅优于PRRSV-1 抗体试剂盒的4 倍和2 倍,甚至比检测N 蛋白抗体的IDEXX 及金诺ELISA 试剂盒敏感性更高。同时该方法最早可在猪感染后10 d 检测到PRRSV-1抗体,结果与IDEXX 方法一致,可以较早的检测到感染PRRSV-1 猪血清样品中的抗体。
采用建立的EU-C-ELISA 方法对我国PRRSV-1进行初步的流行病学调查,对2020 年采自黑龙江(3)、辽宁(3)、河北(2)、山东(2)省10 个猪场采集的432 份临床血清样品进行检测。有2 个猪场检出PRRSV-1 抗体为阳性,猪场阳性率达20%;两个阳性猪场的样品阳性率分别为45.5%和62.5%;10 猪场样品总阳性率为15.0%。同时利用本实验室建立的PRRSV-2 M 蛋白抗体C-ELISA 方法对65 份PRRSV-1阳性临床样品进行了检测[9],该方法可以特异性检测PRRSV-2 抗体,其中PRRSV-2 阳性样品为61 份,阳性率高达93.8%,这可能与部分猪场免疫PRRSV-2疫苗有关,也可能与PRRSV-2 在我国流行范围较广相关。虽然本研究中血清样品数量和采集范围有限,但现有结果表明我国部分地区的猪群中已存在PRRSV-1 抗体。下一步本研究室将增大对被检临床样品的数量及样品具体背景信息的了解,以便进一步明确PRRSV-1 在我国的具体流行状况。
综上所述,本研究建立了一种快速检测PRRSV-1 抗体的EU-C-ELISA 方法,具有良好的特异性、敏感性和重复性。为PRRSV-1 的流行病学调查供了一种简便、快速、特异的血清学抗体检测方法,初步流行病学调查显示,PRRSV-1 抗体已经存在于我国部分地区猪群中。长期以来PRRSV-1 和PRRSV-2 被视为同一种病原,无法了解两种病原在我国具体流行状况,导致我国对PRRSV-1的检测手段十分匮乏,也不利于针对性防控,面对PRRSV-1 与PRRSV-2 分为不同亚属的新局势,加大对我国猪场PRRSV-1 抗体的监测已十分必要。
