醋酸奥曲肽微球联合吉西他滨对胃肠胰神经内分泌肿瘤患者血清激素、肿瘤标志物水平及预后的影响
2022-08-24李明明
李明明,白 岩
榆林市星元医院:1.肾病内分泌科;2.药剂科,陕西榆林 719000
神经内分泌肿瘤是起源于干细胞的肿瘤,有神经内分泌标记物,可产生多肽激素和(或)生物活性胺[1-2]。神经内分泌肿瘤根据发病部位不同可分为后肠神经内分泌肿瘤、中肠神经内分泌肿瘤及前肠神经内分泌肿瘤,以前肠神经内分泌肿瘤中的胃肠胰神经内分泌肿瘤最为多见,在神经内分泌肿瘤中占比高达70%[3-4]。胃肠胰神经内分泌肿瘤临床表现多种多样,症状并不典型,且临床重视度低,患者诊断时多已为晚期。晚期患者治疗困难,预后较差,生活质量会受到严重影响。吉西他滨常用于治疗胃肠及胰的肿瘤,可杀死胃肠胰神经内分泌肿瘤细胞。醋酸奥曲肽微球为生长抑素类似物,可抑制肿瘤细胞分裂周期,延缓其生长,缓解患者临床症状。故本研究旨在观察醋酸奥曲肽微球联合吉西他滨对胃肠胰神经内分泌肿瘤患者血清激素、肿瘤标志物水平及预后的影响,现报道如下。
1 资料与方法
1.1一般资料 选择2017年10月至2020年10月于本院治疗的80例胃肠胰神经内分泌肿瘤患者为研究对象,按照随机数字表法分为联合治疗组及吉西他滨组,每组40例。联合治疗组男25例,女15例;年龄25~70岁,平均(50.12±2.52)岁;肿瘤原发部位:胃1例,小肠9例,直肠9例,胰21例;WHO神经内分泌肿瘤分级:G1级12例,G2级28例;TNM分期:Ⅲ期25例,Ⅳ期15例;有淋巴结转移17例,有肺转移4例,有骨转移5例。吉西他滨组男24例,女16例;年龄25~69岁,平均(50.33±2.65)岁;肿瘤原发部位:胃2例,小肠8例,直肠9例,胰21例;WHO神经内分泌肿瘤分级:G1级13例,G2级27例;TNM分期:Ⅲ期26例,Ⅳ期14例;有淋巴结转移16例,有肺转移3例,有骨转移6例。两组性别、年龄、肿瘤分级、TNM分期、肿瘤转移情况等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院医学伦理委员会批准。患者及家属均知情同意并签署知情同意书。
1.2纳入及排除标准 纳入标准:胃肠胰神经内分泌肿瘤诊断符合《中国胃肠胰神经内分泌肿瘤专家共识(2016年版)》[5]相关标准,经影像学检查证实;存在手术治疗禁忌证,需采用药物治疗者;肠、胃、胰为肿瘤原发部位,TNM分期Ⅲ~Ⅳ期;年龄25~70岁。排除标准:伴有肝、心、肺等重要器官功能障碍;合并其他类型肿瘤者;接受手术治疗者;存在其他部位的神经内分泌肿瘤者;妊娠期或哺乳期女性;对本研究所用药物过敏或存在用药禁忌证者。
1.3治疗方法 吉西他滨组患者给予注射用盐酸吉西他滨(湖北一半天制药有限公司,批准文号H20093568,规格0.2 g)1 000 mg/m2静脉滴注30 min。联合治疗组在吉西他滨组基础上给予患者注射用醋酸奥曲肽微球(瑞士Novartis Pharma Stein AG公司,批准文号H20130367,规格20 mg)臀部肌肉深部注射,每次20 mg。两组均每周治疗1次,每治疗3周停药1周,4周为1个周期,连续治疗4个周期。
1.4观察指标 (1)治疗前后取患者空腹静脉血5 mL,采用酶联免疫吸附试验(试剂盒由睿信生物科技有限公司提供)检测两组患者癌胚抗原(CEA)、嗜铬粒蛋白A(CGA)、神经元特异性烯醇化酶(NSE)、糖类抗原19-9(CA19-9)、胃泌素-17(G-17)、胰高血糖素、血管内皮生长因子(VEGF)水平。采用时间分辨荧光免疫分析法(试剂盒由广州丰华生物工程有限公司提供)检测两组患者中足性梳样蛋白2(SCML2)水平。采用全自动干式生化分析仪(成都斯马特科技有限公司)检测两组患者胰岛素水平。(2)采用胃肠神经内分泌肿瘤患者生活质量量表(QLQ-DI.NET21)[6]及癌症患者生存质量核心量表(QLQ-C30)[7]评价两组患者生活质量。QLQ-DI.NET21包含疾病相关焦虑、社会功能、治疗相关症状、胃肠道症状、内分泌症状5个维度,总分84分,分数越高,患者生活质量越差。QLQ-C30包含社会功能、情绪功能、认知功能、角色功能、躯体功能5个维度,总分100分,分数越高,患者生活质量越好。(3)对两组进行临床疗效评价。明显缓解:病灶完全消失,消失时间持续1个月以上;部分缓解:病灶减小>50%,减小时间持续1个月以上;疾病稳定:病灶减小25%~50%;无效:病灶减小<25%或有新病灶出现。总有效率=(明显缓解例数+部分缓解例数+疾病稳定例数)/总例数×100%。记录两组患者半年内复发情况。(4)记录治疗期间患者恶心呕吐、水肿、味觉减退、骨髓抑制、腹泻、肝肾功能损伤等不良反应发生情况。
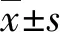
2 结 果
2.1治疗前后两组CEA、CGA、NSE、CA19-9水平比较 治疗前,两组CEA、CGA、NSE、CA19-9水平比较,差异无统计学意义(P>0.05);治疗后,两组CEA、CGA、NSE、CA19-9水平较治疗前降低,且联合治疗组CEA、CGA、NSE、CA19-9水平低于吉西他滨组,差异有统计学意义(P<0.05),见表1。
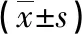
表1 治疗前后两组CEA、CGA、NSE、CA19-9水平比较
2.2治疗前后两组G-17、胰高血糖素、胰岛素水平比较 治疗前,两组G-17、胰高血糖素、胰岛素水平比较,差异无统计学意义(P>0.05);治疗后,两组胰岛素、G-17、胰高血糖素水平较治疗前降低,且联合治疗组胰岛素、G-17、胰高血糖素水平均低于吉西他滨组,差异有统计学意义(P<0.05),见表2。
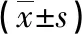
表2 治疗前后两组G-17、胰高血糖素、胰岛素水平比较
2.3治疗前后两组VEGF、SCML2水平比较 治疗前,两组VEGF、SCML2水平比较,差异无统计学意义(P>0.05);治疗后,两组VEGF、SCML2水平较治疗前降低,且联合治疗组VEGF、SCML2水平低于吉西他滨组,差异有统计学意义(P<0.05),见表3。
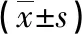
表3 治疗前后两组VEGF、SCML2水平比较
2.4治疗前后两组QLQ-DI.NET21、QLQ-C30评分比较 治疗前,两组QLQ-DI.NET21、QLQ-C30评分比较,差异无统计学意义(P>0.05);治疗后,两组QLQ-DI.NET21评分较治疗前降低,QLQ-C30评分较治疗前升高,且联合治疗组QLQ-DI.NET21评分低于吉西他滨组,QLQ-C30评分高于吉西他滨组,差异有统计学意义(P<0.05),见表4。

表4 治疗前后两组QLQ-DI.NET21、QLQ-C30评分比较分)
2.5两组临床疗效及复发率比较 联合治疗组总有效率为87.50%,高于吉西他滨组的70.00%,差异有统计学意义(χ2=2.515,P<0.05);联合治疗组复发率为7.50%,低于吉西他滨组的32.50%,差异有统计学意义(χ2=4.781,P<0.05),见表5。

表5 两组临床疗效及复发率比较[n(%)]
2.6两组不良反应比较 联合治疗组不良反应发生率为22.50%,吉西他滨组不良反应发生率为30.00%,两组不良反应发生率比较,差异无统计学意义(χ2=0.581,P>0.05),见表6。
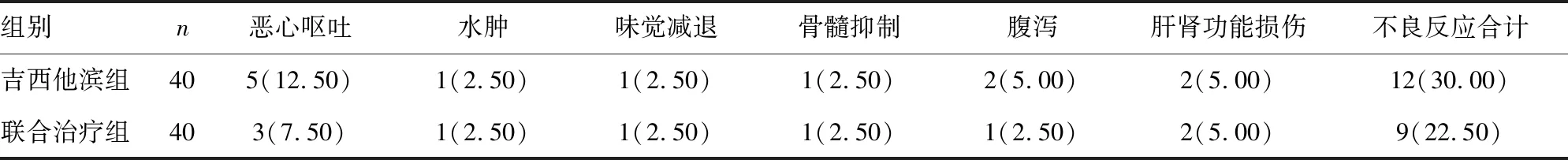
表6 两组不良反应比较[n(%)]
3 讨 论
神经内分泌肿瘤是起源于神经内分泌细胞及肽能神经元的高度异质性肿瘤,全身各部位均可发病,其中以胃、肠、胰多见,不同部位神经内分泌肿瘤临床病理学特征存在一定差异[8-9]。胃肠胰神经内分泌肿瘤临床少见,但近年来发病率呈升高趋势,其发病多与激素水平升高及肽类异常表达有关[10]。胃神经内分泌肿瘤起源于肠嗜铬细胞,分布于胃体及胃底,由萎缩性胃炎破坏壁细胞,致使胃酸缺乏,胃窦部G细胞大量增生,并分泌胃泌素,刺激胃体及胃底部肠嗜铬细胞增生,最终诱发神经内分泌肿瘤[11]。胰神经内分泌肿瘤有独特的生物学特性,生长抑素瘤、胰高血糖素瘤、血管活性肠肽瘤、胰岛素瘤等可分泌特定的激素,产生不同的临床表现,或仅分泌神经降压素、胰多肽等低生物活性肽类激素[12]。十二指肠神经内分泌肿瘤可表达胰多肽、五羟色胺、降钙素、生长抑素、胃泌素等[13]。早、中期胃肠胰神经内分泌肿瘤的治疗以手术切除为主,但治疗后会伴随胃、肠、胰组织损伤,可影响患者消化功能及内分泌功能,增加不良反应,而晚期胃肠胰神经内分泌肿瘤不宜行手术治疗,以靶向治疗、化疗、生物治疗等为主[14]。
吉西他滨是嘧啶核苷类似物,为一线抗肿瘤药物,常用于消化系统肿瘤的治疗,是治疗胰腺癌的基础药物。吉西他滨可磷酸化脱氧胞苷激酶,产生活性三磷酸吉西他滨及活性二磷酸吉西他滨,抑制机体合成脱氧核糖核酸及核糖核苷酸还原酶,从而杀死肿瘤细胞或抑制肿瘤细胞生长,达到抑制肿瘤细胞增殖、浸润及转移的目的[15-16]。醋酸奥曲肽微球是胃肠胰神经内分泌肿瘤的一线治疗药物,具有抑制肿瘤生长及抗胃肠激素分泌的作用,醋酸奥曲肽微球可特异性结合生长抑素受体,启动信号传导;醋酸奥曲肽微球也可抑制生长因子的产生,对细胞分裂产生阻滞作用,从而导致肿瘤细胞凋亡;醋酸奥曲肽微球还可间接调节免疫系统、抗血管生成、抑制生长因子的合成及分泌,产生抗肿瘤作用;同时醋酸奥曲肽微球还可通过调节钙离子通路及抑制腺苷酸环化酶活性的途径来抑制胃肠激素分泌[17-18]。
CEA为结构复杂的糖蛋白,由胚胎的内胚层分化产生,是一种肿瘤相关抗原,具有可溶性,在多数上皮肿瘤中广泛表达,可引起机体免疫反应,对肿瘤细胞的生长及转移具有直接影响[19-20]。CGA为神经内分泌肿瘤通用标志物,是一种酸性可溶性蛋白,多存在于神经内分泌细胞,常用于胃肠胰神经内分泌肿瘤的诊断及预后评估[21]。NSE是一种蛋白酶,为神经内分泌细胞、神经元所特有,是神经内分泌肿瘤特异性的标志物,在分化差的神经内分泌肿瘤中呈高表达,常用于神经内分泌肿瘤的诊断、疗效、预后、复发转移评估,其诊断价值较CGA高[22-23]。CA19-9为唾液酸酸化鞘糖脂抗原,在胰腺肿瘤诊断中价值最高[24]。本研究结果表明,治疗后联合治疗组CEA、CGA、NSE、CA19-9水平低于吉西他滨组(P<0.05),说明将醋酸奥曲肽微球联合吉西他滨用于治疗胃肠胰神经内分泌肿瘤,可降低患者肿瘤标志物水平。
在胃肠胰神经内分泌肿瘤患者中,胰岛素、G-17、胰高血糖素等激素水平呈异常表达,醋酸奥曲肽微球可抑制胰及胃肠组织分泌各种激素,调节机体激素水平,改善患者临床症状[25-26]。治疗后,联合治疗组胰岛素、G-17、胰高血糖素水平较吉西他滨组低(P<0.05),说明将醋酸奥曲肽微球联合吉西他滨治疗胃肠胰神经内分泌肿瘤可有效调节患者血清内分泌激素水平。VEGF在病理状态下可调节淋巴管生成,参与胚胎时期淋巴管的发育,还可使淋巴管壁的通透性增加,促进大分子物质外渗,为毛细血管网及肿瘤细胞提供营养,促进血管生成及肿瘤细胞向淋巴组织转移[27]。SCML2在胰岛细胞癌组织、正常胰岛细胞组织等可产生多肽激素的组织中水平较高,在胰腺腺癌组织及正常胰腺上皮细胞组织中水平较低,是胰神经内分泌肿瘤诊断的潜在指标[28]。治疗后,联合治疗组VEGF、SCML2水平低于吉西他滨组(P<0.05),说明醋酸奥曲肽微球联合吉西他滨治疗胃肠胰神经内分泌肿瘤可降低患者VEGF、SCML2水平。治疗后联合治疗组QLQ-DI.NET21评分低于吉西他滨组,QLQ-C30评分高于吉西他滨组(P<0.05),联合治疗组总有效率较吉西他滨组高(P<0.05),复发率较吉西他滨组低(P<0.05),且两组不良反应发生率比较,差异无统计学意义(P>0.05),说明与单用吉西他滨治疗的患者相比,醋酸奥曲肽微球联合吉西他滨治疗胃肠胰神经内分泌肿瘤的效果较好,可提升患者临床疗效,改善生活质量,降低复发率,安全性高,对改善预后有重要作用。
综上所述,醋酸奥曲肽微球联合吉西他滨治疗胃肠胰神经内分泌肿瘤可降低患者肿瘤标志物水平,调节患者血清激素水平,降低VEGF、SCML2水平,提升患者临床疗效,改善生活质量,值得临床推广使用。
