自然青贮饲草和发酵蔬菜中产乳酸菌的分离鉴定及其特性研究
2022-08-23魏臻武朱道辰蒋建雄
董 柯,李 霞,魏臻武,朱道辰,蒋建雄
(1.江苏大学生物质能源研究院/环境与安全工程学院,江苏 镇江 212013;2.扬州大学动物科学与技术学院,江苏 扬州 225009)
中国主要农作物秸秆可收集资源量每年可达到约7 亿t,但农作物秸秆的资源化利用效率极低,大部分秸秆在田间被直接焚烧或者废弃,不仅造成了巨大的资源浪费,而且也引起了严重的环境污染[1,2]。随着中国养殖业的快速发展,家畜粗饲料短缺的问题越来越突出,因此,将农作物秸秆用作牛羊粗饲草有利于缓解畜牧养殖业面临的饲草不足等问题,同时也为秸秆的资源化合理利用提供了有效途径[3]。但农作物秸秆由于木质纤维素含量偏高、粗蛋白质等营养成分含量偏少等原因,难以被家畜直接消化利用。青贮是一种简单、实用的秸秆饲料化利用方式,一方面可以改善饲草的营养和风味,提高动物的采食量,另一方面可以延长饲草的保存期。青贮是通过乳杆菌等产酸菌厌氧发酵产生乳酸、乙酸以及其他挥发性有机酸,使饲草生物质pH 降低,从而抑制了酵母菌、霉菌等有害微生物滋生,经发酵制成营养价值和适口性均较好的优质饲料。植物表面附着的乳酸菌数量较少,且生存能力不强,仅依靠植物表面的乳酸菌不足以进行青贮发酵,因此青贮的主要方式是加入产乳酸菌剂进行发酵[4-9]。产乳酸菌在饲草青贮发酵中的作用极其重要,发酵质量直接受其影响,常见的产乳酸菌来自乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、乳球菌属(Lactococcus)、明 串 珠 菌 属(Leuconostoc)、片 球 菌 属(Pediococcus)、魏斯氏菌属(Weissella)以及芽孢杆菌属(Bacillus)等[10-18]。
由于不同青贮原料的理化性质千差万别,分离筛选各种产酸能力强、青贮发酵效果好的特异菌种资源对成功调制青贮饲草至关重要。目前,分离鉴定适宜青贮发酵的乳酸菌,以获得发酵品质更高的青贮饲料,成为研究的重点[9,19]。从优质自然发酵青贮或发酵蔬菜中分离筛选产乳酸菌是一条高效、快捷的途径,特别是湖南老坛泡菜和盐菜中含有丰富的耐盐、耐酸胁迫的产乳酸菌,并且这些产乳酸菌的适用性和安全性均较高。本研究从泡菜、盐菜等传统发酵蔬菜以及构树叶和燕麦优质自然发酵青贮中分离鉴定产乳酸菌,并阐明这些产乳酸菌的生长特性与产酸特性,挖掘部分优异的产乳酸菌,研究其对青贮饲草发酵品质的影响,为发展农作物秸秆青贮饲草提供优质的菌种资源及科学依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 泡菜和咸菜是在老坛中腌制的优质湖南传统发酵蔬菜。燕麦(Avena sativaL.)青贮和构树(Broussonetia papyrifera)叶青贮为江苏大学生物质能源研究院调制并保存2 年的优质自然发酵青贮。
1.1.2 细菌培养基 MRS 液体培养基:牛肉膏10 g/L,酵母膏 5 g/L,蛋白胨10 g/L,葡萄糖 20 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,七水硫酸镁0.2 g/L,四水硫酸锰0.05 g/L,吐温-80 1 g/L,柠檬酸三铵2 g/L,pH 6.2。
MRS 固体筛选培养基:MRS 液体培养基种添加琼脂15 g/L 和溴甲酚紫 0.8 g/L,pH 6.2。
碳源基础培养基:牛肉膏10 g/L,酵母膏5g/L,蛋白胨10 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,七水硫酸镁0.2 g/L,四水硫酸锰0.05 g/L,吐温-80 1 g/L,柠檬酸三铵2 g/L,pH 6.2。
氮源基础培养基:麦芽糖20 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,七水硫酸镁0.2 g/L,四水硫酸锰0.05 g/L,吐温-80 1 g/L,柠檬酸三铵2 g/L,pH 6.2。
1.2 产酸菌株的分离与纯化
取5 g 发酵材料研磨粉碎后加入无菌生理盐水室温下浸提30 min,将原液按从10-1至10-8的浓度梯度进行稀释,分别取200 μL 于MRS 固体筛选培养基上涂板,室温下倒置培养24 h[20]。从平板上挑取分散度较好且有黄色透明环的菌落,在新鲜MRS 固体筛选培养基上划线培养,获得纯化的单一菌落。单菌落接种于 MRS 液体培养基中,30 ℃下 200 r/min 振荡培养24 h,菌液加入15%甘油后分装,-80 ℃保存备用。
1.3 产酸菌株16S rDNA 序列分析
产酸菌基因组DNA 采用Ezup 柱式细菌基因组DNA 抽提试剂盒提取。采用扩增16s rDNA 片段的通用引物,27F:5′-AGAGTTTGATCCTGGCTCAG-3′和 1541R:5′-AAGGAGGTGATCCAGCCGCA-3′[21]。PCR 反应体系为 25 μL:1×PremixTaqTM、DNA 模板20~40 ng、正反向引物各0.2 μmol/L。PCR 反应条件为:95 ℃预变性3 min;94 ℃变性 45 s,56 ℃退火 45 s,72 ℃延伸 2 min,35 个循环;72 ℃延伸 7 min。PCR产物经1%琼脂糖凝胶电泳分离后采用SanPrep 柱式DNA 胶回收试剂盒回收目标条带,送至生工生物工程(上海)股份有限公司测序,测序引物仍为27F和1 541R。以拼接好的16S rDNA 序列作为探针在NCBI 数据库中做BLASTn 比对,采用生物信息学软件ClustalX1.83 进行多序列比对分析,采用软件MEGA7 根据Kimura 2-parameter 模型计算序列间进化距离,利用邻接法(Neighbor-Joining)构建系统发育树,系统发育树可靠性采用1 000 次重复的自展值(Bootstrap)评价,系统发育树用软件TreeView展示。
1.4 菌液pH 和产酸圈大小的测定
将活化后的菌液(OD600nm=1.0)按6%接种量加入到新鲜MRS 液体培养基中,25 ℃厌氧条件下静置培养48 h。将菌液于10 000 r/min 离心5 min,取上清液分别用于测定有机酸种类和含量、产酸圈大小以及pH。产酸圈大小的测定采用牛津杯法,菌液pH 的测定采用便携式微量pH 计。
1.5 菌株产酸曲线和生长曲线的测定
将活化后的菌液(OD600nm=1.0)按6%接种量加入到新鲜MRS 液体培养基中,混合均匀后再分装至2 mL 离心管中,25 ℃厌氧条件下静置培养,每隔4 h分别测定菌液OD600nm和pH。
1.6 菌株pH 耐受性的测定
将活化后的菌液(OD600nm=1.0)以6%接种量分别加入到 pH 3、4、5 的 MRS 液体培养基中,混合均匀后再分装到2 mL 离心管中,25 ℃厌氧条件下静置培养 72 h,每隔 12 h 测定菌液OD600nm。
1.7 菌株产酸种类及含量的测定
将产酸菌发酵产物的上清液经0.22 μm 滤膜过滤后,用Prominence LC 高效液相色谱仪测定有机酸的种类及含量。液相色谱条件[22]:色谱柱为C18柱,流动相为甲醇和0.02 mol/L NaH2PO4(pH 2.7),梯度洗脱,洗脱液为甲醇+NaH2PO4(14∶86),流速1 mL/min,柱温30 ℃,检测波长210 nm,进样体积20 μL。
1.8 最佳碳源和氮源及碳氮比的确定
在碳源基础培养基中分别加入20g/L 葡萄糖、蔗糖、麦芽糖或可溶性淀粉制备成不同的碳源培养基。将产酸菌菌液(OD600nm=1.0)以2%接种量接入4种碳源培养基中,37 ℃下180 r/min 培养24 h,测定OD600nm确定最佳碳源。
在氮源基础培养基中分别加入20 g/L 蛋白胨、大豆蛋白胨、酪蛋白胨、酵母粉、牛肉膏、硫酸铵制备成不同的氮源培养基。将产酸菌菌液(OD600nm=1.0)以2%接种量接入6种氮源培养基中,37 ℃下180 r/min培养24 h,测定OD600nm确定最佳氮源。
选择最佳的碳源和氮源分别以1∶1、1∶2、1∶3、1∶1.5、1.5∶1、2∶1、3∶1 的配比制备细菌培养基。将产酸菌菌液(OD600nm=1.0)以2%接种量接入上述培养基中,37 ℃下 180 r/min 培养 24 h,测定OD600nm确定最佳碳氮比。
1.9 玉米秸秆青贮饲草的制备
果穗采收后,将玉米秸秆用粉碎机切成约3 cm的小段,采用真空袋法调制青贮,共设12 组产酸菌处理组和1 组不加菌的对照组(CK),其中单一菌种和混合菌种各6 组,菌种的添加量为1×109CFU/kg秸秆,室温下青贮60 d。
1.10 青贮发酵品质的测定
青贮饲草的pH 测定采用微量pH 计,有机酸含量测定采用高效液相色谱仪。采用烘干法测定青贮饲草中的干物质(DM),采用范式法测定粗纤维(CF)、酸性洗涤纤维(ADF)和酸性洗涤木质素(ADL),采用凯氏定氮法测定粗蛋白质(CP),采用蒽酮-硫酸比色法测定可溶性碳水化合物(WSC),采用灰化法测定灰分(Ash)。饲料有氧稳定性测定:青贮开封后,取出100 g 样品放入250 mL 烧杯中,敞口放置,环境温度为25 ℃,每日定时记录青贮温度,当青贮温度超过室温2 ℃时被认为呈现不稳定状态。
2 结果与分析
2.1 产酸菌的分离及其分子鉴定
经过多轮划板培养,获得96 个产酸的单菌落,其中20 个来源于构树叶青贮、20 个来源于燕麦青贮、17 个来源于盐菜、39 个来源于泡菜。对96 个单菌落进行分子生物学分类鉴定,扩增的16s rDNA 片段长度约为1 500 bp,并将序列在NCBI 数据库中做BLASTn 比对分析。结果表明,有27 株弯曲乳杆菌(Lactobacillus curvatus)、6 株植物乳杆菌(Lactobacillus plantarum)、6 株短乳杆菌(Lactobacillus brevis)、35 株布氏乳杆菌(Lactobacillus buchneri)、1 株戊糖片球菌(Pediococcus pentosaceus)、19 株芽孢杆菌属(Bacillussp.)、1 株科氏葡萄球菌(Staphylococcus cohnii)和1 株肠球菌属(Enterococcussp.)。其中,弯曲乳杆菌、植物乳杆菌和短乳杆菌均来源于构树叶及燕麦青贮;戊糖片球菌仅来源于构树叶青贮;布氏乳杆菌和芽孢杆菌属来源于泡菜与盐菜;而肠球菌属和科氏葡萄球菌仅从咸菜中分离到。利用16S rDNA 片段测序尚无法确定19 株芽孢杆菌属和1 株肠球菌属的具体分类名。
通过对发酵液pH 和产酸圈直径的测定与比较,从中初步筛选出16 个具有较强产酸能力的菌株,48 h 发酵液pH 大多低于4.0,而且菌液pH 越低的菌株,其产酸圈直径也越大(表1)。16 株产酸菌分别为2 株弯曲乳杆菌(G3 和Y5)、2 株植物乳杆菌(G17和Y17)、2 株短乳杆菌(G14 和Y4)、2 株布氏乳杆菌(PC-C1 和 PC2-1-1)、5 株芽孢杆菌属(YC1-1-4、PC1-1、YC1-4-5、PC2-1-21、YC2-1),戊糖片球菌(G18)、科氏葡萄球菌(YC1-2-8)以及肠球菌属各1株(YC2-6)。NJ系统发育树如图1 所示。

图1 16 株产酸菌基于16S rDNA 序列的NJ 系统发育树
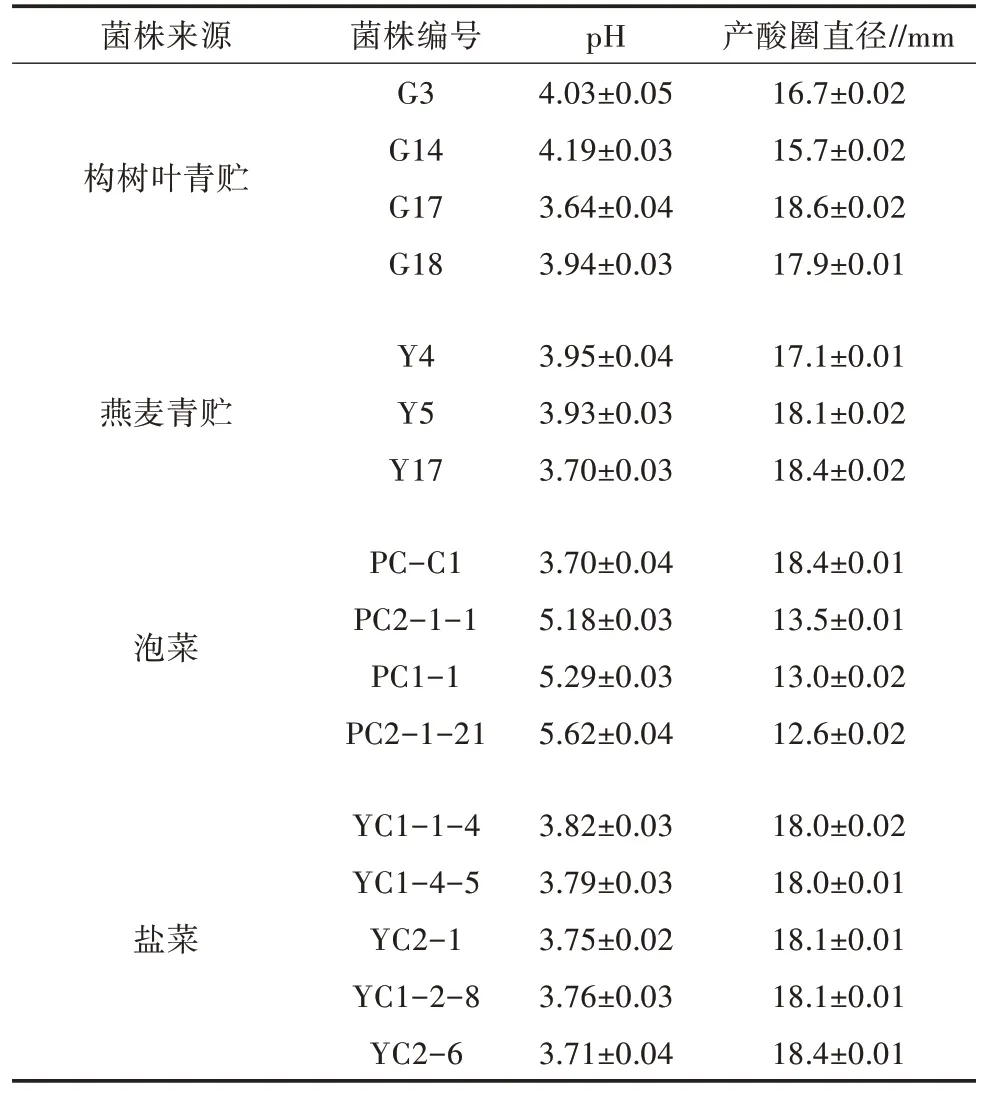
表1 16 株产酸菌培养48 h 后发酵产物的pH 及产酸圈直径
2.2 产酸菌的生长特性及产酸特性
初步筛选出的16 株产酸菌在静置培养24 h 后菌液pH 均降至4.2 以下。其中,植物乳杆菌的pH 最低,达3.72,短乳杆菌的pH 最高,达4.02。进一步对同一菌种不同菌株之间的生长速率及产酸速率进行比较。结果表明,短乳杆菌Y4 和G14 在培养的前16 h 内生长迅速,pH 快速下降,16 h 后变化趋缓,在整个培养过程中Y4 的OD600nm均明显高于G14,其pH 则明显低于 G14,Y4 的 pH 在培养 24 h 后即可达到4.0 左右(图2a)。对于弯曲乳杆菌G3 和Y5,在培养后的12 h 内,G3 的生长速率明显高于Y5,之后G3的生长开始下降,而Y5 的生长则持续缓慢上升,到24 h 时两者OD600nm基本接近,但两者的产酸曲线基本一致,pH 在 24 h 后均接近 4.0(图 2b)。植物乳杆菌G17 和Y17 的生长曲线基本保持一致,均能持续快速生长,且具有很强的产酸能力,培养12 h 后pH达到 4.0 左右,24 h 后降至约 3.7(图 2c)。2 株布氏乳杆菌之间的生长曲线及产酸曲线表现出较大差异,其中,PC2-1-1 生长极其缓慢,培养24 h 后其OD600nm仅达到2.5,pH仍有5.1,而PC-C1持续快速生长,24 h后其OD600nm约13.0,pH 降至3.7(图2d)。2 株芽孢杆菌之间的生长速率和产酸能力同样也有较大差异,其中YC1-1-4 持续缓慢生长,培养24 h 后其OD600nm达到 9.0 左右,pH 降至 3.9 左右,而 PC1-1 则在前期生长缓慢,16 h 后才开始进入快速生长期,24 h 后其OD600nm接近8.0,pH 达到4.3 左右(图2e)。
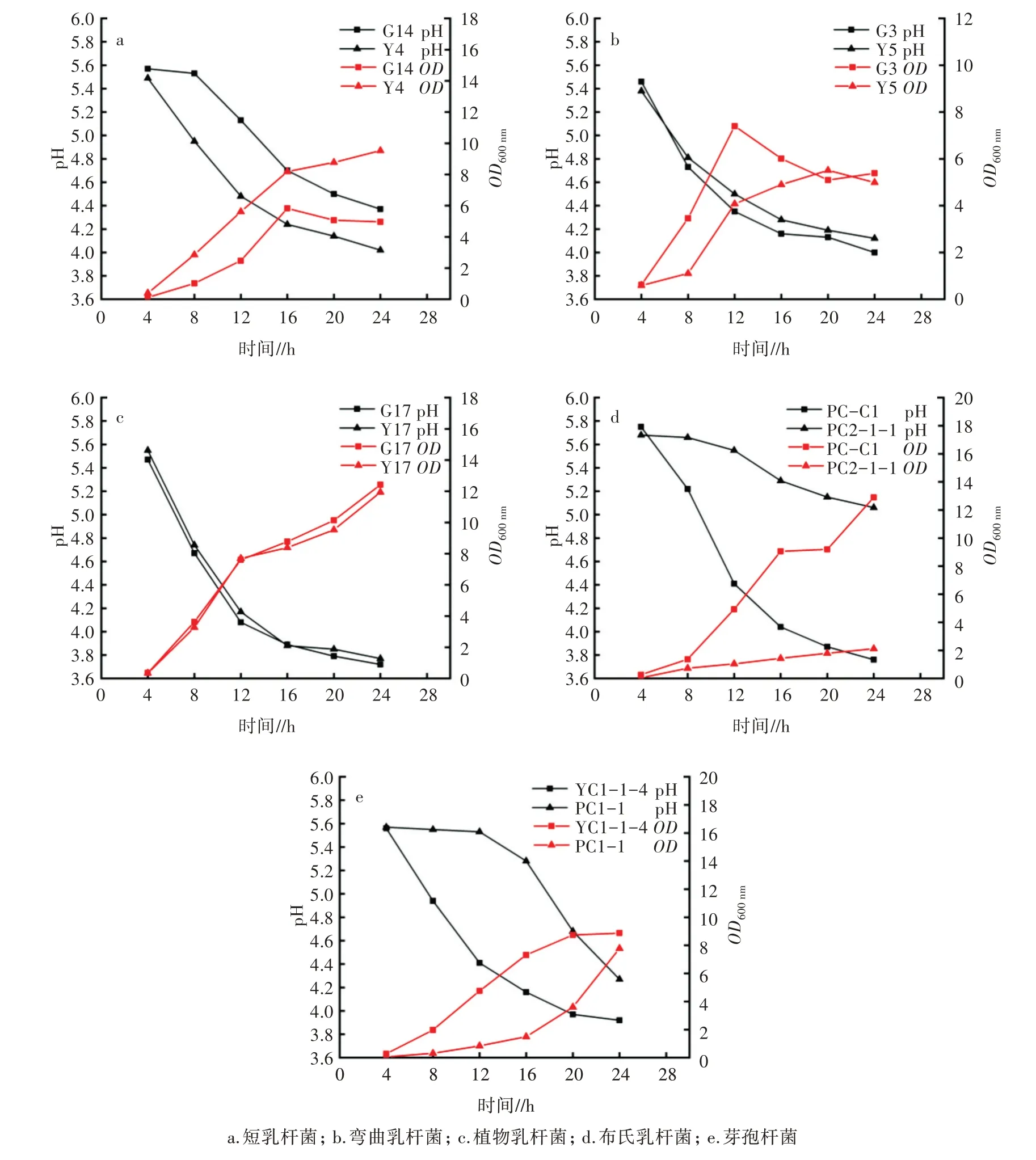
图2 不同产酸菌产酸曲线和生长曲线
2.3 产酸菌的pH 耐受性
MRS 液体培养基的初始pH 为3 时,所有产酸菌株的繁殖速度极为缓慢,在培养72 h 后OD600nm均低于2.0。培养基pH 提高至4 或5 时,产酸菌株的繁殖速度与pH 为3 时的相比均有明显增加,但也仅有植物乳杆菌(G17 和 Y17)在 pH 4 与 pH 5 的 MRS 液体培养基中培养72 h 后其OD600nm分别超过了5.0 和6.0。植物乳杆菌对低pH 的耐受性最强,其次是布氏乳杆菌、短乳杆菌和戊糖片球菌,弯曲乳杆菌对低pH 的耐受性最差(图3)。

图3 产酸菌的pH 耐受性
2.4 菌株产有机酸的种类及含量
采用HPLC 测定了16 株产酸菌48 h 发酵液中乳酸和其他挥发性有机酸的种类及含量。结果(表2)表明,产酸菌主要产生乳酸、乙酸和丙酸以及少量的异丁酸、丁酸和戊酸,均未检测到异戊酸。同一种菌不同来源菌株的产酸含量具有差异性,产有益酸(乳酸、乙酸和丙酸)的总含量占优势的菌种有弯曲乳杆菌G3、植物乳杆菌G17、短乳杆菌Y4、芽孢杆菌YC1-1-4、布氏乳杆菌 PC-C1、肠球菌 YC2-6 和戊糖片球菌G18。
2.5 最佳碳源、氮源及碳氮比
产酸菌在不同碳源培养基中生长状况有显著性差异,其中在可溶性淀粉培养基中细菌几乎无生长,G17 在蔗糖培养基中生长量最高,而其他产酸菌则在麦芽糖培养基中生长最好,培养24 h 后OD600nm均达到7.0 以上(表3)。综合比较,麦芽糖为产酸菌的最佳碳源。另一方面,产酸菌在硫酸铵为氮源的培养基中生长量极低,而在其他5 种氮源培养基中的生长量也存在显著性差异,在培养24 h 后,OD600nm大小依次为酪蛋白胨>酵母粉>大豆蛋白胨>胰蛋白胨(表4),因此酪蛋白胨为最佳氮源。但从性价比考虑,选用酵母粉为佳。7 种产酸菌均在C/N 为1∶3 的培养基中生长最好,显著高于在其他C/N 比中的生长状况(表5)。

表3 产酸菌在不同碳源培养基下培养24 h 的OD600 nm
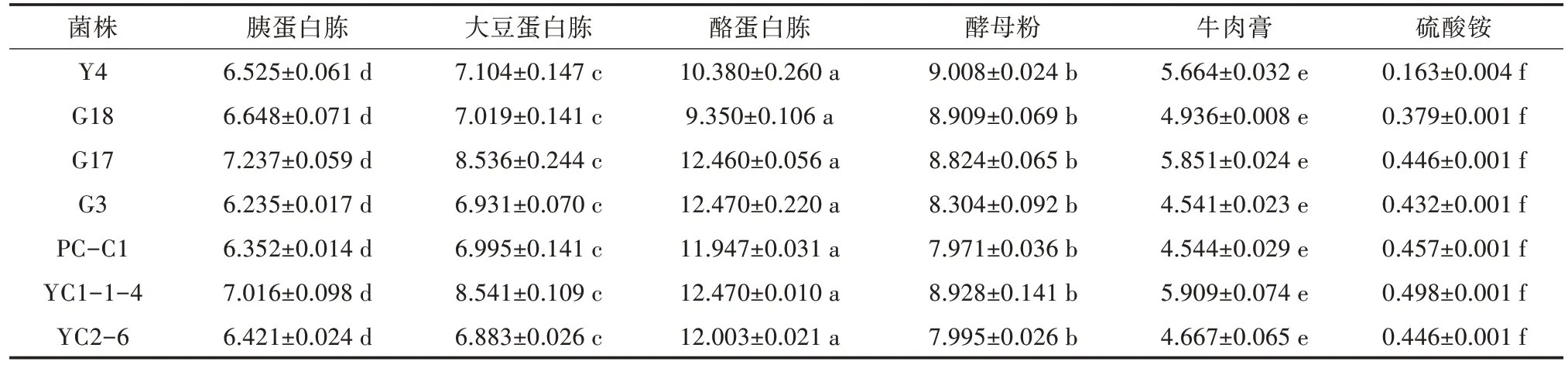
表4 产酸菌在不同氮源培养基下培养24 h 的OD600 nm
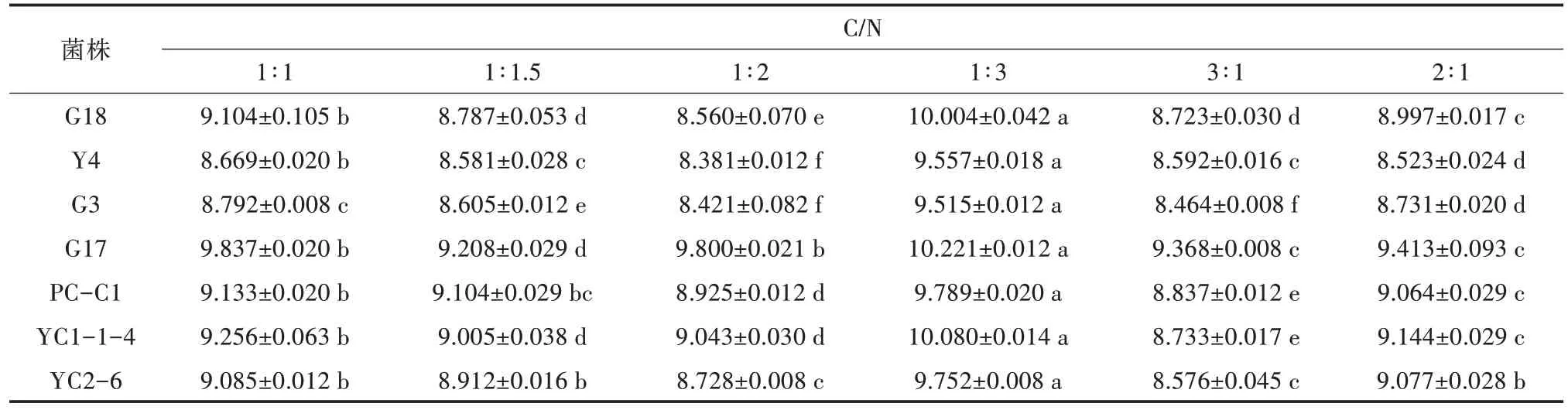
表5 产酸菌在不同C/N 培养基下培养24 h 的OD600 nm
2.6 玉米秸秆青贮的pH 和有机酸含量
添加产酸菌的青贮和对照组相比饲料的pH 无显著性差异,但添加产酸菌显著提高了青贮中有机酸含量,并且混合菌的效果要好于单菌(表6)。其中,乳酸含量以添加植物乳杆菌+短乳杆菌的处理最高,乙酸含量以添加戊糖片球菌+短乳杆菌的处理最高,各处理中丙酸含量较少。除对照组之外,所有添加产酸菌的处理组均未检测出异丁酸。

表6 玉米秸秆青贮饲草的pH 及有机酸含量
2.7 玉米秸秆青贮的营养成分
青贮发酵后各处理组干物质含量均低于原料的干物质含量(表7),添加植物乳杆菌+布氏乳杆菌的处理组干物质含量显著高于对照组(P<0.05)。青贮后可溶性糖含量降低,添加短乳杆菌、植物乳杆菌、肠球菌、植物乳杆菌+短乳杆菌的可溶性糖含量显著高于对照组(P<0.05)。青贮后添加短乳杆菌的处理组酸性洗涤纤维含量与对照组差异不大,而其他各组酸性洗涤纤维含量均显著低于对照组(P<0.05)。添加布氏乳杆菌、短乳杆菌、植物乳杆菌+布氏乳杆菌的酸性洗涤木质素与对照组无差异,其他各组酸性洗涤木质素含量均显著低于对照组(P<0.05)。除了短乳杆菌处理组的粗纤维含量与对照组差异不显著之外,其他各组粗纤维含量显著低于对照组(P<0.05)。添加菌剂可降低粗灰分的含量,各组与对照组差异显著(P<0.05)。此外,添加戊糖片球菌+植物乳杆菌的粗蛋白质含量显著低于对照组(P<0.05),其余各组粗蛋白质含量均显著高于对照组(P<0.05)。
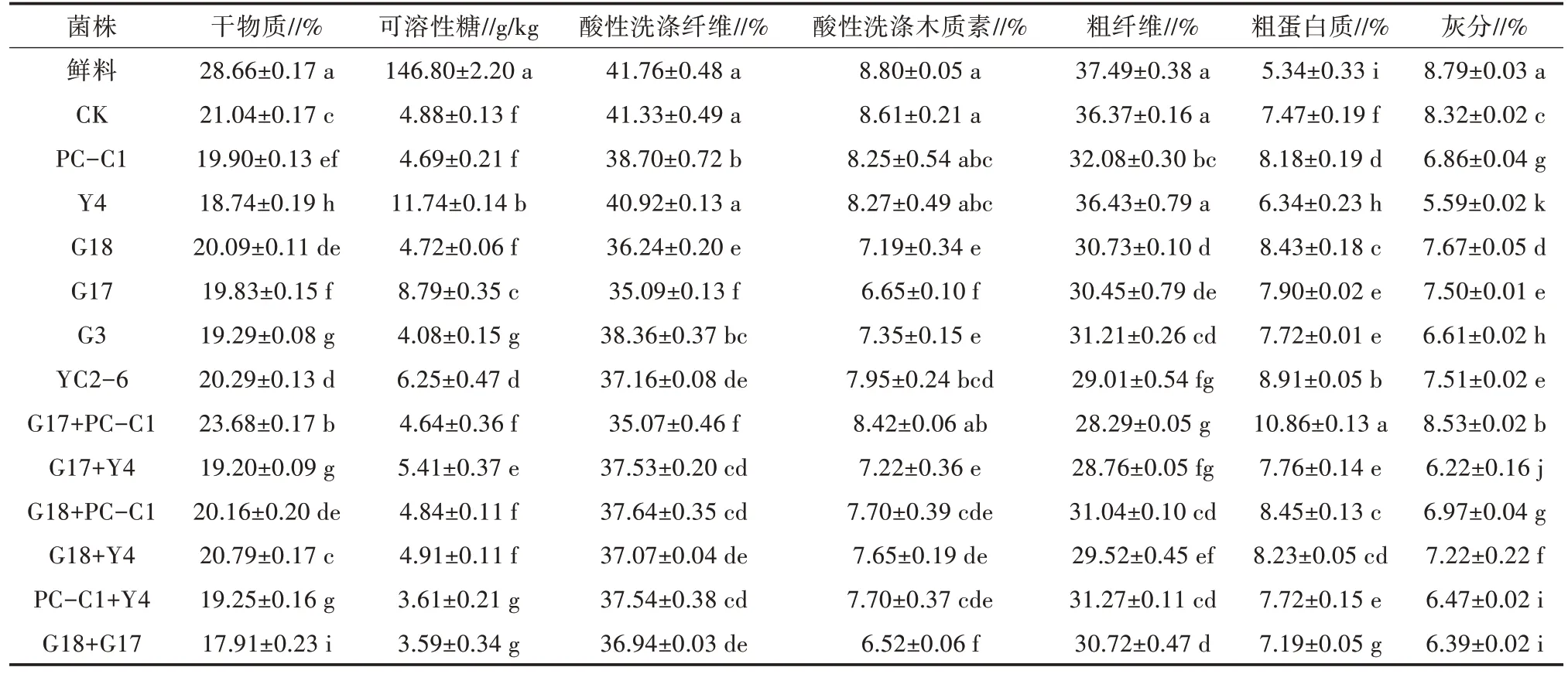
表7 玉米秸秆青贮饲草的营养成分
2.8 玉米秸秆青贮的有氧稳定性
青贮饲料暴露于空气中,温度上升到高于环境温度2 ℃时所需的时间即为有氧稳定性。对照组有氧稳定性低于120 h,添加戊糖片球菌或肠球菌的处理组有氧稳定性低于对照组,分别为93 h 和104 h,其余各组有氧稳定性均高于对照组。添加单菌处理组中以布氏乳杆菌和短乳杆菌的有氧稳定性较高,而添加混合菌处理组中则是植物乳杆菌+布氏乳杆菌、植物乳杆菌+短乳杆菌、布氏乳杆菌+短乳杆菌有氧稳定性较高,其中布氏乳杆菌+短乳杆菌处理组有氧稳定性最高,达192 h(图4)。
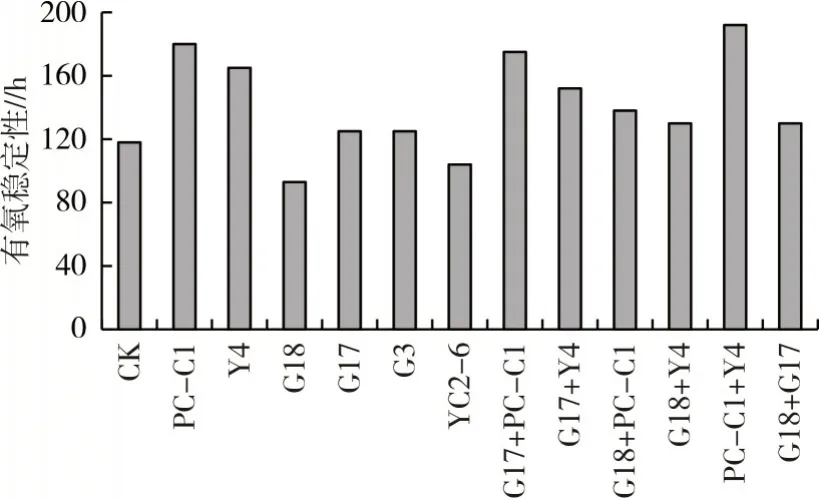
图4 不同处理组玉米秸秆青贮的有氧稳定性
3 讨论
3.1 不同发酵产品中产酸菌的多样性
本研究从4 种自然发酵产品中共分离鉴定出8种不同种类的产酸菌,其中,构树叶青贮中分离出了弯曲乳杆菌、植物乳杆菌、短乳杆菌和戊糖片球菌,在燕麦青贮中主要分离出了弯曲乳杆菌、短乳杆菌和植物乳杆菌,泡菜中分离出了布氏乳杆菌和芽孢杆菌,盐菜中分离出了芽孢杆菌、布氏乳杆菌、肠球菌和科氏葡萄球菌,表明同一自然发酵产品中以及不同自然发酵产品之间的产酸菌具有多样性,各种发酵产品拥有的独特风味则可能是多种产酸菌共同作用的结果。植物乳杆菌、弯曲乳杆菌、肠球菌和戊糖片球菌为同型发酵乳酸菌,该类乳酸菌一般具有较快的发酵特性,可以显著降低青贮的pH,有效抑制腐败菌活性,且调制的青贮饲草中营养物质损失较小;短乳杆菌和布氏乳杆菌为异型发酵乳酸菌,能够有效防止青贮开窖后的二次发酵,从而提高青贮有氧稳定性和保存期[23,24]。本研究中还从泡菜和咸菜中还分离出一些属于芽孢杆菌属的产酸菌。Bacillus subtilis等芽孢杆菌通过分泌细菌素等抗真菌或抗细菌的成分,抑制植物病原菌的滋生,提高青贮产品有氧稳定性,或者分泌纤维素酶等水解酶,提高青贮饲草的消化利用率,因此可以作为青贮添加剂使用[25-27]。本研究中分离到芽孢杆菌,其分泌乳酸以及乙酸、丙酸等挥发性有机酸,也将有助于提高青贮饲草的品质。由于乳酸菌不形成芽孢,因此乳酸菌剂难以长期保存或长途运输,导致其应用于生产中的成本较高,增加了推广的难度[28]。而芽孢杆菌通常具有很强的抗逆性,能耐热、紫外线以及多种溶剂和酸碱等,在保存和运输过程中损失小,有利于保证菌剂的活性和降低其生产成本,提高青贮产品质量[29,30]。
3.2 产酸菌的产酸特性
产酸菌的快速繁殖和青贮过程中pH 的快速降低是保证青贮发酵品质的关键,因此理想的青贮菌剂应具有较高的产酸、耐酸能力且竞争力强,生长旺盛[31]。本研究中初步筛选出16 株产酸能力较强的菌株,其中植物乳杆菌G17 和Y17、弯曲乳杆菌G3、短乳杆菌Y4、布氏乳杆菌PC-C1、芽孢杆菌属YC1-1-4 的生长及产酸速度快,发酵液的pH 在静置培养24 h 后即可降至4.0 左右,有利于在青贮发酵初期就迅速抑制住酵母菌等其他好氧性杂菌的滋生。但是另一方面,较低的培养基起始pH 会严重制约产酸菌的生长,但不同菌种之间耐酸性有差异,例如植物乳杆菌G17 和Y17 对低pH 的耐受性较强,而弯曲乳杆菌耐受性较差,因此,在青贮过程中选择适宜的起始pH 和产酸菌种有助于提高青贮饲草调制的成功率。
本研究中分离的产酸菌株在发酵过程中主要分泌乳酸、乙酸和丙酸等有机酸,而丁酸、异丁酸、戊酸等有机酸的产量很低,但不同菌株在有机酸含量上有所差别。乳酸和乙酸是降低青贮饲草pH 的主要因子[32],属于有益酸,而丁酸的含量则直接反映了青贮饲草的腐败程度。在短链脂肪酸中,丙酸的抗真菌效果最佳,在抑制青贮饲草的好氧性腐败方面具有良好的作用,且不影响青贮产品的发酵品质,因此它可作为好氧微生物抑制剂应用于青贮调制过程中[33,34]。 G17、G3、Y4、PC-C1、YC1-1-4、YC2-6、G18 等菌株在有益有机酸(乳酸、乙酸和丙酸)总产量上占优势,在青贮调制中具有较大的应用潜力。
3.3 产酸菌对玉米秸秆青贮发酵品质的影响
青贮发酵是一个复杂的生物化学过程,主要是附着在植物表面的乳酸菌利用可溶性碳水化合物生长繁殖,其代谢过程产生有机酸,能迅速降低饲料的pH,从而抑制有害微生物的生长,降低营养物质的损耗。当饲料pH 低于临界值4.2 时,发酵效果较好[35]。本研究中各处理组以及对照组青贮的pH 均低于4.2,因此添加菌剂对玉米秸秆青贮的pH 影响不大,但对青贮中有机酸的含量有显著影响,本研究发现添加菌剂处理可以显著提高乳酸的含量,有效改善青贮的发酵品质。DM 含量直接反映了底物营养物质的浓度,研究表明,添加乳酸菌菌剂可显著提高青贮玉米中DM 的含量[36],但本试验中只有添加植物乳杆菌+布氏乳杆菌处理组中青贮的DM 含量高于对照组,添加戊糖片球菌+短乳杆菌的处理中与对照组无显著差异,其余各处理组的DM 含量则显著低于对照组。研究表明,当原料含糖量达到10%时,干物质的损失主要是由于糖的降解。
粗纤维、酸性洗涤纤维和酸性洗涤木质素是衡量饲料营养价值的重要指标,因此测定饲料中纤维含量及木质素的含量尤为重要。CF、ADF 和ADL 与动物消化率呈负相关,青贮饲料中其含量越低,则饲料的消化率越高[37]。本研究中粗纤维、酸性洗涤纤维和酸性洗涤木质素的含量均有不同程度的降低,其原因可能是由于青贮期间存在部分产纤维素酶的微生物,其在消耗饲料营养物质进行代谢活动时产生纤维素酶,导致粗纤维和酸性洗涤纤维含量降低[38]。此外,有氧稳定性也是评价饲料的一个重要指标,提高有氧稳定性,防止进一步的干物质和能量损失[39]。本研究发现所有添加了短乳杆菌或布氏乳杆菌的玉米秸秆青贮的有氧稳定性与对照相比均有明显提高,特别是添加短乳杆菌+布氏乳杆菌混合菌可以达到最佳的保护效果,因此这些产酸菌种在生产上有较高应用价值。
4 小结
本研究中分离筛选的 G3、G17、Y4、YC1-1-4、PC-C1 等菌株生长迅速,产酸快,且分泌的有益有机酸产量高,在玉米秸秆青贮调制过程中可以显著地降低饲草的酸性洗涤纤维、酸性洗涤木质素、粗纤维和粗灰分含量,并提高粗蛋白质含量,特别是短乳杆菌Y4、布氏乳杆菌PC-C1 还可以明显提高青贮饲草的有氧稳定性,在农作物秸秆饲草生产中应用潜力大。
