猪流行性腹泻病毒HB/HEBEU/2020株全基因组遗传变异与重组分析
2022-08-23翟新国郑培培苏金辉李庆阳焦贺静张若冰李朋辉
翟新国,郑培培,苏金辉,李庆阳,焦贺静,张若冰,李朋辉,
(1.河北工程大学生命科学与食品工程学院,邯郸 056038;2.河北大北农农牧食品有限公司,衡水 053900)
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)属于冠状病毒科(Coronaviridae)病毒大家族[1]。PEDV是一种单股正链具有囊膜的RNA病毒,基因组长约28 000 bp[1-2]。PEDV基因组编码3个非结构蛋白(复制酶1a、复制酶1b 以及附属蛋白(ORF3))和4个结构蛋白(刺突糖蛋白(S)、囊膜蛋白(E)、核衣壳蛋白(N)和膜蛋白(M))[3-5]。在所有PEDV蛋白中,S蛋白主要参与病毒吸附和入侵,决定病毒的毒力和细胞嗜性,并诱导宿主产生中和抗体,在分子流行病学上具有重要意义[6-10]。PEDV感染各年龄段猪均可导致猪流行性腹泻(porcine epidemic diarrhea,PED),但仔猪往往更为严重,表现为厌食,呕吐,肠绒毛萎缩,水样腹泻,恶性脱水,体重减轻,病死率极高(最高可达100%)[11-13]。1971年英国报道首例PED疫情,但PEDV却直到1977年才被比利时科学家首次鉴定出来,命名为CV777株[13-15],随后PEDV广泛传播至欧洲和亚洲诸多生猪养殖国家[16]。1984年,中国学者利用免疫荧光试验和血清中和试验首次证实PEDV在中国的存在[17]。由于中国广泛使用传染性胃肠炎(transmissible gastroenteritis,TGE)和PED的腹泻二联疫苗,PED疫情一直维持在较低水平[16,18]。2008—2010年间,韩国和中国暴发了由高毒力变异型PEDV毒株引起的PED,随后疫情迅速席卷亚洲、北美洲和欧洲,对全球养猪业造成巨大的损失[19-20]。为更好防控变异型PEDV毒株,中国基于AJ1102和LW/L毒株研发并上市两款新的变异毒株疫苗。尽管如此,近些年PED仍是中国最常见危害性最大的猪病之一。Tian等[19]报道2014—2018年四川省和贵州省有47.66%的猪场呈PEDV阳性,对52株PEDVS基因进行遗传变异分析,发现变异型PEDV达82.7%。Cui等[16]报道2015—2019年许多河南省和山西省的经典弱毒疫苗免疫的猪场仍会暴发腹泻,PEDV阳性率为63.7%,对32株PEDVS基因进行遗传变异分析,发现其均属于变异型PEDV。因此,变异PEDV毒株已经发展为流行并循环于中国猪场的最主要毒株[15-16,19]。作为一种重要的猪冠状病毒,PEDV仍在不断进化和变异,免疫逃逸能力和传染性在不断加强,中国PEDV已呈现出较强的流行性和基因异质性,亟需加强对PEDV毒株的遗传变异监测并发展更有效的防控方案[19]。
2020年底,河北省某大型猪场暴发PED,大量新生仔猪水样腹泻,迅速死亡,损失惨重。为了了解河北地区遗传变异情况,掌握本地区PEDV的流行情况,本研究对该猪场病仔猪进行检测,成功获得1株PEDV全基因组序列,并进行了遗传变异和重组分析,以期了解该PEDV毒株的遗传进化和重组规律,为PEDV疫苗的研制和该病的合理防控提供新思路和理论依据,也为进一步研究PEDV的致病机制以及病毒与宿主的相互作用奠定基础。
1 材料与方法
1.1 样品采集与处理
急性仔猪腹泻样品于2020年底采集于河北某大型种猪场,产房内出生仔猪水样腹泻,无菌条件下采集3份濒死仔猪新鲜小肠组织,利用无菌生理盐水冲洗,剪取约1 g组织,充分剪碎并放入灭菌2 mL EP管中,加入1 mL无菌PBS,再加入2~4粒灭菌玻璃匀浆珠,提前30 min预冷组织研磨仪的适配器,按照标准研磨程序,将小肠组织研磨成组织悬液,在4 ℃下,10 000×g离心3 min,取上清于-80 ℃保存备用。
1.2 主要试剂
离心柱法DNA/RNA提取试剂盒购自IDEXX公司;琼脂糖购自BIOWEST公司;DL5000 DNA Marker、大肠杆菌DH5α感受态细胞和pMD18-T Vector均购自TaKaRa公司;快速PCR试剂盒(1.1×T3 Super PCR Mix)购自北京擎科生物技术有限公司;TIANprep Mini Plasmid Kit和TIANgel Midi Purification Kit均购自天根生化科技(北京)有限公司;TransScript First-Strand cDNA Synthesis SuperMix购自北京全式金生物技术有限公司。
1.3 引物与探针
基于LW/L(MK392335.1)、USA/Colorado/2013(KF272920.1)、S14(MH891585.1)、PEDV-WS(KM609213.1)、PEDV 1842/2016 ITA(KY111278.1)、SD2014(KX064280.1)、JSX2014(MH056658.1)、GD-A(JX112709.1)、CH/S(JN547228.1)、CH/HNYF/14(KP890336.1)、BJ-2011-1株(JN825712.1)和AJ1102(JX188454.1)等设计PEDV引物,分别为:PEDV-5′-F:ACTTAAA-AAGATTTTCTATCTACGGATAGTTAGCTC;PEDV-3′-R:GTGTATCCATATCAACACC;用于扩增PEDV基因组内部序列的引物参考文献[21],引物由北京擎科生物技术有限公司合成。
1.4 总RNA提取与RT-PCR扩增
参考翟新国等[22]方法进行总RNA提取和RT-PCR。取适量肠组织研磨液上清按照核酸提取试剂盒说明书提取总RNA;取950 ng总RNA按照TransScript First-Strand cDNA Synthesis SuperMix说明书(AT301)合成cDNA;以cDNA为模板参照1.1×T3 Super PCR Mix说明书进行PCR扩增,PCR反应体系25 μL:1.1×T3 Super PCR Mix 20 μL,上、下游引物(10 μmol/L)各1 μL,cDNA模板1 μL,补ddH2O至25 μL。PCR反应条件:98 ℃预变性3 min;98 ℃变性10 s,56 ℃退火10 s,72 ℃延伸10 s,共31个循环;72 ℃延伸2.5 min。
1.5 序列测定与基因组拼接
将获得的各PEDV基因片段的RT-PCR产物进行1.0%琼脂糖凝胶电泳,按照TIANgel Midi Purification Kit说明书对各PEDV片段进行切胶纯化,送北京擎科生物技术有限公司测序;利用DNAStar软件对测序结果进行拼接和整理,组装成完整的PEDV基因组。
1.6 遗传变异和重组分析
从GenBank中选取20条PEDV基因组序列作为参考序列(表1),利用DNAStar软件对所获的PEDV毒株基因组和S基因序列与参考毒株相应序列进行相似性分析;利用NCBI在线BLAST程序对所获得的PEDV毒株基因组与参考毒株SNJ-P株进行核苷酸变异性比对;利用Mega X 10.0.5软件对所获的PEDV毒株基因组和S基因序列与参考毒株相应序列进行拟合对比和最大似然法(ML)遗传进化分析[23];利用RDP4软件对所获的PEDV毒株基因组序列与参考毒株基因组序列进行重组分析[24-25]。
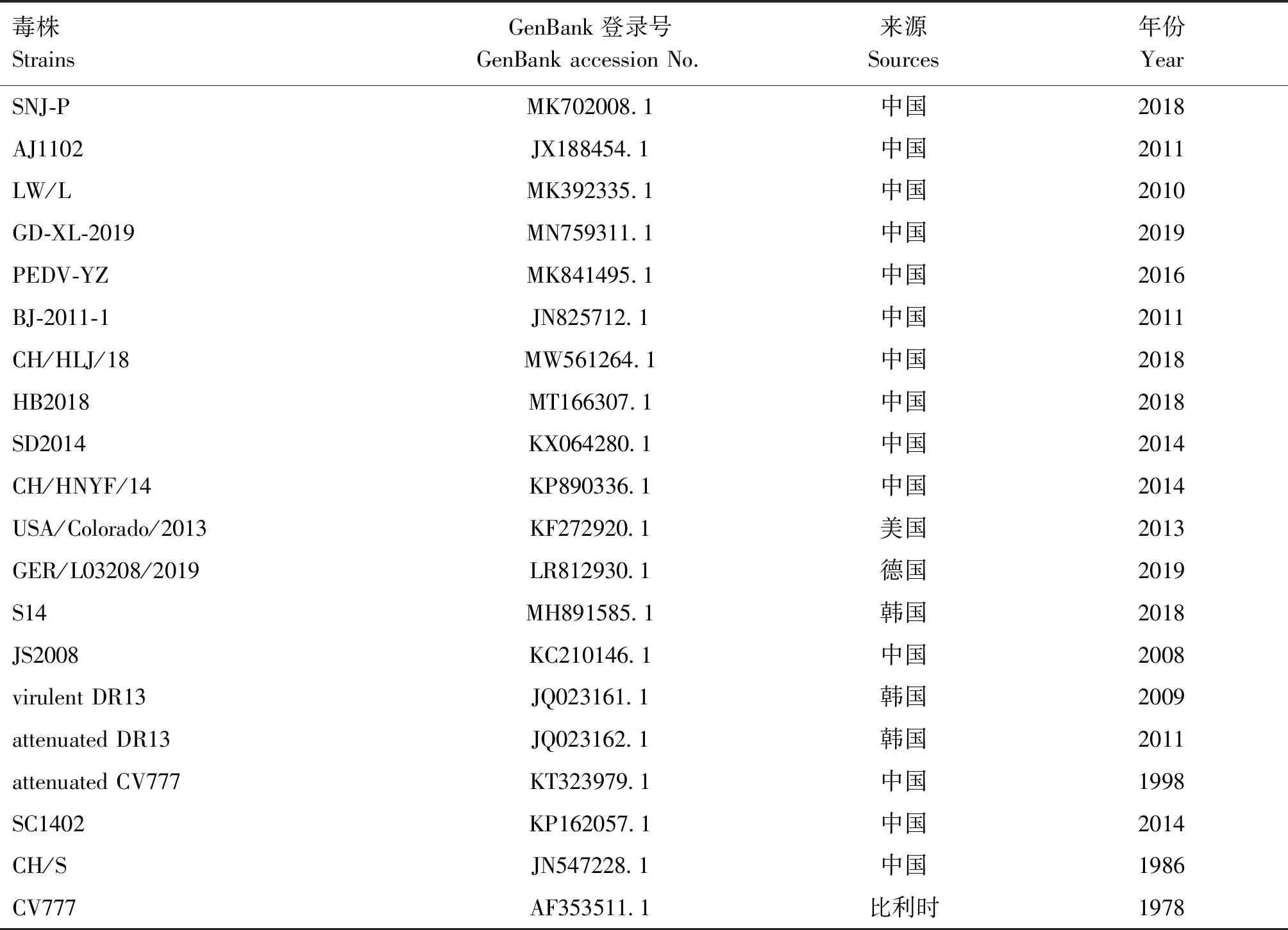
表1 参考毒株信息
2 结 果
2.1 PEDV基因组扩增与测序
RT-PCR扩增产物经1.0%琼脂糖凝胶电泳分析,产生1条清晰条带,大小约1 816 bp(图1),说明小肠病料为PEDV阳性,将该毒株命名为HB/HEBEU/2020。成功克隆了覆盖PEDV全基因组的目的片段,经测序和拼接,获得HB/HEBEU/2020全基因组序列,并提交GenBank,获得的登录号为:MW413556。
M,DL5000 DNA Marker;1~3,样本M,DL5000 DNA Marker;1-3,Samples图1 PEDV基因组RT-PCR扩增结果Fig.1 RT-PCR amplification results of PEDV genome
2.2 HB/HEBEU/2020基因组相似性分析
由表2可知,HB/HEBEU/2020基因组全长28 038 bp,其中5′-非编码区(UTR)的1—36 bp和3′-UTR的28 020—28 038 bp为引物序列,其余27 983 bp均为本研究测序所得。HB/HEBEU/2020基因组编码区全长27 412 bp,含有7个开放阅读框,从5′到3′依次为复制酶1a基因(12 309 bp)、复制酶1b基因(8 037 bp)、S基因(4 161 bp)、ORF3基因(675 bp)、E基因(231 bp)、M基因(681 bp)和N基因(1 326 bp)。与SNJ-P株(MK702008.1)相比,HB/HEBEU/2020基因组包含207个核苷酸点突变,但不存在插入或者缺失。由图2可知,HB/HEBEU/2020与PEDV流行株株的相似性在96.5%~99.3%之间,HB/HEBEU/2020株与分离自中国的SNJ-P株相似性最高,为99.3%,SD2014、USA/Colorado/2013、BJ-2011-1、S14、HB2018、CH/HLJ/18、PEDV-YZ、GER/L03208/2019、AJ1102、CH/HNYF/14、GD-XL-2019和LW/L与HB/HEBEU/2020相似性均>97.5%,SC1402与HB/HEBEU/2020相似性为96.6%;virulent DR13、CH/S和JS2008与HB/HEBEU/2020相似性分别为97.3%、97.0%和96.7%。在所有市售疫苗株中,变异疫苗株AJ1102与HB/HEBEU/2020相似性最高,为98.3%,其次是变异疫苗株LW/L,与HB/HEBEU/2020相似性为97.8%;经典疫苗株attenuated CV777和CV777则与HB/HEBEU/2020的相似性稍低,均为96.5%。

表2 HB/HEBEU/2020株与SNJ-P株基因组的变异性比对

五角星表示本研究的目标毒株;黑圆表示疫苗毒株。下同Pentagram represents the target strain of this study;The black circles represent vaccine strains.The same as below图2 HB/HEBEU/2020全基因组与各PEDV参考毒株的相似性比对Fig.2 Similarity alignment of whole genome of HB/HEBEU/2020 and the PEDV reference strains
2.3 HB/HEBEU/2020 S基因相似性分析
通过对HB/HEBEU/2020全基因组测序结果进行分析,可知其S基因全长4 161 bp,编码1 386个氨基酸。由图3可知,HB/HEBEU/2020S基因与比利时CV777标准株的相似性为93.5%,共存在248个核苷酸突变,在167 bp处存在G插入,在175—185 bp处存在CAGGGTGTTAA插入,在416—418 bp处存在ATA插入,在475—480 bp处存在CGTGAT缺失,推导的氨基酸相似性为92.8%,共存在93个氨基酸突变,在56—59和140位氨基酸处分别存在GENQ和N插入,在163—164位氨基酸处存在DI缺失。HB/HEBEU/2020S基因与所选参考株相似性在93.2%~98.8%之间,其中与HB2018的相似性最高,为98.8%。HB2018、CH/HLJ/18、GER/L03208/2019、CH/HNYF/14、GD-XL-2019、S14、USA/Colorado/2013、AJ1102、SNJ-P、SD2014、BJ-2011-1、LW/L、PEDV YZ株S基因与HB/HEBEU/2020相似性均超过95.5%,SC1402相似性为93.3%。变异疫苗株AJ1102和LW/LS基因与HB/HEBEU/2020相似性分别为97.3%和96.9%,相比之下,经典疫苗株attenuated CV777和CV777则与HB/HEBEU/2020的相似性稍低,分别为93.3%和93.5%。
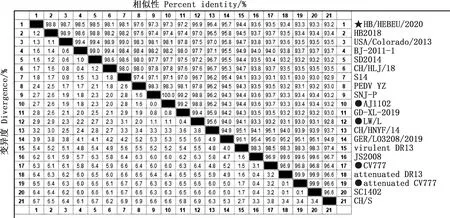
图3 HB/HEBEU/2020 S基因与各PEDV参考毒株的相似性对比Fig.3 Similarity alignment of S gene of HB/HEBEU/2020 and the PEDV reference strains
2.4 HB/HEBEU/2020基因组遗传进化分析
由图4可知,21株PEDV毒株进化形成了G1群和G2群,G1群包含G1a和G1b亚群,G1a亚群以经典株CV777为代表,还包含virulent DR13和CH/S,G1b亚群以JS2008为代表,还包含attenuated DR13、SC1402和attenuated CV777毒株;G2群包含G2a和G2b亚群,G2a亚群以变异株BJ-2011-1为代表,还包括SNJ-P、SD2014、USA/Colorado/2013、S14、HB2018和CH/HLJ/18等毒株,G2b亚群以变异株AJ1102为代表,还包括GD-XL-2019和LW/L毒株。HB/HEBEU/2020属于G2a群,该群中所有14株PEDV均分离于2010年之后,包括11株中国株SNJ-P、SD2014、BJ-2011-1、HB2018、CH/HLJ/18、PEDV-YZ、AJ1102、CH/HNYF/14、HB/HEBEU/2020、GD-XL-2019和LW/L,1株美国株USA/Colorado/2013,1株韩国株S14和1株德国株GER/L03208/2019。HB/HEBEU/2020与市售的经典疫苗株attenuated CV777和CV777遗传距离(亲缘关系)较远,而与变异疫苗株AJ1102和LW/L遗传距离较近。

图4 HB/HEBEU/2020基因组遗传进化分析Fig.4 Phylogenetic analysis of whole genome of HB/HEBEU/2020
2.5 HB/HEBEU/2020 S基因遗传进化分析
由图5可知,S基因遗传进化分析结果与全基因组结果基本一致,HB/HEBEU/2020S基因与6株中国株PEDV-YZ、BJ-2011-1、CH/HLJ/18、HB2018、SD2014和CH/HNYF/14,1株美国株USA/Colorado/2013和1株韩国株S14均属于G2a亚群,其中与HB2018的遗传距离最近,具有共同的起源,而AJ1102与SNJ-P、LW/L和GD-XL-2019形成了G2b亚群,CV777与CH/S、virulent DR13、attenuated DR13和GER/L03208/2019形成了G1a亚群,JS2008与attenuated DR13、attenuated CV777和SC1402形成了G1b亚群。值得关注的是,基于S基因遗传进化分析,德国株GER/L03208/2019和中国株CH/HNYF/14虽分别被划为G1a亚群和G2a亚群,但其S基因在遗传上实际处于G1和G2群之间。2株PEDVS基因更接近G1和G2群共同的始祖株。HB/HEBEU/2020S基因与市售的经典疫苗株attenuated CV777株和CV777遗传距离(亲缘关系)较远,而与变异疫苗株AJ1102和LW/L遗传距离较近。
2.6 HB/HEBEU/2020基因组重组分析
为了解HB/HEBEU/2020潜在基因重组情况,基于图4 PEDV遗传系谱,选择11株具有代表性的PEDV毒株(SNJ-P、AJ1102、LW/L、CH/HNYF/14、BJ-2011-1、SD2014、PEDV-YZ、GD-XL-2019、HB2018、attenuated CV777和SC1402)进行基因组重组分析。由表3可知,HB/HEBEU/2020基因组存在3个潜在重组事件,根据重组事件发生的概率,事件1、2均至少有5种重组检测方法呈阳性,发生概率较高。重组事件1主要亲本可基于G2a群的SD2014进行推导,次要亲本为G2a群的SNJ-P,重组断点为15 918—22 119 bp(ORF1b-S基因部分区域);重组事件2主要亲本为G2a群的HB2018,次要亲本为G1b群的SC1402,重组断点为100—734 bp(5′-UTR-ORF1a基因部分区域),发生在G1群和G2群之间;重组事件3,发生概率较低(所有7种重组检测方法中2种呈阳性,重组断点为2 214—2 729 bp(5′-UTR基因部分区域),主要亲本为G2a群的SNJ-P,次要亲本可基于G1b群的经典疫苗株attenuated CV777进行推导。
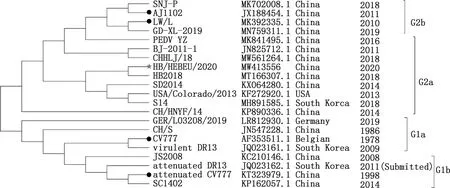
图5 HB/HEBEU/2020 S基因遗传进化分析Fig.5 Phylogenetic analysis of S gene of HB/HEBEU/2020

表3 HB/HEBEU/2020株基因组的重组分析
3 讨 论
PEDV是威胁全球养猪业的一种重要冠状病毒,2010年后,中国的流行毒株以变异型PEDV毒株为主,许多已免疫的猪场纷纷发病,仔猪死亡率极高,损失巨大[26]。目前,PEDV仍在不断流行和进化,然而近2年具有代表性的PEDV毒株全基因组遗传信息却十分匮乏。2020年底,河北某大型猪场暴发PED,本研究采集病料成功扩增并获得1株突变型PEDV HB/HEBEU/2020全基因组序列,并进行了遗传变异和重组分析。
HB/HEBEU/2020属于PEDV突变株,在相似性和遗传进化上与当前主要的商业化传统疫苗株存在差异。虽然基于PEDV基因组和S基因相似性分析结果略有不同,HB/HEBEU/2020与以BJ-2011-1、USA/Colorado/2013、HB2018、S14和SD2014等为代表的分离于2010年后的PEDV毒株相似性均较高。本研究选择了ML法进行遗传进化分析。利用ML法进行遗传进化分析虽然耗时长,但却往往能反应真实的情况,结果更为准确[27-28]。本研究发现,不论是全基因组遗传进化分析还是S基因遗传进化分析,PEDV均呈现两种不同的进化路径,形成了G1群和G2群,G1群可进一步分化为G1a亚群和G1b亚群,G2群可进一步分化为G2a亚群和G2b亚群,该结果与Wang等[26]的研究结果一致。德国株GER/L03208/2019在全基因组遗传进化分析和S基因遗传进化分析中呈现不同的结果,但在遗传上都处于G1a群和G2a群之间,亲缘关系更接近于G1群和G2群共同的始祖株。与GER/L03208/2019类似,CH/HNYF/14在遗传上也更接近于G1群和G2群共同的始祖株。相比其他甲型冠状病毒,如猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和人冠状病毒229E株等,一种高头蝠冠状病毒512/2005株(Scotophilusbat coronavirus,BtCoV)与PEDV原型株CV777的亲缘性更高,说明CV777与BtCoV存在共同祖先,冠状病毒可能在猪和蝙蝠之间存在跨物种传播[29]。HB/HEBEU/2020属于G2a群,与PEDV原型株CV777(G1a亚群)的遗传距离较远,因此HB/HEBEU/2020的进化方向与高头蝠来源的BtCoV关系不大。目前,以CV777为基础的经典株PEDV疫苗在中国市场占有较大份额,本研究提示这些经典疫苗可能很难对HB/HEBEU/2020提供有效的保护。在所有市售疫苗株中,AJ1102(G2b亚群)与HB/HEBEU/2020遗传距离最近,同属于G2群,这提示AJ1102 与HB/HEBEU/2020可能进化于同一个祖先毒株。由于AJ1102与HB/HEBEU/2020相似性达98.3%,并且目前尚无以G2b亚群毒株开发的商品化PEDV疫苗,本研究结果表明现阶段选择以AJ1102毒株为基础的PEDV疫苗并制定免疫计划将有助于对HB/HEBEU/2020的防控。近年来,中国频频发生G2b亚群PEDV变异毒株感染疫情[22,26],损失惨重,建议中国及早布局G2b亚群PEDV毒株疫苗研发计划以应对PEDV疫情。
PEDV仍在不断进化,HB/HEBEU/2020已经进化为跨G1和G2群的重组变异株。以冠状病毒为代表的RNA病毒通过点突变积累和同源重组进化有利于基因损伤修复、组织嗜性和宿主范围改变,进而增强环境适应性[22,30-33]。本研究发现,HB/HEBEU/2020存在3个潜在的重组事件,其中重组事件1和2均至少有5种检测方法验证呈阳性,说明发生概率较大。翟新国等[22]研究发现PEDV G1群和G2群毒株S1基因可能存在重组事件。在本研究中,重组事件2和3证明PEDV G1b亚群和G2a亚群基因组之间存在重组事件,说明不同PEDV毒株之间普遍存在基因重组现象[19,34]。由于PEDV重组发生会带来潜在不可控风险,因此建议种猪场在制定免疫程序时,应基于本场病原日常监测结果,选择亲缘关系较近的疫苗毒株(避免不同疫苗株混用),从而有效防止强毒重组突变株的产生。Boniotti等[32]报道了1株2009—2012年间流行于意大利的猪重组肠道冠状病毒(Swine enteric coronavirus,SeCoV),SeCoV由PEDV的S基因和TGEV的骨架重组产生,随后,德国和西班牙等国也暴发了这种重组型SeCoV引起的疫情[35];Valkó等[36]发现在匈牙利SeCoVS基因和PEDV又有了新的重组现象,这些都说明冠状病毒属的成员之间也可发生基因重组,这些广泛发生的猪冠状病毒重组将持续对生猪养殖业带来严重威胁。因此,应继续加强对PEDV病原学监测,揭示PEDV潜在起源、演化和重组的分子机制。
4 结 论
本研究成功克隆了河北省暴发于2020年底的1株变异型PEDV(HB/HEBEU/2020)全基因组,发现其与SNJ-P株相似性最高,属于PEDV G2b亚群,并且存在跨PEDV亚群重组现象。研究结果有助于揭示PEDV在中国的自然选择与进化规律,为制定合理的防控策略提供理论和依据。
