小檗胺在严重烧伤大鼠心肌损伤中的保护作用
2022-08-22翟蒙恩段维勋刘金成金振晓俞世强
张 彬,翟蒙恩,段维勋,刘金成,金振晓,俞世强
临床研究表明,烧伤面积占全身表面积30%以上的严重烧伤其初始阶段即会发生心肌损害[1-2]。如果在严重烧伤后没有立即进行医疗干预,心肌损伤会导致心脏功能障碍,在这种情况下可能发生潜在的烧伤休克,导致循环功能受损和可能的死亡事件的发生[3]。 虽然严重烧伤引起心肌损伤的确切机制尚未完全阐明,但越来越多的证据表明,心肌损伤涉及多个病理生理过程,包括缺氧、炎症、钙信号传导、细胞凋亡、败血症和氧化应激等[4-5]。 因此,寻找一种能有效减轻烧伤所致心脏并发症的治疗措施成为降低严重烧伤患者终末危险事件发生的关键途径之一。
小檗胺(berbamine,BBM)是一种从中草药黄芦木中分离而来的双苄基异喹啉类天然产物[6]。 以往其多被应用于放、化疗或慢性苯中毒所导致的白细胞减少症[7]。 但近年来越来越多的研究验证了BBM 在心血管疾病当中的治疗作用[8-10],然而 BBM对严重烧伤引起的心肌损伤的保护作用尚未见相关报道。 因此,在本研究中通过建立Ⅲ度烧伤动物模型,以明确BBM 对严重烧伤引起的心肌损伤的潜在保护作用,并进一步探究其可能的分子机制。
1 材料与方法
1.1 实验动物及主要试剂 6 ~8 周龄无特定病原体级雄性SD 大鼠40 只,体重200~250 g,饲养于清洁级环境中,购自空军军医大学实验动物中心,使用许可证号:SYXK(军)2012-0022。 BBM(美国 sigma公司);白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国Abcam 公司);原位末端标记法( terminal - deoxynucleoitidyl transferase mediated nick end, TUNEL)凋亡检测试剂盒(瑞士 Roche 公司);二氢乙锭(dihydroethidium,DHE)活性氧(reactive oxygen species, ROS)检测试剂盒(美国 Invitrogen 公司);髓过氧化物酶(myeloperoxidase,MPO)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)试剂盒(中国南京建成生物工程研究所);沉默信息调控因子3(silent information regulation-3,SIRT3)去乙酰化活性检测试剂盒(美国 Enzo Life Sciences 公司);SIRT3、SOD2、Ac-SOD2、切割型半胱氨酸天冬氨酸蛋白酶3(cleaved caspase-3)和甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体(美国 Abcam 公司)。
1.2 实验方法
1.2.1 动物分组及模型建立 雄性 SD 大鼠 40 只随机均分为以下4 组:假烧伤组(Sham)、单纯BBM处理组(BBM)、烧伤组(Burn)、烧伤+BBM 处理组(Burn+BBM),每组 10 只。 烧伤模型法建立如下,大鼠经腹腔注射戊巴比妥(40 mg/kg)麻醉后,脱去背部毛发。 仰卧位固定于模板设备上,将其背部浸于100℃水下12 s,以产生30%的总体表面积(total body surface area,TBSA)全层真皮Ⅲ度烧伤。 Sham组和BBM 组大鼠则背部脱毛后浸于37℃温水中12 s。 所有大鼠烫伤后迅速晾干并行液体复苏,Sham 组和Burn 组大鼠在烫伤后0 h 和6 h 腹腔注射乳酸林格氏液[4 ml/(kg·TBSA)],BBM 组和Burn+BBM 组大鼠在烫伤后0 h 和6 h 腹腔注射溶解于乳酸林格氏液中的 BBM[100 mg/(kg·TBSA)]。在烧伤处理12 h 后对大鼠实施安乐死,然后通过开胸获得心脏样本及眶后放血收集血样。
1.2.2 心脏功能监测 分离并暴露大鼠右侧颈总动脉,将聚乙烯医用塑料导管和压力换能器内充满0.3%肝素生理盐水注射液,排走气泡。 将颈总动脉远心端结扎,近心端用动脉夹夹住,用眼科剪刀以45°角剪口,将准备好的颈总动脉导管向近心端一直插入到左心室。 导管的末端依次连接到RM6240B生理信号采集系统进行数据采集。 稳定5 min 后,测量左室收缩压(left ventricular systolic pressure,LVSP)和左室压最大增减速率(±dp/dtmax)以评定心功能。
1.2.3 心肌组织染色
1.2.3.1 伊红染色(hematoxylin-eosin,HE) 取适量大鼠左心室心肌组织标本,经4%多聚甲醛固定后制成5 μm 厚的石蜡组织切片,用苏木素和伊红染料分别染色细胞核及细胞质,封片后置于显微镜下观察。
1.2.3.2 TUNEL 染色 将 5 μm 厚的心脏石蜡切片用1%的蛋白酶 K 室温孵育 20 min。 避光滴加TUNEL 染液后继续在室温中孵育30 min 以标记凋亡细胞核,反应终止后用DAPI 工作液室温孵育15 min 以染色细胞核。 在激光共聚焦显微镜下随机选择5 个无重叠图像观察并拍照,计算心肌细胞总数和凋亡心肌细胞的数量。 心肌细胞凋亡百分比计算公式为:凋亡心肌细胞百分比=凋亡心肌细胞数/心肌细胞总数×100%。
1.2.3.3 DHE 染色 取适量大鼠左心室心肌组织标本,制备成5 μm 厚的心脏冰冻切片。 避光滴加DHE 染液后室温孵育30 min,在激光共聚焦显微镜下随机选择5 个无重叠图像观察并拍照。 使用Image-Pro Plus 软件分析切片中的二氢乙锭荧光强度代表各组心肌组织ROS 生成量。
1.2.4 心肌损伤标志物测定 将收集到的血样在4℃下2 000 g 离心15 min,收集上清液。 使用化学自动分析仪测定血清肌钙蛋白T(cardiac troponin T, cTnT) 和 肌 酸 激 酶 同 工 酶 ( creatine kinase isoenzyme, CKMB)水平来评估心肌损伤。
1.2.5 心肌炎性因子水平测定
1.2.5.1 将收集到的血样在 4℃ 下 2 000 g 离心 15 min,收集上清液。 使用 ELISA 试剂盒测量血清IL-1β、TNF-α 和 IL-6 以评估心肌炎性因子水平。
1.2.5.2 取适量心肌组织在 MPO 试剂盒试剂Ⅱ中进行匀浆,其重量/体积比为1 ∶19。 严格按照MPO试剂盒说明书对组织中的MPO 活性进行检测。 一个单位的 MPO(U/g)定义为在37℃下降解1 μmol/L 过氧化物/1 g 心脏组织所需的MPO 量。
1.2.6 心肌 SOD 活性及 MDA 含量测定 按照重量体积比为1 ∶9 对心肌组织进行匀浆,将组织匀浆在4℃下700 g 离心30 min,收集上清液,使用 SOD 和MDA 检测试剂盒进行分析以评估心肌组织氧化应激水平。
1.2.7 Western Blot 检测蛋白表达 将制备好的心肌组织蛋白样本按照每孔30 μg 进行上样,用SDS-PAGE 试剂盒配置的分离胶进行电泳。 随后将分离的蛋白质转移到聚偏二氟乙烯膜上,在室温下用5%脱脂牛奶封闭2 h。 依次将切好的条带放入 SIRT3 (1 ∶1 000)、Ac-SOD2(1 ∶1 000)、SOD2(1 ∶1 000)、cleaved caspase-3(1 ∶1 000)和GAPDH(1 ∶5 000)的一抗管中 4℃过夜孵育,TBST缓冲液洗涤三次后,用辣根过氧化物酶偶联的二抗(1 ∶4 000)孵育条带 2 h。 使用电化学发光检测试剂并通过凝胶成像系统观察蛋白条带,采用Image J软件进行密度分析。
2 结 果
2.1 BBM 改善严重烧伤大鼠心脏功能障碍 心导管监测记录发现,与Sham 组比较,Burn 组大鼠心脏功能显著受损,表现为反映心脏收缩功能指标的LVSP 与±dp/dtmax值均显著降低(P<0.01);给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠的心脏功能显著改善,其 LVSP 与±dp/dtmax值均得到显著上升(P<0.01)。 与 Sham 组比较,BBM 组LVSP 与±dp/dtmax值无明显变化(P>0.05,见图 1)。可见,BBM 处理可显著改善严重烧伤大鼠心脏功能障碍。

图1 小檗胺对严重烧伤大鼠心脏功能的影响
2.2 BBM 减轻严重烧伤大鼠心肌组织损伤 心肌组织微观结果显示,与Sham 组比较,Burn 组大鼠心肌细胞水肿,部分发生灶性溶解,心肌纤维出现肌束分离和断裂;给予BBM 处理后,BBM+Burn 组大鼠心肌组织病变程度显著减轻,心肌细胞水肿及肌束分离断裂现象明显改善。 与Sham 组比较,BBM 组心肌微观组织结构无明显影响(图2 A)。 血清学检测结果显示,与Sham 组比较,Burn 组大鼠心肌损伤标志物 CKMB 和 cTnT 均显著升高(P<0.01);给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠的CKMB 和 cTnT 水平显著下降(P<0.01)。 与 Sham组比较,BBM 组血清CKMB 和cTnT 水平无明显变化(P>0.05,图 2 B、C)。 可见,BBM 处理可显著减轻严重烧伤大鼠心肌组织损伤。

图2 小檗胺对严重烧伤大鼠心肌组织结构及血清CKMB 和cTnT 水平的影响
2.3 BBM 抑制严重烧伤大鼠心肌组织炎症反应与Sham 组比较,Burn 组大鼠血清中炎性因子IL-1β、IL-6 及 TNF-α 水平均显著增加(P<0.01);给予 BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠血清中 IL-1β、IL-6 及 TNF-α 的水平均显著降低(P<0.01,图 3A~C)。 测定 MPO 活性以评估中性粒细胞在心肌组织中的聚集情况,与Sham 组比较,Burn 组大鼠心肌组织 MPO 活性显著升高;(P<0.01);给予 BBM 处理后,与 Burn 组比较,BBM +Burn 组大鼠心肌组织 MPO 活性显著降低(P<0.01,图3D)。 与 Sham 组比较,BBM 组大鼠血清炎性因子的表达及心肌组织MPO 活性均无明显变化(P>0.05)。 可见,BBM 处理可显著抑制严重烧伤大鼠心肌组织炎症反应。
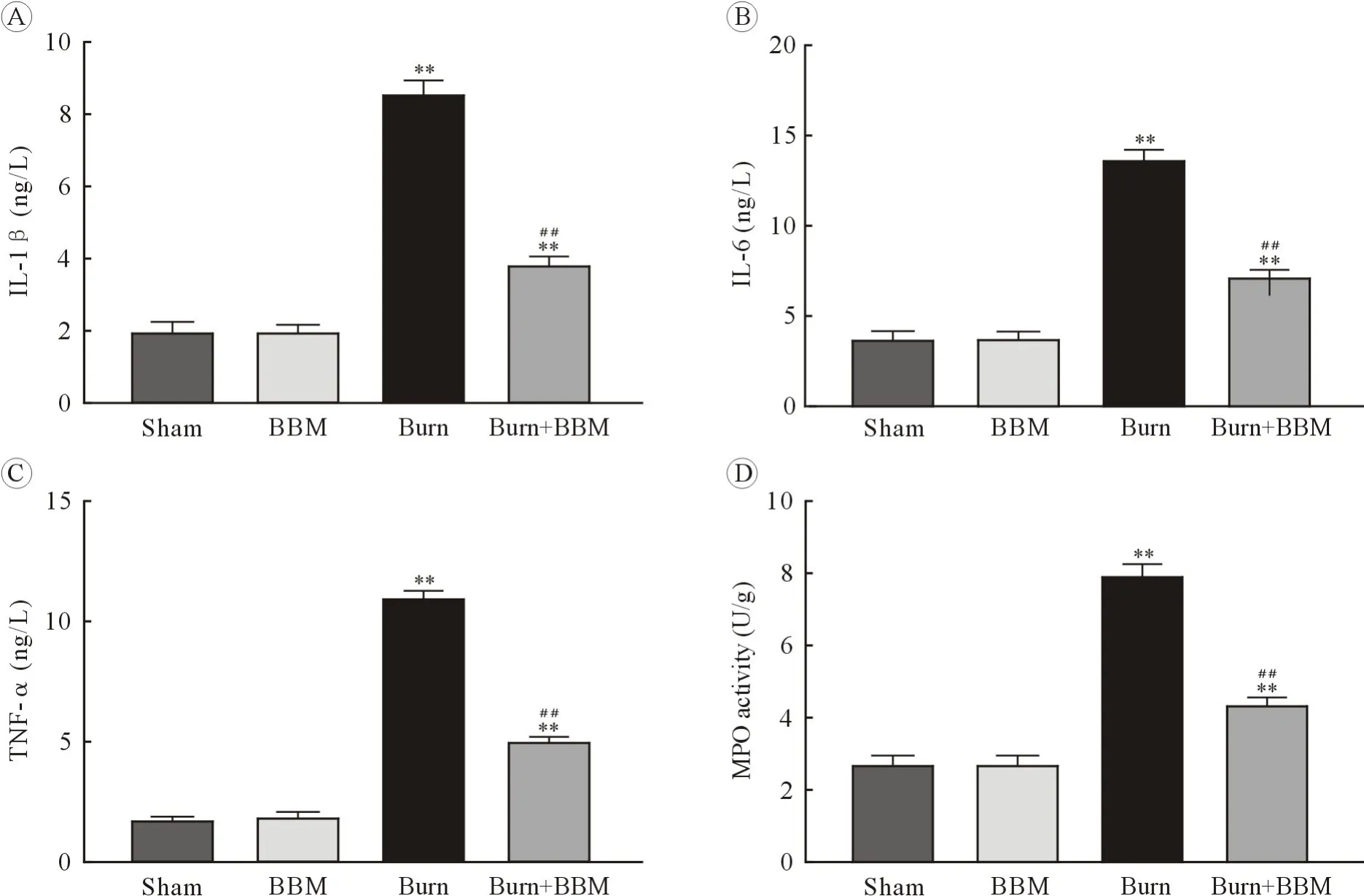
图3 小檗胺对严重烧伤大鼠心肌组织炎症水平的影响
2.4 BBM 减轻严重烧伤大鼠心肌组织氧化应激水平 与Sham 组比较,Burn 组大鼠心肌组织中MDA含量显著上升,SOD 活性显著下降(P<0.01);给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠心肌组织中MDA 生成明显被抑制,SOD 活性得到明显升高(P<0.01,图 4A、B)。 DHE 染色以评估心肌组织ROS 生成情况,与 Sham 组比较,Burn 组大鼠心肌组织 ROS 产量显著增加(P<0.01);给予 BBM处理后,与Burn 组比较,BBM+Burn 组大鼠心肌组织 ROS 生成量明显下降(P<0.01,图 4C、D)。 与Sham 组比较,BBM 组上述氧化应激指标均无明显变化(P>0.05)。 可见,BBM 处理可显著减轻严重烧伤大鼠心肌组织氧化应激损伤。

图4 小檗胺对严重烧伤大鼠心肌组织氧化应激水平的影响
2.5 BBM 抑制严重烧伤大鼠心肌细胞凋亡 心肌组织TUNEL 染色结果显示,与 Sham 组比较,Burn组大鼠心肌组织细胞凋亡明显增多(P<0.01);给予 BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠心肌组织细胞凋亡明显减少(P<0.01,图 5A、B)。与Sham 组比较,Burn 组大鼠心肌组织凋亡蛋白cleaved caspase-3 的表达明显上升(P<0.01);给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠心肌组织cleaved caspase-3 蛋白表达被显著抑制(P<0.01,图 5C)。 与 Sham 组比较,BBM 组心肌细胞凋亡率及cleaved caspase-3 的蛋白表达均无明显变化(P>0.05)。 可见,BBM 处理可显著抑制严重烧伤大鼠心肌细胞凋亡。

图5 小檗胺对严重烧伤大鼠心肌细胞凋亡水平的影响
2.6 BBM 激活严重烧伤大鼠心肌SIRT3 信号通路与Sham 组比较,Burn 组大鼠心肌组织 SIRT3 蛋白的活性及表达均显著减低,SIRT3 下游调控分子SOD2 乙酰化程度显著升高(P<0.01);给予 BBM处理后,与Burn 组比较,BBM+Burn 组大鼠心肌组织SIRT3 蛋白的活性及表达均显著上升,SOD2 乙酰化程度显著下降(P<0.01)。 与 Sham 组比较,BBM 组心肌组织SIRT3 蛋白的活性及表达和SOD2 乙酰化程度均无明显变化(P>0.05,图 6)。 可见,BBM 处理可显著激活严重烧伤大鼠心肌SIRT3 信号通路。

图6 BBM 对严重烧伤大鼠心肌组织SIRT3 通路的影响
3 讨 论
心肌损害常常发生在严重烧伤的早期阶段,心肌损伤不仅会导致心功能不全,也会加重其他组织器官缺血缺氧损害[1,11]。 因此,早期的医疗干预以预防烧伤引起的心肌损伤成为临床研究的重点。BBM 是从天然植物中提取的多酚类化合物,在心血管保护方面具有多种生物学功能[8-10]。 然而,BBM对严重烧伤引起的心肌损伤是否具有治疗效果尚未完全阐明。 本实验采用背部烫伤法建立严重烧伤动物模型,观察到BBM 可明显减轻心肌组织炎症反应和氧化应激损伤,进而改善严重烧伤所致的心肌损伤,并证明这种作用与BBM 激活SIRT3 信号有关。
导致严重烧伤患者心功能不全的重要原因之一是其早期的心肌组织损伤[12-13]。 本实验结果同样发现,严重烧伤 12 h 后,与 Sham 组比较,Burn 组大鼠血清中CKMB 和cTnT 显著升高,心肌组织细胞水肿,部分发生灶性溶解,心肌纤维出现肌束分离和断裂。 继而心功能检测发现,Burn 组大鼠LVSP 与±dp/dtmax值均显著降低,心脏收缩功能显著受损。给予 BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠的心肌损伤标志物水平显著下降,心肌组织病变程度显著减轻,并且心脏收缩功能得到显著改善。以上结果表明,BBM 对大鼠严重烧伤引起的急性心肌损伤具有潜在的治疗作用。
前期研究已证实严重烧伤可显著增加促炎细胞因子的产生[14-15]。 IL-1β、IL-6 和 TNF-α 是心肌损伤过程中重要的炎性因子,可通过抑制cAMP 等信号抑制心肌细胞收缩[16]。 此外,IL-1β、IL-6 和TNF-α 还可通过诱导中性粒细胞与内皮细胞的黏附而在微血管和心脏损伤中发挥关键作用[17]。MPO 是一种血红素辅基的血红素蛋白酶,富含于中性粒细胞中,其活性直接反映了心肌组织中中性粒细胞的富集情况[18]。 本研究显示,与 Sham 组比较,Burn 组大鼠血清中 IL-1β、IL-6 和 TNF-α 的水平均显著增加,且心肌组织MPO 活性显著升高。 给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠血清炎性因子的表达及心肌组织MPO 活性均显著下降。 以上结果表明,BBM 在严重烧伤后的心脏保护作用与抑制炎性因子的产生和中性粒细胞浸润有关。
大量证据表明,严重烧伤也可显著上调机体氧化应激水平[19-20]。 当体内高活性分子如 ROS 和活性氮自由基(reactive nitrogen species, RNS)产生超出了机体的清除能力,氧化系统与抗氧化系统失衡,继而导致心肌组织损伤[21]。 此外,循环中 MPO 水平升高也可进一步促进ROS 的生成,而ROS 又可通过氧化低密度脂蛋白导致血管内皮细胞和心肌细胞功能障碍[22]。 本研究显示,与 Sham 组比较,Burn组大鼠心肌组织中MDA 含量及ROS 产量显著增加,抗氧化物SOD 活性显著下降。 给予BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠 MDA 含量及ROS 产量明显降低,SOD 活性明显升高。 以上结果表明,BBM 在严重烧伤后的心脏保护作用与抑制心肌组织氧化应激水平有关。
严重烧伤引起的炎症与氧化应激损伤均可导致心肌细胞线粒体功能障碍,并诱发凋亡相关因子的释放[23-24],这与心肌损伤的发生发展紧密相关。caspase-3 的裂解是调控凋亡DNA 片段化的关键步骤[25]。 本研究显示,与 Sham 组比较,Burn 组大鼠心肌组织cleaved caspase-3 的表达明显上升,心肌细胞凋亡显著增多。 给予BBM 处理后,与Burn 组比较,BBM+Burn 组大鼠心肌组织 caspase-3 裂解明显被抑制,心肌细胞凋亡率显著下降。 以上结果表明,BBM 可通过抑制炎症反应与氧化应激损伤抑制心肌细胞凋亡,进而减轻大鼠严重烧伤引起的急性心肌损伤。
一种依赖于烟酰胺腺嘌呤二核苷酸的去乙酰化酶SIRT3 在调控细胞周期、代谢及细胞寿命方面起着非常重要的作用。 其主要定位于线粒体,且广泛存在于心脏等富含线粒体的组织器官中[26]。 近年来研究发现,SIRT3 在多种心血管疾病中都起到了保护性作用,其机制与抵抗炎症与氧化应激反应相关[27]。 Zhai 等[28]发现,褪黑激素可通过 SIRT3 依赖性调节氧化应激和细胞凋亡改善心肌缺血再灌注损伤。 Chen 等[29]报道,三甲胺-N-氧化物可通过激活 SIRT3-SOD2-mtROS 信号通路抑制 NLRP3 炎症小体诱导的血管炎症反应。 然而,SIRT3 信号是否介导了BBM 在严重烧伤所致急性心肌损伤中的保护性作用有待进一步探究。 本研究显示,与Sham组比较,Burn 组大鼠心肌SIRT3 蛋白的活性及表达均显著减低,SIRT3 下游调控分子SOD2 乙酰化程度显著升高。 给予 BBM 处理后,与 Burn 组比较,BBM+Burn 组大鼠心肌组织SIRT3 信号被显著激活。以上结果表明,BBM 发挥抗严重烧伤所致急性心肌损伤的作用可能与其激活心肌SIRT3 信号有关。
综上所述,BBM 通过激活心肌SIRT3 信号,增强心肌组织抗氧化应激损伤和抗炎症反应的能力,进而减轻严重烧伤大鼠心肌损伤。
