血清中性粒细胞明胶酶相关脂质沉积蛋白预测A 型主动脉夹层术后急性肾损伤的临床价值
2022-08-22周晔农王东旭王馨怡王娇姣段维勋刘金成白军锋马鹏飞金振晓俞世强
杨 晨,侯 鹏,周晔农,王东旭,丁 伟,张 超,王馨怡,王娇姣,段维勋,刘金成,白军锋,马鹏飞,金振晓,俞世强
Stanford A 型主动脉夹层(type A aortic dissection,TAAD)是心血管外科的危急重症,其较为公认的治疗方法为主动脉弓置换手术,且与多种并发症息息相关[1]。 急性肾损伤(acute kidney injury,AKI)是全主动脉弓置换术后发病率较高的并发症之一,高达 50% ~ 70%,且与死亡率密切相关[2-3]。 目前AKI 的主要评价指标为肌酐和尿量。 但因肌酐多延迟增加且诊断敏感度较低,较难满足临床需求[4]。因此早期且可靠的AKI 生物标志物对于全主动脉弓置换术后AKI 的预测和防治具有重要意义。 中性粒细胞明胶酶相关脂质沉积蛋白(neutrophil gelatinase- associated lipocalin,NGAL)是一种与中性粒细胞明胶酶共价结合的小分子蛋白质,同时也是肾毒性和缺氧性AKI 最快诱导表达的蛋白,可在初次肾损伤后 2 ~ 3 h 内检测到[5-6]。 已有研究证明,NGAL 为心脏手术后 AKI 的早期生物标志物[7]。 本研究将对全主动脉弓置换围术期血清NGAL 的浓度,以及其对AKI 的早期诊断能力进行探究。
1 资料与方法
1.1 研究设计与对象 本研究为单中心前瞻性病例对照研究,已通过西京医院伦理委员会批准(批准文号:KY20182052-1 号),且在中国临床试验注册中心完成注册(ChiCTR1800018701)。 纳入2018年10 月至2019 年12 月于西京医院心外科行全主动脉弓置换的155 名 Stanford TAAD 患者。 排除2名妊娠患者,2 名术后48 h 内死亡患者,2 名术前有慢性肾脏疾病透析史患者以及6 名重要数据缺失的患者,最终纳入143 例患者。
1.2 手术方法 所有患者均接受全主动脉弓置换和冷冻象鼻支架植入手术。 手术使用4 分支人工血管(Vascutek Terumo Inc,苏格兰,英国)进行主动脉弓置换,且在降主动脉中植入冷冻象鼻支架(Micro-Port Medical,上海,中国)。 术中常规行中度低温停循环(25 ~ 28℃) 和选择性顺行脑灌注[5 ~ 10 ml/(kg·min)]。 麻醉诱导开始时通过静脉注射舒芬太尼、罗库溴铵、丙泊酚和咪达唑仑,术中使用舒芬太尼、哌库溴铵、咪达唑仑维持麻醉。 术后镇痛采用舒芬太尼和瑞芬太尼。 所有手术均由同一个手术团队完成。
1.3 数据采集 本研究人群所有数据均为前瞻性收集。 同时分别于围术期5 个固定时间点采集患者的静脉血,分别为:术前、术后0 h、术后12 h、术后24 h 以及术后48 h。 其中术前为麻醉诱导时,术后0 时指手术结束入ICU 时。 在12 h 内进行离心,取上清血清保存于-80℃条件下,用酶联免疫吸附法测定(ELISA)检测血清内NGAL 浓度(试剂盒购自R&D,明尼苏达,美国)。 AKI 诊断标准仅使用改善全球肾脏病预后组织(Kidney Disease Improving Global Outcomes,KDIGO)标准中的肌酐标准[8]。 基线肌酐水平以术前最后一次检验为准。 术后7 d 内肌酐升高为基线的1.5 倍或48 h 内绝对值较术前升高≥26.5 μmol/L 可诊断为 AKI。 术前肾小球滤过率采用Cockcroft-Gault 公式计算。 本文将发病至手术时间按照<24 h,24 ~48 h,>48 ~72 h 以及>72 h,分为Ⅰ、Ⅱ、Ⅲ、Ⅳ等级;并将夹层累及范围按照累及至胸主动脉,累及至腹主动脉以及累及至髂动脉,分为Ⅰ、Ⅱ、Ⅲ等级。
1.4 统计方法 采用 Kolmogorov-Smirnov 法进行正态性检验,符合正态性检验的计量资料,用Mean±SD 表示,组间比较采用t检验。 非正态分布计量资料以中位数(四分数间距)[Q(Q1,Q3)]表示,非双变量正态分布的比较采用非参数独立样本Mann-Whitney 检验或 Kruskal-Wallis H 检验。 计数资料以例数(百分比)[n(%)]表示,率的比较使用卡方检验。 计量资料的相关性采用Pearson 相关。P<0.05 为差异有统计学意义。 将单因素分析中P<0.05 的指标纳入多因素分析采用二元logistic 回归或线性回归进行多因素分析。 采用受试者工作特征(receiver operating characteristic curves,ROC)曲线的曲线下面积(area under the curve, AUC)、灵敏度、特异度、约登指数获取最佳临界值。 采用Delong 检验来对比不同ROC 曲线的AUC 的差别。 使用SPSS 19.0 和 Medcalc 软件进行统计学分析。
2 结 果
2.1 患者特征 本研究人群平均年龄为(48±8.6)岁,84.6%为男性,73 名(51.0%)患者发生术后AKI,18 人(12.6%)行透析治疗,术后 30 d 内 14 名(9.8%)患者死亡。 术后发生 AKI 的患者身体质量指数(body mass index, BMI)较高、单动脉插管比例较高、合并冠状动脉旁路移植手术(coronary artery bypass graft,CABG)手术较多、手术时间和体外循环时间以及升主动脉阻闭时间较长、术中输红细胞量较大。 患者基线信息以及手术细节见表1 和表2。

表1 患者术前基线资料

表2 患者术中及术后参数比较
2.2 患者围术期血清NGAL 水平与AKI 的相关性研究对象的术前血清 NGAL 平均水平为27.35(18.77,41.55) μg/L,术后 0 h 时 NGAL 水平升高且达到顶峰,为 65.07(46.44,89.73)μg/L。 术后 12 h内 NGAL 水平迅速下降、12 h 时 NGAL 水平为 48.46(33.32,73.61)μg/L,12 h 后 NGAL 水平缓慢下降,术后 24 h NGAL 为 46.28(29.60,63.65)μg/L,术后48 h 为 44.26(33.14,65.35)μg/L,仍高于术前水平。术前及术后48 h 内发生AKI 患者的NGAL 水平均高于未发生AKI 者,且差异具有统计学意义。 见图1。
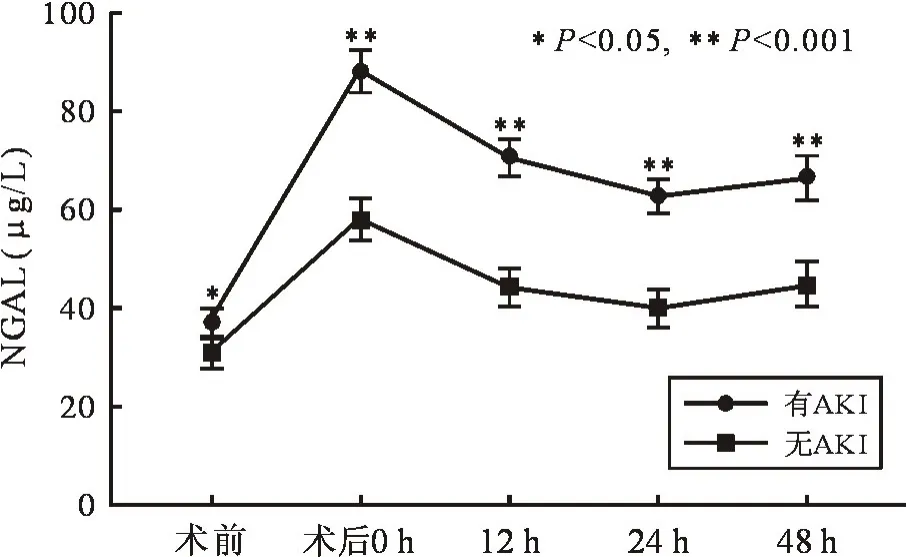
图1 不同AKI 发生情况患者围术期血清NGAL 水平
2.3 术后AKI 的多因素分析 根据AKI 的单因素分析结果,将BMI、单动脉插管、合并CABG、手术时间、体外循环时间、升主动脉阻闭时间、术中红细胞输入量以及术后0 h 时NGAL 水平纳入多因素回归分析中。 在此模型中,术后0 h 时NGAL 水平与AKI显著相关(P<0.001)。 同时手术时长(P= 0.013)和输血量(P=0.029)也是术后 AKI 的独立危险因素。 见表 3。

表3 患者围术期发生急性肾损伤的多因素分析结果
2.4 围术期血清 NGAL 预测 AKI 的价值 ROC 曲线分析显示术前血清NGAL 含量即可预测AKI。 总体来说术后血清NGAL 水平对AKI 具有更高的预测准确性。 术后0 h 时血清NGAL 水平预测AKI 的最佳临界值 57.35 μg/L,敏感性 84.0%,特异性 67.1%,AUC =0.838(95%CI:0.710 ~0.850)。 术后 12 ~48 h血清NGAL 水平对AKI 的预测准确性均较高,但与术后0 h 时血清NGAL 水平的预测能力比较并无统计学差异。 故术后0 h 时NGAL 即可早期预测AKI的发生,且具有较高的诊断准确性。 见表4 及图2。

图2 围术期血清NGAL 水平预测AKI 的ROC 曲线
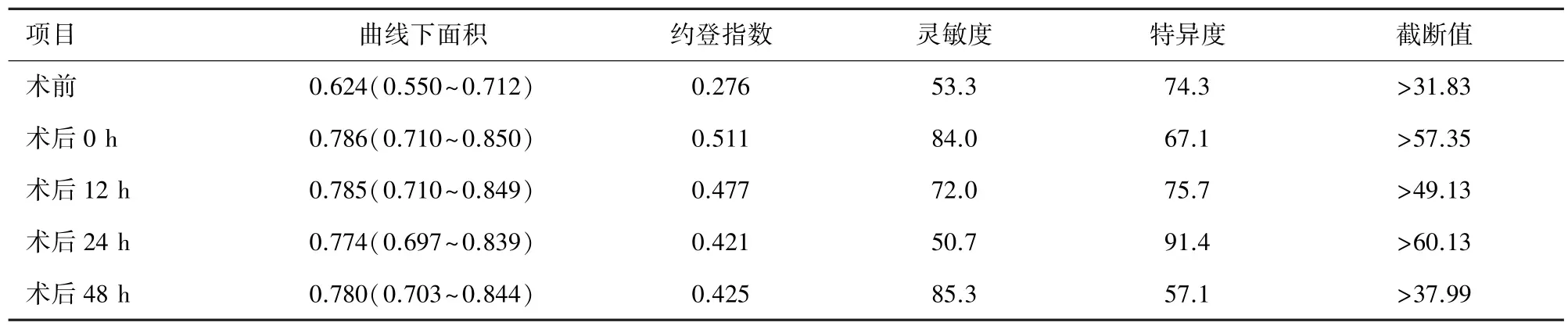
表4 患者围术期血清NGAL 水平预测急性肾损伤发生价值分析
2.5 围术期血清NGAL 的影响因素 单因素分析术后 0 h NGAL 与夹层累及范围(P=0.027)、发病至手术时间(P=0.006)、手术时间(r =0.181,P=0.030)、体外循环时间(r=0.234,P=0.005)、升主动脉阻闭时间(r=0.191,P=0.022)相关。 多重线性回归所得发病至手术时间(P=0.032)、升主动脉阻闭时间(P=0.043)与术后 0 h NGAL 水平独立相关。
2.6 NGAL 与其他炎性因子的相关性 术前及术后24 h 内 NGAL、白介素 6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)的峰值以及其与术前白细胞的相关性见表 5。 NGAL 峰值与 IL-6 峰值、PCT峰值以及术前白细胞相关性均具有统计学意义,且与术前白细胞相关性最强(r=0.376,P<0.001)。

表5 NGAL 与其他炎性因子的相关性
3 讨 论
本研究首次探究了TAAD 全主动脉弓置换围术期血清NGAL 水平作为AKI 早期预测因子的潜在价值,是目前相关研究中病例数较大的前瞻性研究。术前及术后48 h 内的血清NGAL 水平升高均与术后AKI 相关。 术后0 h 时的NGAL 水平具有更高的预测准确性,最佳截断值为 57.35 μg/L。 在术后 AKI的多因素分析中,术后0 h 时的血清NGAL 水平是AKI 的独立危险因素。 血清NGAL 水平有望成为TAAD 主动脉弓置换术后早期预测AKI 的生物标志物。
心脏术后AKI 的病理生理学机制较为复杂且尚不明确,主要包括溶血、炎症反应、血流动力学不稳定、缺血再灌注损伤及围术期肾毒性物质等几个方面。 同时国际急性透析质量指南组织指出大血管手术与普通心脏手术AKI 发生机制不尽相同。 且目前关于大血管术后 AKI 的研究较少[9]。 TAAD 术后AKI 较其他心脏外科手术发生率较高,且长期以来未能得到较好的控制。 故在大血管手术中早期识别AKI 对于降低AKI 发病率并改善患者预后显得尤为重要[4]。
NGAL 是lipocalin 家族的一种25kDa 的蛋白质,已被认为是肾小管损伤的标记物[10]。 研究表明,肾小管细胞在肾脏缺血缺氧、遭受肾毒性物质打击以及脓毒症等情况下,会出现不同程度的细胞极性丧失以及细胞死亡分化等形态和功能变化,在此过程中控制NGAL 表达的基因显著上调,因此在临床场景中 AKI 患者表现出 NGAL 水平的升高[11-12]。 此为NGAL 在AKI 诊断和预后评估中的临床应用的基本病理生理学基础。
NGAL 已在不同的临床场景中成功用于AKI 的诊断和预后[13]。 Rozenfeld 等在 ST 段抬高型心肌梗死患者中发现其可在肌酐升高之前提示肾小管损伤且与不良预后相关[14]。 Giovanni 等的研究说明心脏术后ICU 患者早期检测NGAL 对于AKI 的早期诊疗是有意义的[15]。 Zhou 等的荟萃分析表明,NGAL 对于AKI 具有较高的诊断准确性,并且制定了包含NGAL 的评分来评估心脏CABG 术后发生AKI 的风险[16-17]。 同时还有一些研究评估了 NGAL 在胸腹主动脉夹层及血肿修复中早期诊断AKI 的潜在用途。Benedetta 等进行了一项样本量不大的研究,他们在腔内治疗及手术治疗的患者中均未观察到血清NGAL 和尿 NGAL 与术后 AKI 的相关性[18]。 Alexander 等在同样的人群中发现尽管血清NGAL 不如尿NGAL 敏感,但仍能在早期对AKI 进行良好的预测[19]。 同时 Kokot 等也发现,与血清 NGAL 相比,尿NGAL 水平对AKI 发生概率的预测准确度更高[20]。
尽管有很多研究都表明NGAL 检测在AKI 早期诊断中的作用,但迄今为止,NGAL 检测的临床应用尚未达成明确共识[21-23]。 同时因血液中生物标记物的检测可能包含其他炎症及多器官衰竭的“噪音”[24],故尿中 NGAL 在多个研究中展现出较好的诊断价值。 但临床上尚未常规开展尿液的生物标记物检测,因此对于一些一致性较高的患者在血清中识别合适的肾损伤标志物可能同样是有益的。 故血清NGAL 可能更适合作为AKI 的临床常规诊断生物标志物。
本研究也观察到了术前NGAL 在AKI 和未发生AKI 的患者中的差异,且差异具有统计学意义。 这一差异可能与部分TAAD 患者的术前状态有关。 有研究表明NGAL 水平与IL-6 是相关的,与本文结果一致,可代表患者炎症状态[25]。 同时本文观察到术后NGAL 与夹层发病到手术时间以及升主动脉阻闭时间独立相关,可能代表患者的全身的缺血缺氧及炎症情况。 这也提示虽然术中肾损伤可导致NGAL水平大幅上升,但术前患者的器官灌注情况及全身炎症状态等对于患者肾脏的损伤也不可忽视。
同时此研究存在以下局限性:①本研究为单中心研究,仅代表本中心患者的情况,期待多中心的结果,且本研究37.1%患者为外院转入,缺少本院的完整检查,未能对本群体的器官灌注不良情况进行评估;②本研究未采集患者围术期尿液,未能对尿NGAL 与AKI 的相关性进行评估;③未对患者的肾脏情况进行长期随访,无法对血清NGAL 预测患者肾脏长期预后的结果进行报道。
4 结 论
血清NGAL 可能是TAAD 全主动脉弓置换术后AKI 的早期生物标记物。 术前和术后 48 h 内的NGAL 水平与AKI 的相关性良好。 期待高质量的多中心前瞻性研究对NGAL 与AKI 的相关性进行更加深入的研究。
