基于转录组学的白扁豆总皂苷抑制前列腺癌细胞系PC-3细胞生长的机制研究*
2022-08-20袁强华
袁强华 韩 君
(1)成都中医药大学附属医院药剂科,成都 610072;2)北京康仁堂药业有限公司中药配方颗粒关键技术国家地方联合工程研究中心,北京 101301)
前列腺癌是老年男性泌尿生殖系统常见的恶性肿瘤,在全球男性肿瘤中,发病率和死亡率分别位列第2位和第5位[1]。近年来上市的内分泌治疗药物只能有限改善前列腺癌患者的预后情况,并且长期使用容易出现耐药性。此外,用于前列腺癌治疗的化疗药如多西他赛等,其靶向效率不佳,故现有药物仍有局限性[2]。这些局限性限制了前列腺癌药物长期疗效以及应用。
从天然药物中分离提取化学成分是抗癌药物的来源之一。研究表明,一些中药提取物对前列腺癌具有明显的抗肿瘤效果[3],因此进一步探索能够抑制前列腺癌发生发展的中药成分是有必要的。
白扁豆,属于豆科植物,在全国各地均有栽培。白扁豆的种子能够作为重要的中药原材料,活性成分的前期研究发现其种子含有皂苷[4]。药理以及临床研究均发现,白扁豆总皂苷具有抗菌及增强细胞免疫的作用,小扁豆凝集素能明显抑制肝癌细胞生长[5]。目前关于白扁豆总皂苷在前列腺癌中的作用及其发挥作用的分子机制尚未见报道。
因此,本研究拟利用白扁豆总皂苷处理前列腺癌细胞系,探究白扁豆总皂苷对前列腺癌的作用以及其发挥作用的具体分子机制,力图为前列腺癌的临床干预提供新的治疗手段。
1 材 料
1.1 实验材料
PC-3细胞购自中科院细胞库,白扁豆总皂苷(批号201210)购自成都植标化纯生物技术有限公司,PBS缓冲液(货号B548117-0500)购自生工生物,胎牛血清(货号16000-044)购自Gibco,胰酶(货号C0201)、CCK8检测试剂盒(货号C0038)购自碧云天生物,RIPA细胞裂解液、BCA蛋白浓度检测试剂盒、超敏ECL化学发光试剂盒购自上海碧云天生物公司,兔抗人醛脱氢酶7家族成员A1(ALDH7A1)(货号DF12247)购自Affinity Biosciences公司,兔抗人胱硫醚β合成酶样(CBSL)(货号AP17189PU-N)购自OriGene公司,兔抗人甘氨酸C-乙酰转移酶(GCAT)(货号ab181094)、兔抗人二甲基甘氨酸脱氢酶(DMGDH)(货号ab198292),鼠抗人磷酸甘油酸变位酶家族成员4(PGAM4)(货号ab279384)、β-肌动蛋白抗体(β-actin antibody)(货号ab8226)、辣根过氧化酶标记山羊抗鼠IgG(货号ab6789)、辣根过氧化酶标记山羊抗兔IgG(货号ab136636)购自Abcam公司,DMEM/F12培养基(货号D6421)购自Sigma-Aldrich公司,pcDNA3.1哺乳动物表达载体(货号V79020)、Lipofectamine LTX(货号15338500)购自Invitrogen公司。
1.2 仪器
倒置显微镜(IX70型Olympus公司);酶标仪(MK3 Thermo);实时荧光定量PCR仪(CFX96 Bio-Rad)。
2 方法
2.1 细胞培养
PC-3细胞用含有10%胎牛血清的DMEM/F12培养基,置于37℃、CO2体积分数为5%的饱和湿度培养箱中进行常规培养。
2.2 药物处理
称取白扁豆总皂苷,用二甲基亚砜(DMSO)充分溶解并配制400 g/L母液。用完全培养基将白扁豆总皂苷分别稀释成终浓度为0、15.625、31.25、62.5、125、250、500、1 000、2 000、4 000 mg/L,用DMSO作为对照。
2.3 CCK8检测
取对数生长期的细胞接种于96孔板中,每孔接种5 000个细胞,将96孔板在培养箱中培养过夜。细胞培养过夜后,取出96孔板,吸弃培养基,每个实验组加入含有上述不同浓度药物的培养基继续培养24 h,每组设置3个平行孔。培养基中加入对应体积的DMSO为空白对照组。处理结束后向每孔中加入CCK8溶液(每孔100μl培养基中加入10μl CCK8)。37℃培养箱孵育1 h后,用酶标仪测定450 nm处的吸光度值。
2.4 RNA提取
细胞分成空白对照组和1 086 mg/L白扁豆总皂苷处理组两个组,每组3个平行孔,药物处理24 h后,弃掉细胞培养液。向培养板中每孔加入1 ml TRizol试剂,收集细胞样本。之后向其中加入200μl氯仿,剧烈震荡混匀。离心,收集上层的液体,并向其中加入等体积的异丙醇,充分混匀,使RNA沉淀。离心,弃掉上清,用预冷的75%乙醇洗涤沉淀。最后向离心管中加入适量体积的蒸馏水溶解RNA,并进行浓度测定。
2.5 反转录和实时定量PCR反应
反转录反应根据南京诺唯赞公司的HiScript®III RT SuperMix for qPCR(+gDNA wiper)试剂盒(R323-01)进行,具体步骤按照说明书进行,反转录RNA的量为1μg。反转录结束后,向每管加入180μl TE溶液或者ddH2O将cDNA稀释10倍,并将样本放入-20℃冰箱保存,用于后续实验。实时定量PCR反应参照诺唯赞公司的ChamQ SYBR qPCR Master Mix试剂盒(Q311-02)进行。首先向每管2×ChamQ SYBR qPCR Master Mix中加入50μl ROX Reference Dye II,混合均匀,然后按照表1配制反应体系:

Table 1 RT-PCR reaction system
配制好反应液后,将液体依次加入96孔板中,最后加入cDNA。加样结束后,用膜将96孔板封好,1 200 r/min离心1 min。接着在实时定量PCR仪上进行反应,反应条件参照说明书。每个基因选用特定的引物重复检测3次,基因的表达水平选用β-actin作为内参。采用2-△△Ct法对基因的表达进行相对定量。引物序列如表2。

Table 2 Primers for RT-PCR
2.6 转录组测序及数据处理
按照之前总RNA抽提方法抽提空白对照组和白扁豆总皂苷处理组的RNA,用Qubit Fluorometer和Agilent bioanalyzer 2100对RNA进行质量检测,RIN值大于7.5的RNA样品用于后续的建库。利用NEBNext® Ultra™ RNA Library Prep Kit for Illumina®试剂盒进行建库,建库后的样本采用双端测序(2×150 bp)。利用FastQC软件对测序得到的原始数据进行质控分析,利用HISAT2进行序列比对,参考基因组为hg19。用String Tie和Ballgown软件找到不同处理组之间的差异基因列表。本文选用变化倍数大于2(fold change>2)的差异基因进行后续的数据分析。转录组测序的原始数据已经上传NCBI,序列号为:PRJNA751036。
2.7 细胞总蛋白质抽提
首先收集不同处理组的PC-3细胞样本,并向其中加入适量的RIPA细胞裂解液,冰上裂解细胞30 min。细胞裂解之后,以最高转速4℃离心15 min,将上清液转移至新的EP管中,即为细胞中总蛋白质。之后利用BCA蛋白浓度测定试剂盒检测蛋白质总浓度。测定浓度之后,向蛋白质中加入等体积的上样缓冲液,99℃加热使蛋白质变性,并将样本保存在-20℃冰箱中。
2.8 Western blot
取40μg变性蛋白加到上样孔中,进行SDSPAGE凝胶电泳。电泳结束后,进行转膜,转膜条件为恒流300 mA,时间为1 h。之后将PVDF膜放置在5%脱脂奶粉中室温封闭2 h,分别加入对应的一抗进行孵育(ALDH7A1一抗1∶500稀释,GCAT一抗1∶1 000稀释,PGAM4一抗1∶1 000稀释,DMGDH一抗1∶1 000稀释,CBSL一抗1∶500稀释,β-actin一抗1∶1 000稀释),4℃孵育过夜。第二天先用TBST洗膜3次,每次10 min。再加入1∶2 000稀释的二抗室温孵育2 h,TBST洗膜3次,每次10 min。最后将超敏ECL化学发光试剂滴加到PVDF膜上,进行曝光成像和拍照。蛋白质的表达以β-actin为内参,使用Quantity One软件分析各条带的蛋白质相对表达水平。
2.9 细胞转染
为了构建ALDH7A1过表达质粒,本文将人全长ALDH7A1 cDNA克隆到pcDNA3.1载体中(pc-ALDH7A1)。空载体pcDNA3.1为对照组(pc-NC)。按照厂商提供的说明书,使用Lipofectamine LTX将以上质粒分别转染到PC-3细胞中,细胞转染48 h后收集样本,用于后续的Western blot分析。
2.10 统计分析
本文采用GraphPad Prsim 6.0软件进行统计分析,所有数据表示为平均值±标准差。本文使用t检验对不同组别进行显著性分析。所有数据都进行至少3次独立重复实验。P值小于0.05被认为具有统计学意义。
3 结 果
3.1 白扁豆总皂苷能够抑制前列腺癌细胞系PC-3细胞的生长
本文先用不同浓度的白扁豆总皂苷处理前列腺癌PC-3细胞,CCK8结果显示,当浓度为0~250 mg/L时,白扁豆总皂苷对细胞的生长基本没有影响。但是,当浓度升高为500~4 000 mg/L时,细胞生长受到明显抑制,并且呈浓度依赖性(图1a,b)。进一步结果显示,白扁豆总皂苷的IC50值为1 086 mg/L,因此后续实验本文选用该浓度处理细胞。本文用该浓度处理细胞并收集不同时间点的细胞样本进行检测。RT-PCR结果显示,随着处理时间的延长,促凋亡标志物BAX的mRNA水平显著增加(图1c)。因此,白扁豆总皂苷在体外能够显著抑制前列腺癌细胞的生长。
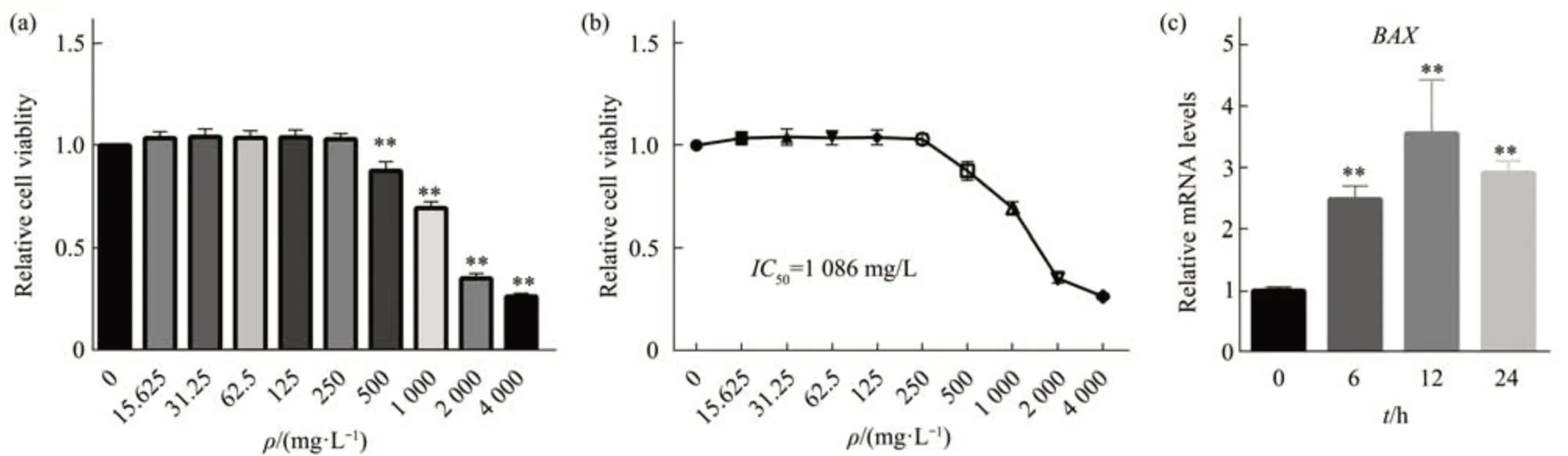
Fig 1 The effect of total saponins of Lablab Semen Album on cell growth
3.2 转录组分析
为了探索白扁豆总皂苷抑制前列腺癌细胞生长的分子机制,本文对空白对照组和浓度为1 086 mg/L的白扁豆总皂苷处理12 h的细胞进行了转录组分析。结果显示,不同组别的基因表达量基本没有差异,分布也是基本一致的(图2a)。差异基因分析结果显示,与对照组相比,白扁豆总皂苷处理的细胞中具有2 360个差异基因,其中1 982个基因上调,378个基因下调(图2b)。
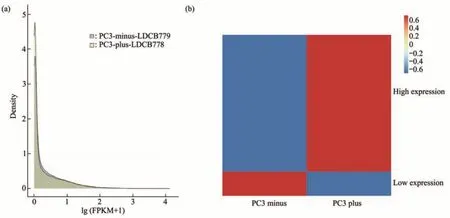
Fig 2 Transcriptome analysis
3.3 差异表达基因功能和通路富集分析
为了探究对照组和给药组的差异表达基因所参与的生物学过程及其功能,本文将变化倍数大于2并且P<0.05的差异基因进行基因组京都百科全书(KEGG)信号通路和基因功能注释(GO)富集分析。KEGG结果显示,差异表达基因富集在很多肿瘤相关通路,例如肿瘤代谢和IL-17相关通路等(图3a)。GO结果显示,差异表达基因显著富集到有丝分裂纺锤体检查点(mitotic spindle checkpoint)、纺锤体组装检查点(spindle assembly checkpoint)等一系列跟癌症的发生发展密切相关的生物学过程(图3b)。并且,这些差异基因主要分布在螺旋体双子(gemini of coiled bodies)等(图3c)。此外,差异表达基因的分子学功能主要跟错配DNA结合(mismatched DNA binding)、金属羧肽酶活性(metallocarboxypeptidase activity)和Toll样受体结合(Toll-like receptor binding)等功能相关(图3d)。
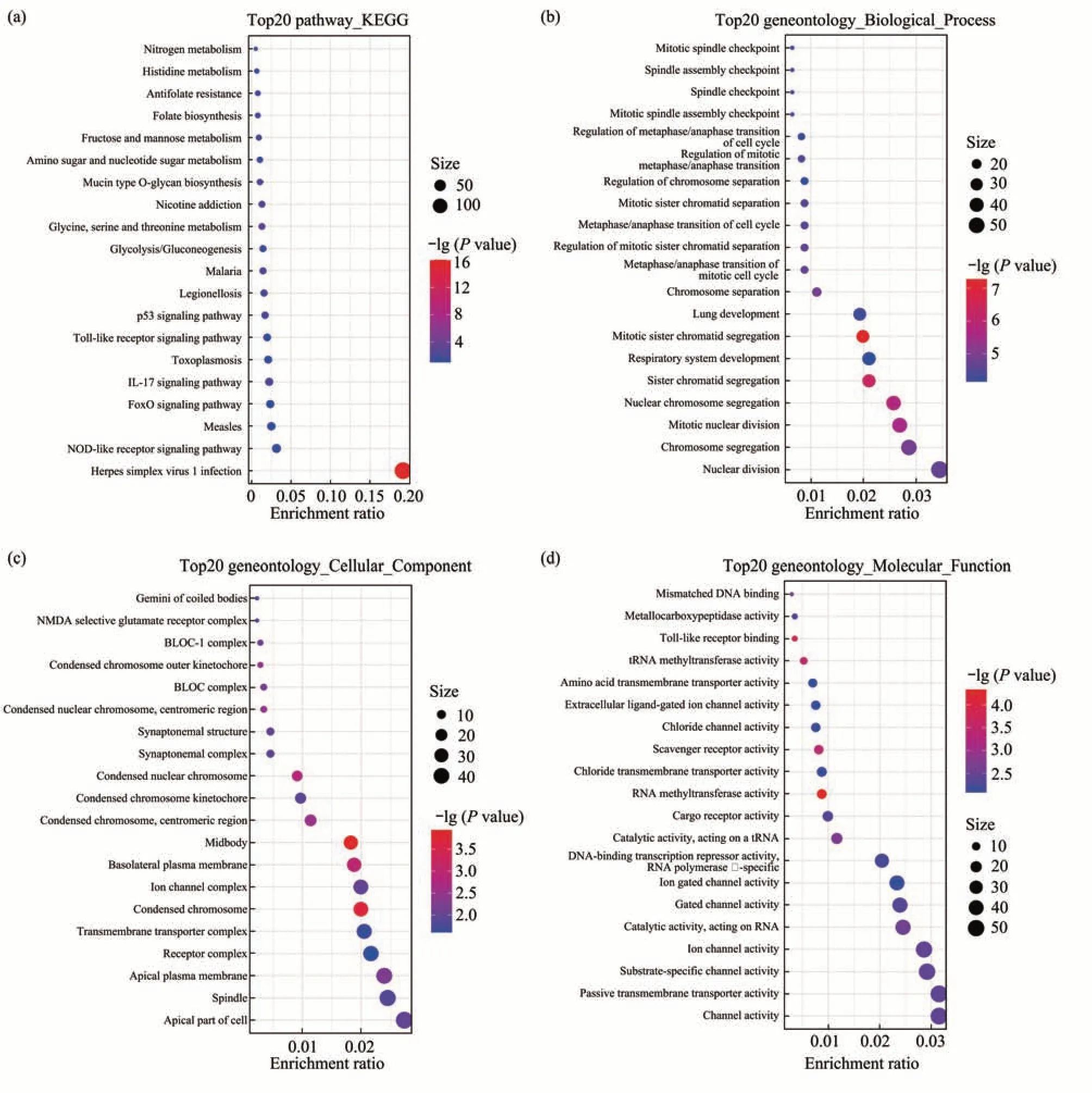
Fig.3 Analysis of pathways and functions enrichment of differentially expressed genes after total saponins of Lablab Semen Album act on prostate cancer cells
对代谢通路中的基因进一步分析,结果发现主要富集的差异基因有ALDH7A1、GCAT、PGAM4、DMGDH、CBSL、肌氨酸脱氢酶(SARDH)和哌可酸和肌氨酸氧化酶(PIPOX)(图4a)。蛋白质互作分析预测结果显示,这7个蛋白质之间存在相互作用(图4b)。
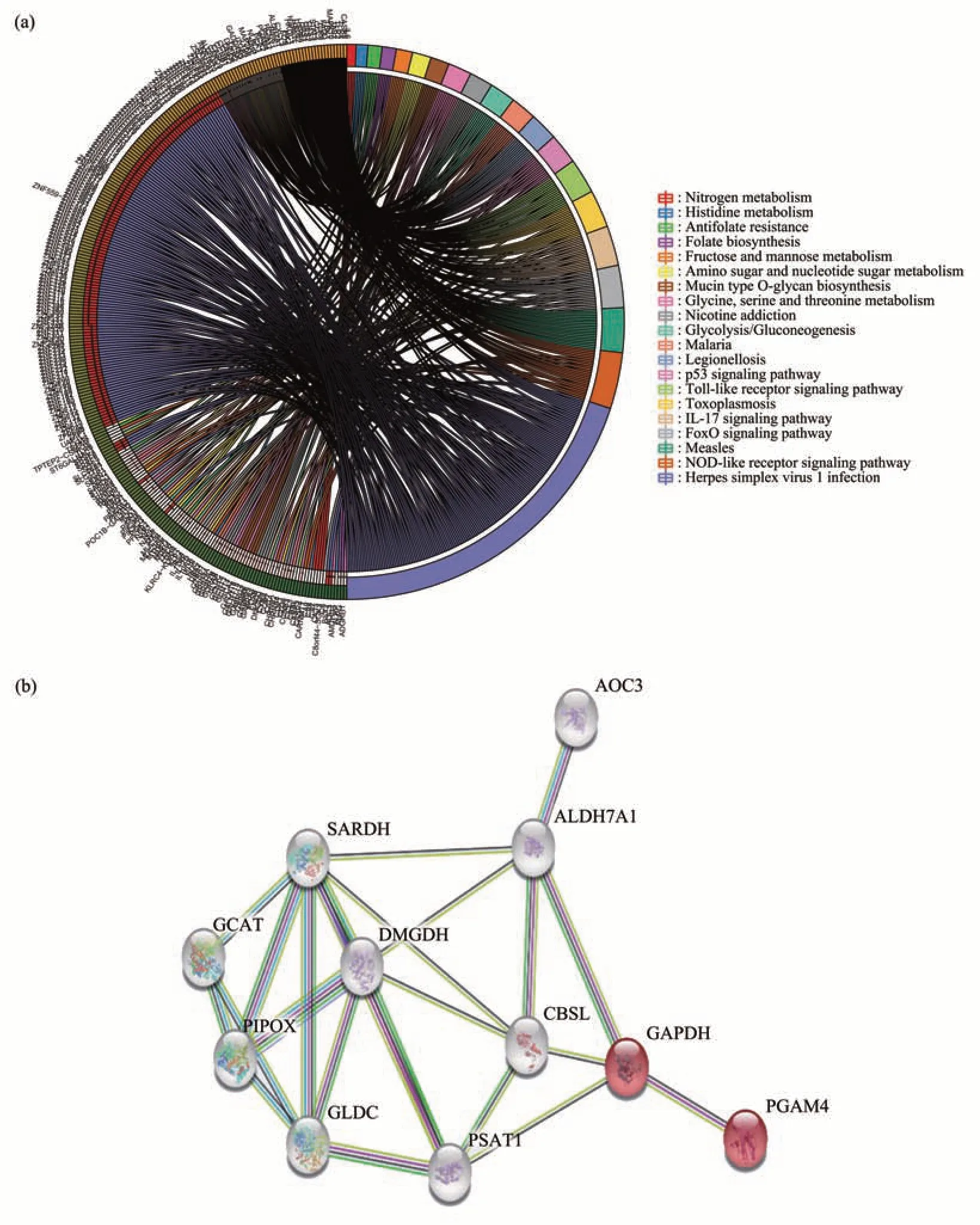
Fig.4 Attribution of pathway genes and analysis of protein interaction
3.4 差异表达基因验证
由于转录组分析的结果存在一定程度的假阳性,因此为进一步证实测序结果,本文先用浓度为1 086 mg/L的白扁豆总皂苷处理PC-3细胞12 h,接着利用实时定量PCR对上述7个基因的表达进行验证。结果显示,在7个基因中有5个基因的mRNA水平与转录组测序结果一致,它们分别是:
ALDH7A1、GCAT、PGAM4、DMGDH、CBSL,而另外两个基因SARDH和PIPOX的mRNA水平在不同组别之间没有显著差异(图5a)。
进一步本文对这5个差异基因的蛋白质水平也进行了检测。结果显示,与对照组相比,浓度为1 086 mg/L白扁豆总皂苷处理的PC-3细胞中ALDH7A1、GCAT和PGAM4的蛋白质表达水平显著降低(P<0.05),而DMGDH和CBSL的蛋白质表达水平显著升高(P<0.001),与之前的RT-PCR验证结果一致(图5b,c)。
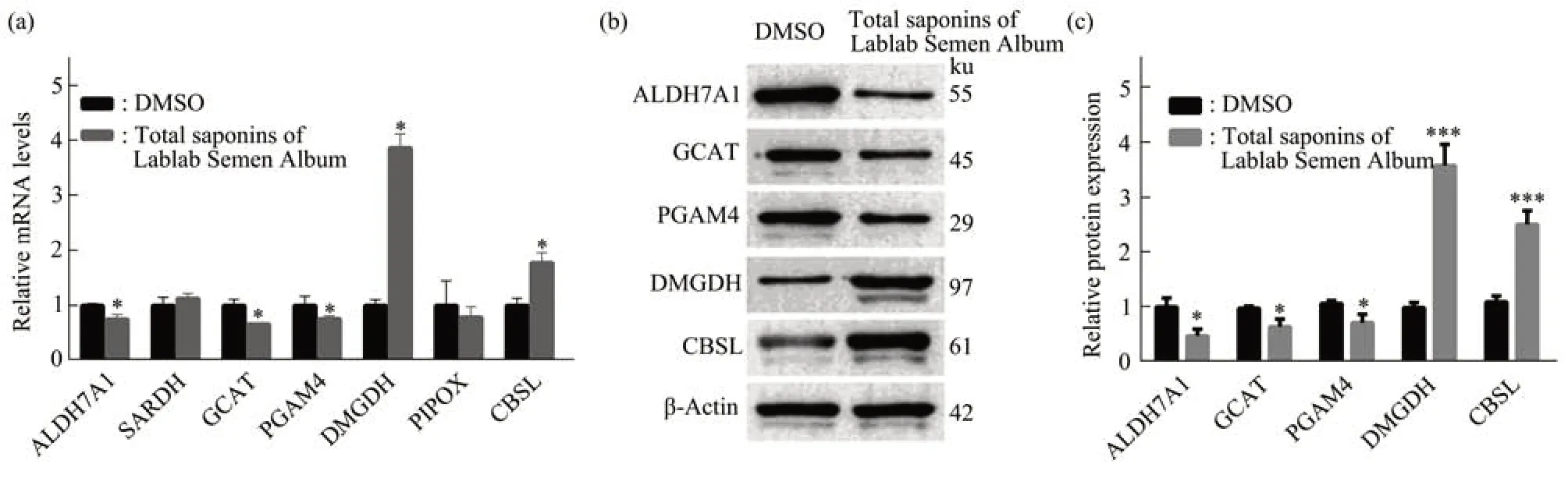
Fig.5 Verification results of differentially expressed genes

Fig.6 Influences of ALDH7A1 overexpression on the role of total saponins of Lablab Semen Album in inhibiting prostate cancer cell proliferation
3.5 ALDH7A1过表达解除了白扁豆总皂苷对前列腺癌细胞系PC-3细胞的抑制作用
白扁豆总皂苷处理的PC-3细胞中ALDH7A1的mRNA和蛋白质表达水平均显著降低。因此,为了进一步探究ALDH7A1是否参与了白扁豆总皂苷对PC-3细胞的生长抑制作用,本文构建了ALDH7A1过表达质粒并将其转染到PC-3细胞,随后用浓度为1 086 mg/L的白扁豆总皂苷处理细胞12 h。Western blot结果表明,ALDH7A1过表达质粒显著增加了PC-3细胞中ALDH7A1的蛋白质表达(P<0.001),并且ALDH7A1过表达显著增加了白扁豆总皂苷处理的PC-3细胞中ALDH7A1蛋白表达(P<0.01,图6a,b)。CCK-8的结果显示,pc-ALDH7A1转染促进了PC-3细胞活力(P<0.001),白扁豆总皂苷处理则显著抑制了PC-3的细胞活力(P<0.001),而进一步转染pc-ALDH7A1后,部分逆转了白扁豆总皂苷对细胞活力的抑制(P<0.01,图6c),以上结果表明,白扁豆总皂苷通过下调ALDH7A1的表达抑制前列腺癌细胞系PC-3细胞生长。
4 讨 论
前期研究表明,白扁豆中含有皂苷类成分,采用四极杆-静电场轨道肼高分辨质谱仪在负离子模式下对白扁豆总皂苷进行成分分析共鉴定出18个化合物,其中多为齐墩果烷型三萜类皂苷。如竹节参皂苷IVa(chikusetsusaponin IVa)、竹节参皂苷V(chikusetsusaponin V)和大豆皂苷I(soyasaponin I)等,且这些皂苷类成分具有广泛的药理活性[6-7]。采用紫外可见分光光度计测定白扁豆总皂苷(以齐墩果酸计)样品中含量结果为52.8%。
虽然之前报道小扁豆凝集素能够抑制肝癌细胞的生长,但关于白扁豆总皂苷在前列腺癌中的作用目前尚无报道。而本研究发现,当白扁豆总皂苷的给药浓度大于500 mg/L时,其能明显抑制前列腺癌细胞系PC-3的生长。并且随着处理时间的延长,白扁豆总皂苷能够促进PC-3细胞中促凋亡蛋白BAX的表达。转录组学分析发现,白扁豆总皂苷处理后引起的差异表达基因主要跟肿瘤代谢相关。通过对转录组数据进行验证,结果发现,与对照组相比,在白扁豆总皂苷处理的细胞中ALDH7A1、GCAT和PGAM4的水平显著降低,而DMGDH和CBSL的水平显著升高。
ALDH7A1作为乙醛脱氢酶,负责将胆碱代谢后的甜菜碱醛代谢成甜菜碱[8]。研究发现,ALDH7A1在胰腺癌病人中高表达,其通过增加耗氧量和促进ATP的产生,从而促进胰腺癌的发生发展[9]。DMGDH是一种线粒体基质黄素蛋白,负责二甲基甘氨酸的去甲基化,形成肌氨酸[10]。据报道,DMGDH在肝癌病人中显著下调,其通过影响Akt信号通路的活化,从而促进肝癌细胞的转移[11]。PGAM4作为磷酸甘油酸变位酶(PGAM)的家族成员,是糖酵解和葡萄糖异生通路中的一种重要酶。PGAM4可以催化3-磷酸甘油酸盐(3-PGA)转化为2-磷酸甘油酸盐(2-PGA)。在肿瘤细胞中,PGAM可调节糖酵解与其他ATP产生通路以及糖异生之间的平衡[12]。目前,对于GCAT和CBSL两个基因在肿瘤中的作用尚未报道。此外,本研究还发现DMGDH的互作蛋白支架蛋白4A(Cullin4A,CUL4A),CUL4A已经被报道能够促进肿瘤的生长[13],暗示DMGDH可能与CUL4A相互作用介导白扁豆总皂苷对前列腺癌生长的抑制作用。
本研究发现,白扁豆总皂苷可以抑制前列腺癌细胞系PC-3细胞的生长。进一步的体外细胞实验结果表明,白扁豆总皂苷通过下调ALDH7A1的表达从而抑制PC-3细胞生长。而之前的文献报道ALDH7A1通过影响肿瘤代谢参与癌症的发生发展,但是在前列腺癌中其是否具有相同的作用并不清楚。因此,接下来将继续探究白扁豆总皂苷是否通过影响肿瘤代谢抑制PC-3细胞的生长。
5 结 论
本研究发现白扁豆总皂苷可以抑制前列腺癌细胞系PC-3细胞的生长。并且,白扁豆总皂苷可能通过影响肿瘤细胞的代谢过程发挥抑癌作用。体外细胞实验结果表明,白扁豆总皂苷下调前列腺癌细胞中ALDH7A1的表达可能与其抑制前列腺癌细胞增殖作用相关。本研究的发现为前列腺癌的临床干预提供了新的治疗手段和见解。
