微管蛋白亲和力调节激酶4作为药物靶点的研究进展*
2022-08-20叶和杨尹秀山
周 箭 叶和杨 尹秀山 李 健**
(1)赣南医学院药学院,赣州 341000;2)沈阳化工大学制药与生物工程学院,沈阳 110142)
微管蛋白亲和力调节激酶(microtubule affinity-regulating kinase,MARK)家族包含4个家族成员MARK1、MARK2、MARK3和MARK4,它们的基因分别位于人类基因组的1、11、14和19号染色体上[1]。MARK家族成员之间在氨基酸序列上有大约45%的同源性,并且MARKs的氨基酸序列与腺苷单磷酸活化蛋白激酶(adenosinemonophosphate activated protein kinase,AMPK)家族其他成员具有很高的同源性,并具有相似的三维结构,因此MARKs也被认为是钙/钙调素依赖性蛋白激酶 (calcium/calmodulin-dependent protein kinase,CAMPK)家族中AMPK亚家族的成员[2]。MARK4是一种丝氨酸/苏氨酸激酶,几乎在人体的每个器官都有表达,主要表达于脑和睾丸,其次是肝和肺等重要器官[3]。MARK4有MARK4S和MARK4L两种亚型,其中MARK4L在睾丸、大脑、肾脏、肝脏和肺中高表达,而MARK4S在睾丸、心脏和大脑中表达较高[3-4]。另外,MAKR4的两个亚型在神经元中也有表达。MARK4最早是在阿尔茨海默病(Alzheimer’s disease,AD)中被发现,并被作为治疗AD的一个重要靶点,随后又发现MARK4与癌症和代谢紊乱密切相关[4]。最新的一项研究发现,MARK4有望成为心衰心梗的一个治疗靶点,MARK4参与众多疾病的发生、发展,因此靶向MARK4研发有效的小分子抑制剂,从而抑制其活性进行疾病的治疗成为一种行之有效的方案,使其成为极具潜力的创新药物研发靶点。本文综述了MARK4的三维结构、功能、MARK4与疾病之间的关系以及MARK4小分子抑制剂的研究进展。
1 MARK4的结构
MARK4的基因全长53 992 bp,位于人19号染色体的q13.32位置上,该基因还存在一个假基因,存在于3号染色体的长臂和短臂上[1]。MARK4包含6个保守区域[1,5]:a.功能未知的N端;b.催化结构域,包括活化环,分为催化环和p环(磷酸结合环),是一个易发生突变的结构域;c.1个负电荷基序连接区;d.1个UBA(ubiquitin-associated)结构域,是一个泛素相关结构域,可能发挥着自动调节器的作用;e.可变的区域,又称为间隔区,对调节MARK4活性至关重要;f.C端尾部含有激酶相关结构域,可能具有自抑制功能。MARK4与家族其他成员不同的是,MARK4有MARK4S和MARK4L两种亚型,MARK4S编码688个氨基酸,MARK4L编码752个氨基酸,MARK4L的激酶结构域序列与其他成员相同,但MARK4S中的激酶结构域与其他成员同源性较低[1,5]。MARK4的丝氨酸/苏氨酸激酶催化域位于59~314位氨基酸残基,随后是膜靶向基序(T区),氨基酸314~322残基,然后是泛素相关结构域(氨基酸序列322~369),激酶结构域位于尾部(氨基酸序列649~752)(图1),目前MARK4的催化中心和UBA结构域的晶体结构已经解析(PDB ID:5ES1,图2)[1,6-7]。
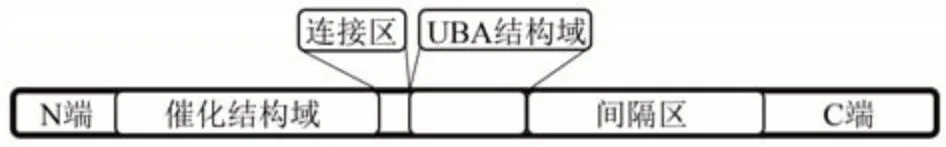
Fig.1 The topology of MARK4图1 MARK4L的拓扑结构

Fig.2 Crystal structure of MARK4-inhbitor complex图2 MARK4-抑制剂的复合物晶体结构
MARK4的尾部保守性最低[4,8],核心与其他激酶一样折叠成双叶结构[5,9]。MARK4的UBA域与家族其他成员相比较小,呈球状,由3个短的α螺旋(α1、α2、α3)组成[10-11],N端由5条β链和单个α螺旋组成,而C端主要由α螺旋和1个扩展环组成,它们之间有一个裂隙,是核苷酸结合的位置即活性位点[5]。MARK4的主要激活机制是通过LKB1(liver kinase B1)在T环磷酸化214位的苏氨酸,也被称为活化环,活化环作为激活片段的一部分,从保守的DFG基序开始,到磷酸化位点苏氨酸214结束[12]。研究表明,在激酶的非活性构象转变为活性构象的过程中,有两个主要的障碍:a.α螺旋的旋转;b.β链上赖氨酸和α螺旋的谷氨酸之间形成保守的盐桥和T环拉伸,在此过程中会形成几种稳定的构象,这些中间状态采用扩展的构象,这使得MARK4很容易被LKB1磷酸化[5]。
2 MARK4的生物学功能
MARK4在真核细胞内定位于细胞核附近并与内质网相关联,在原核生物中定位于中间体[13]。当MARK4被磷酸化激活时,它与中心体和中间体的微管共定位,MARK4通过与ATP结合催化蛋白质的磷酸化,导致微管重组为束[13]。ATP结合于MARK4的激酶催化结构域,使底物蛋白被磷酸化(图3)。MARK4的催化结构域与C端结构域、连接区以及UBA结构域形成双球状结构,使底物和ATP发生解离,水解下来的磷酸基团与微管蛋白上的丝氨酸或者苏氨酸残基结合从而使得蛋白质被磷酸化[3,14]。MARK4在细胞内与许多信号通路相关,例 如NF-κB、mTOR、Wnt和Akt等[15]。MARK4与组织发育相关,是纤毛发生早期步骤的关键正调节因子,并且是纤毛囊泡与母中心粒蛋白对接后开始的轴丝延伸过程中所必需的[16]。MARK4在细胞分裂早期磷酸化外层致密纤维蛋白2(outer dense fiber protein 2,ODF2),使得ODF2向中心体聚集,影响细胞分裂早期的进程[16]。MARK4还可以磷酸化哺乳动物雷帕霉素靶点复合物(mammalian target of rapamycin complex 1,mTORC1)成 员RPTOR(regulatory-associated protein of mTOR),是mTORC1复合物的负调节因子[17]。MARK4在细胞内吞过程中调控囊泡(clathrin-coated vesicle,CCV)的功能,MARK4的Thr214和Ser218位点被磷酸化从而执行其功能,当MARK4的Thr214位点被磷酸化时,催化功能被激活,当Ser218位点被磷酸化时,活性被抑制[18]。MARK4的UBA结构域介导了与泛素的相互作用[19],泛素低聚物与UBA结构域的结合可能使该结构域与催化结构域分离,从而使MARK4激酶活性增强[8]。MARK4在细胞分裂的整个周期中都有表达,并在有丝分裂期间被优先激活,在生物体内发挥了促进细胞分裂,调控细胞周期的重要作用[13]。
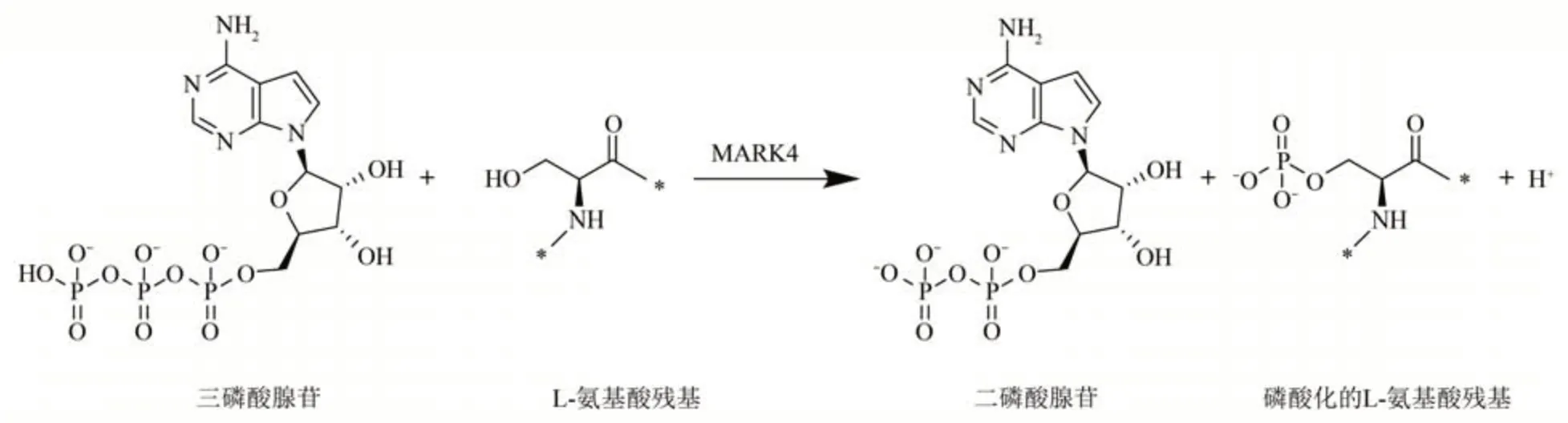
Fig.3 Phosphorylation of protein catalyzed by MARK4图3 MARK4催化的蛋白质磷酸化过程
3 MARK4与疾病的联系
MARK4的过表达影响神经元迁移、细胞极性、微管动力学、细胞凋亡、细胞周期调节、细胞信号传导和分化等,从而与多种人类重大疾病的发生密切相关。
MARK4在脑卒中损伤后皮质下的第5层皮质神经元表达升高,因此作为轴突损伤的一个特征标志[20]。脑卒中患者的MARK4上调与卒中后根尖树突的选择性重塑和体内tau蛋白的磷酸化密切相关,深层皮层神经元缺血性轴突损伤后,MARK4的表达升高导致的tau磷酸化和聚集,为轴突和神经退行性疾病之间的协同作用提供了新的证据[20-21]。MARK4在AD患者的大脑中高表达[22],MARK4在微管结合重复序列Ser262和Ser356磷酸化天然未折叠的tau蛋白,而微管结合蛋白tau的过度磷酸化导致tau蛋白的在神经元纤维上聚集是AD和其他神经退行性疾病的重要病理标志[23]。研究表明,MARK4能在体外磷酸化tau蛋白并且促进tau蛋白的聚集[20],MARK4的双突变体MARK4ΔG316E317D与早发型AD风险升高有关[24],当tau与突变体MARK4共表达时,Ser262位点的tau磷酸化水平比tau与正常的MARK4共表达时更高,表明该突变通过促进tau蛋白的异常磷酸化而增加了AD的风险[25]。
MARK4可能调控细胞程序性死亡,促进细胞级联死亡,其过表达导致细胞活力下降[18]。衰老是AD发生的重要因素,同时身体的衰老会减慢代谢,引发肥胖等代谢性疾病。另一方面,这些代谢性疾病也会进一步加重AD患者的病情[26]。研究表明,MARK4可以调控葡萄糖代谢,MARK4缺乏小鼠会导致嗜食、过度活跃和代谢率升高,通过上调棕色脂肪的活性来保护小鼠免受饮食诱导的肥胖及其相关代谢并发症的影响[27]。MARK4缺乏通过显著增强主要代谢组织中胰岛素刺激的AKT磷酸化,减轻了与饮食诱导的肥胖相关的胰岛素抵抗[27]。研究发现,在3T3-L1脂肪细胞内的MARK4能显著促进基因甾醇调节元件结合蛋白1c(sterol regulatory element binding protein-1c,SREBP-1c)、脂 肪 酸 合 酶(fatty acid synthase,FAS)、乙酰辅酶A羧化酶α(acetyl-coa carboxylase-α,ACCα)和过氧化物酶体增殖物激活 受 体 γ(peroxisome proliferators activate receptors-γ,PPARγ)的表达,并降低了脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)的蛋白质含量,作用机制为通过激活c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1,JNK1)和抑制p38 MAPK通路促进3T3-L1脂肪细胞的脂肪生成,进而触发脂肪细胞凋亡[28]。MARK4的过表达增加了自噬相关因子Beclin1和自噬相关蛋白7抗体的表达,降低了自噬底物核孔糖蛋白P62抗体,MARK4通过促进自噬降低产热基因的表达,并通过促进自噬抑制了白色脂肪组织的褐变,其作用机制是通过激活AMP活化蛋白激酶通路和抑制AKT/mTOR信号传导,促进自噬标记蛋白LC3A向LC3B-II的转化[29],这表明MARK4与白色脂肪细胞的自噬-褐变密切联系。研究表明,高脂肪饮食(high fat diet,HFD)会诱导细胞内MARK4表达,而MARK4在白色脂肪细胞中表达升高会干扰线粒体氧化呼吸过程并增加活性氧(reactive oxygen species,ROS)的产生,并且大幅提升超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的活性,还加剧了H2O2诱导的氧化应激[30-31]。
人类动脉粥样硬化病变的巨噬细胞中可以检测到MARK4的表达升高,同时还能检测到炎症小体
NLRP3(nucleotide-binding oligomerization domainlike receptor family pyrin domain-containing-3的表达升高,MARK4和NLRP3在动脉粥样硬化病变中的表达与活性白介素(IL)-1β以及IL-18的产生有关[32]。研究表明,骨髓源巨噬细胞中的MARK4缺陷阻止了NLRP3炎性体激活,造血细胞中MARK4依赖性的NLRP3炎症小体激活后能调节动脉粥样硬化的发展[32]。当MARK4沉默或敲除,或破坏MARK4-NLRP3相互作用后,会打乱NLRP3在细胞内的分布并限制炎症小体激活[32]。研究发现,在炎性体家族的各种NLR成员中,MARK4选择性地与NLRP3相互作用并促进其向线粒体的聚集,MARK4驱动NLRP3传递到微管组织中心,从而允许NLRP3以微管依赖的方式定位到特征斑点结构[31]。此外,MARK4的缺失或NLRP3和MARK4之间相互作用的中断都会改变NLRP3炎症小体的激活[31]。这说明MARK4在促进NLRP3基于微管的运输方面发挥着重要作用。
MARK4在乳腺癌中起重要调控作用,MARK4作为Hippo通路的负调节因子激活转录因子 YAP (Yes-associated protein) 和 TAZ(transcriptional coactivator with PDZ-binding motif),MARK4的缺失抑制了乳腺癌细胞的致瘤特性即抑制细胞增殖和细胞迁移能力,研究表明,Hippo通路调节的异常会导致癌症[33]。乳腺癌细胞中的MARK4缺失导致细胞核内YAP/TAZ丢失并抑制YAP/TAZ靶基因的激活。MARK4与Hippo通路的核心组件MST(mammalian sterile20-like kinase)1/2和相关的调控蛋白SAV结合,随后将两者磷酸化,MARK4对MST1/2和SAV(Salvador)的磷酸化导致MST/SAV与其下游靶标LATS激酶之间复合物形成的破坏(图4a),从而使得Hippo通路异常,进一步引发癌症[34]。

Fig.4 Effect of MARK4 on Hippo pathway(a)and MARK4 on heart failure myocardial infarction model(b)图4 MARK4参与Hippo通路(a)与MARK4对心衰心梗模型的作用机制(b)
MARK4通过调节微管的磷酸化来调节衰竭心肌细胞的功能,作用机制是MARK4通过催化KXGS基序上MAP4的磷酸化来调节心肌细胞的收缩力,而磷酸化后的MAP4促进微管蛋白羧肽酶VASH2(vasohibin2)与小型VASH2结合蛋白SVBP(small vasohibin-binding protein,SVBP)聚合后进入微管,导致α微管蛋白的去酪氨酸化,最终使得心肌细胞收缩功能下降(图4b)[35]。MARK4敲除实验表明,MARK4的缺失减慢了急性心肌梗死后左心室射血效率的下降速度[35]。
综上所述,MARK4在AD、代谢相关疾病、心肌梗塞、动脉粥样硬化和心血管并发症等多种疾病的发生、发展中起着重要的作用,是治疗这些重大疾病极具潜力的药物靶点。
4 MARK4抑制剂
目前研发的MARK4抑制剂主要分为两类,分别是天然植物中提取的化合物和基于MARK4的活性中心设计的小分子[36]。唇形科(薄荷)科植物中提取的天然化合物迷迭香酸(rosmarinic acid,RA)(图5a)[15]可以抑制MARK4活性(IC50=6.204µmol/L),通过抑制tau等微管结合蛋白的磷酸化控制细胞生长并诱导细胞凋亡。天然化合物α芒果素(图5b)是MARK4的潜在抑制剂,分子对接和分子动力学模拟表明α芒果素的结合稳定了MARK4的结构[37],亚微摩尔范围内抑制MARK4(IC50=1.47μmol/L)的活性,结合常数Ka为5.2×107M-1。从柠檬草的精油中提取的柠檬醛可以与MARK4蛋白的活性位点结合[38],体外实验研究表明柠檬醛(图5c)可以抑制MARK4的酶活性(IC50=172μmol/L)从而抑制乳腺癌细胞的增殖。MARK4还能通过增加微管动力学赋予肝癌细胞(hepatoma carcinoma cell,HCC)紫杉醇抗性,表明MARK4是克服紫杉醇抗性的一个潜在性靶点[39]。香豆素对MARK4有抑制作用,通过以香豆素为母核得到的香豆素衍生物(图5d)能在体外与MARK4的催化结构域结合并抑制MARK4的活性(IC50=1.301μmol/L),以MARK4依赖的方式抑制细胞活力并使得HCC对紫杉醇敏感最终诱导HCC细胞凋亡[39]。这种联合使用中药对抗治疗肝癌的方式给肝癌患者的治疗带来了新的希望。
基于蛋白质结构的小分子抑制剂研发应同时兼顾细胞扩散的容易程度、膜渗透性、运输、生物利用度、结合亲和力和与小环杂环基序相关的效力等药理学特性,并且易于优化和筛选,被广泛应用于药物开发[40]。目前基于MARK4结构的小分子抑制剂主要是以芳醛肟、吡唑并嘧啶和N-取代吖啶酮为母核设计的。小分子芳醛肟/5-硝基咪唑杂化物作为MARK4强效抑制剂的设计和开发将成为一种前景光明的靶向癌症治疗方法[41]。芳醛肟衍生的小分子可靶向结合MARK4,同时具有细胞自由基清除特性和有效的生物利用度。此外,芳醛肟/5-硝基咪唑杂化物(图5e)的发现提出一种合理的构效关系,该小分子有一个疏水片段、芳香化合物片段以及与MARK4活性残基Asp196相互作用的肟中心(IC50=1.47μmol/L)[41]。芳基醛肟/5-硝基咪唑杂化物可作为设计新颖候选药物的先导分子,为进一步的抑制剂的设计和优化提供基础。
晶体三维结构表明,MARK4与小分子抑制剂(图5f)形成复合物(图2),小分子抑制剂占据了ATP结合位点,吡唑嘧啶基团与铰链区相互作用(IC50=4.6 nmol/L),而氨基环己烷基团与催化环和DFG基序相互作用,使激活环脱离ATP结合口袋[6]。N-取代吖啶酮衍生物(图5g)也与MARK4催化结构域结合[36],IC50为1.8μmol/L。近几年以靛红-三唑腙和3-N-芳基取代-2-杂芳基酮为母核设计出了新的MARK4抑制剂[42],其中以靛红-三唑腙为母核优化的MARK4抑制剂(图5h)IC50为1.54μmol/L[43]。小分子PCC0208017(图5i)是MARK3和MARK4的双重抑制剂(IC50分别1.8 nmol/L和2.01 nmol/L),PCC0208017可以破坏细胞内微管动力学并诱导G2/M期细胞周期停滞和细胞凋亡,体内实验表明PCC0208017能显著抑制胶质瘤细胞的生长、迁移和侵袭,抑制血管生成[42]。重要的是,PCC0208017显示出强大的体内抗肿瘤活性,并显示出良好的药代动力学特征和血脑屏障通透性。除此之外,临床上用于抑制AChE活性的药物多奈哌齐和酒石酸卡巴拉汀也能抑制MARK4的活性(IC50分别为5.3μmol/L和6.74μmol/L),临床上已经被批准用于治疗有症状的轻度至中度AD患者[44]。因此,以多奈哌齐和酒石酸卡巴拉汀的分子骨架为母核设计对MARK4具有高结合亲和力和选择性的新型小分子抑制剂,为MARK4为靶点的抑制剂发现提供了一个新颖的设计思路。

Fig.5 Molecular structure of MARK4 inhibitors图5 MARK4抑制剂的分子结构
5 展 望
人类在克服神经退行性疾病、癌症、心衰心梗等疾病道路上从未停止探索,MARK4的深入研究给予了以上人类重大疾病患者新的治疗希望。目前研究已经证实,MARK4与退行性疾病、癌症、心衰心梗等疾病的发生、发展密切相关,抑制MARK4的功能或者敲除MARK4都可以不同程度地改善上述疾病,MARK4是极具潜力的创新药物研究靶点,可以通过发现并设计、优化小分子抑制剂来调节其活性,用于疾病的治疗,因此近几年对MARK4作为药靶的关注度不断升高。MARK4的研究为与此相关疾病的药物发现提供了坚实的基础,这些研究将有助于加深人们对MARK4相关疾病的认知和以此为靶点的药物研发,更好地解决靶向选择性、细胞疗效、治疗效果和耐受性等问题,为治疗MARK4相关疾病开辟一条有前景的新道路。
