皮肤模型与微针穿刺性能评价的研究*
2022-08-20马凤森王延妮修雪亮宋伟民胡夏夏
王 缘 马凤森** 王延妮 修雪亮 刘 勇 宋伟民 胡夏夏
(1)浙江工业大学药学院生物制剂与材料实验室,杭州 310014;2)杭州颜术新芽医疗美容诊所,杭州 310015;3)浙江工业大学机械工程学院,杭州 310023)
微针(microneedle,MN)是一种高效、安全、新型的经皮给药技术,克服了很多传统透皮给药系统的缺点。微针阵列(microneedle array)是由附着在背衬层上的多个微米级针头组成的阵列,以无痛方式有效地将药物递送到皮肤中。微针刺穿角质层产生微孔洞,但不会损伤表皮和真皮内层中的神经末梢和血管,从而不会导致出血和疼痛[1-3]。在过去十几年中,由于微针起效快、可自我给药、疗效好等优势,常用于增强生物活性分子的透皮递送,如治疗性肽[4-5]、蛋白质[6]、激素[7-8]、多糖[9]、DNA[10]、小分子[11]等,在疾病治 疗[12-13]、预 防[14-15]、诊 断[16-17]、药 物 辅 助 递送[18]、医美行业[19-20]等方面有广泛应用。
微针透皮给药技术虽然应用研究和市场需求非常广泛,但该技术的大规模产业化仍存在一定的困难,其中,缺少一套评价产品质量的通用标准是微针商业化过程中的主要障碍之一。目前研究微针穿刺性能的评价方法较多使用真实皮肤模型,但因人体皮肤获取困难,多选择与人体皮肤相类似的动物皮肤,例如鼠、兔、猪等。而生物组织的均一性一直是行业面临的大难题,不同种属动物、不同部位的皮肤及其获取方式、保存状态(即新鲜、冷藏、冷冻或浸入溶液中)以及外部因素(如相对湿度和温度)等都会影响皮肤的性能,导致实验结果重现性差[21]。模拟皮肤与真实皮肤虽有差异(表1)[22-24],但更符合伦理要求,从微针商业化角度来看,不失为建立评价标准的可取路径。因此,本文对真实皮肤的物理特性、皮肤模型的分类、制备和特点,以及真实皮肤和皮肤模型在评价微针穿刺性能方面的应用进行系统的归纳、总结,为构建更为合适的用于微针穿刺性能评价的皮肤模型提供参考。

Table 1 The merits and demerits of real skin and skin models表1 真实皮肤和皮肤模型的优缺点
1 皮肤的物理特性
成熟的微针产品通常需要经过精心的阵列设计、反复的微针材料处方筛选以及成型工艺试验等,使其具有足够的机械强度能完全刺入皮肤且不会造成微针断裂或弯曲。只有完全刺入皮内,微针所承载的药物才能按照设计要求定量进入体内发挥作用。因此,评价其穿刺性能显得尤为重要。微针刺入皮肤的过程与皮肤结构及其力学特征密切相关,对皮肤力学特性的解析,有助于探索建立与真实皮肤性能相近的皮肤模型,以利于解决微针产品质量评价的标准化难题。
1.1 与力学特性主要相关的皮肤结构与成分
人皮肤主要分为表皮层、真皮层及皮下组织(图1a),每层具有不同的成分和厚度以及对应力的可变机械响应[25-26]。由于皮肤作为一个整体组织,各皮层相互间存在着密切的联系,很难阐述单一皮层的具体机械行为。因此,可通过阐明与力学性能主要相关的皮肤结构与成分来分析和判断微针刺入皮肤组织的力学障碍。

Fig.1 Schematic diagram of skin structure and electron micrographs of its main components图1 皮肤结构示意图及其主要成分的电镜图
1.1.1角蛋白丝
表皮的最外层即角质层,充满密集平行的角蛋白丝(keratin filament)(图1b[27]),呈现致密的砖墙结构(图1a),保证皮肤的致密性和硬度。皮肤的角蛋白(keratin)由4个右旋α螺旋组成,形成1个左旋超螺旋、直径约2 nm的原纤维(protofibril),4个原纤维聚合形成角蛋白丝[28]。α角蛋白是表皮主要的结构蛋白,非常坚硬[29],具有黏性和弹性,杨氏模量大于胶原蛋白。角质层是微针穿刺遇到的首要障碍(图1a),也是人工皮肤模型需要重点模拟的对象。
1.1.2胶原纤维
胶原蛋白(collagen)是真皮中的主要结构蛋白,形成原纤维的胶原蛋白负责组织的机械强度,其抗拉强度是钢的1/4[30]。胶原蛋白的特征是高刚度(线性区域的杨氏模量约为0.1~1 GPa)和低延展性(断裂时应变约为5%~6%)[31]。胶原纤维(collagen fibers)由紧密排列的胶原蛋白原纤维组成,呈1~20μm宽的珊瑚带状,在组织中呈波浪状(图1c[32]),表现出分裂和连接,形成一个整体的三维网络[32-33]。胶原纤维占真皮干重的70%,具有较高的抗拉强度[34]。
1.1.3弹性纤维
弹性蛋白(elastin)是所有弹性组织和器官的重要组成部分,由0.1~0.2μm的弹性蛋白颗粒组成。弹性纤维(elastic fibers)是由直径为10~12 nm的微原纤维和弹性蛋白组成(图1d[35]),是真皮的第二大主要成分(占干重的4%),硬度比胶原蛋白低,可逆应变,能在外力的作用下恢复正常的纤维排列[36]。
真皮成纤维细胞将胶原蛋白和弹性蛋白沉积到其细胞外空间,在凝胶状基质中形成胶原纤维和弹性纤维的网状结构[34]。在真皮内,机械应力主要通过胶原纤维和弹性纤维消散[37],因此真皮层的力学性能也是设计皮肤模型的重点之一。
1.1.4皮下组织
皮下组织(hypodermis)由疏松结缔组织和脂肪组织构成,处于真皮与肌肉、骨骼之间,为皮肤提供缓冲、保护的作用。皮下组织在皮肤受到负荷时,承担负荷转移的责任,会发生更多的形变[38],进而会影响微针穿刺的效果,皮下组织也是微针穿刺皮肤时必需的支撑物,设计皮肤模型也需考虑类似脂肪、肌肉、骨骼等的支撑功能。
1.2 微针穿刺皮肤的力学分析
微针针长一般在1 mm以下,使其刺入皮肤或类似组织的力学行为研究存在困难,迄今系统研究微针刺入皮肤过程的力学行为的报道尚属鲜见。而普通钢针(其长度和直径远大于微针的)穿刺皮肤的力学分析可以提供借鉴。Ma等[39]详细综述了Simone和Okamura[40]关于针刺牛肝组织的研究,指出针受到的力为组织的刚度力、摩擦力以及针切割内部组织所需力的总和,将针刺过程分为3个阶段:接触时、刺入瞬间和刺入皮肤后。Kataoka等[41]在其基础上将1.15 mm直径的普通钢针刺入狗前列腺组织,使用测压元件独立量化了针的尖端力和摩擦力,进一步分析了针刺入组织的受力情况(图2)。
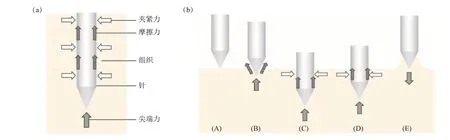
Fig.2 The force associated with the needle tissue is related to the needle-stabbing process图2 针刺组织的相关力与针刺过程
针受到3种力的作用(图2a):轴向作用于针尖上的尖端力、轴侧壁上的轴向摩擦力和轴侧壁上的法向夹紧力[41]。当针刺入组织时,尖端力与切割力有关,其大小受针尖形状的影响;摩擦力主要受库仑摩擦力和黏性摩擦的影响;法向力是确定的总夹紧力,且其大小在针刺过程中随针与组织之间接触面积的增加而增加。夹紧力是指从针道挤压出来的组织所受到的阻力,它受针尖在组织中所形成的切口形状以及针距的影响。针的总轴向力是尖端力和摩擦力的总和。
针刺过程可细化为5个阶段[41](图2b):(A)针尖未接触组织;(B)尖端接触组织后,总轴向力呈指数增加,到达第一个峰值,此时尖端力也到达第一个峰值,但摩擦力低,显示了组织表面刺穿的过程,针尖只是挤压表面还未刺入到组织内;(C)总轴向力略微下降后再次增加,直到针刺停止,在此时期,尖端力在开始时随之下降并保持不变,摩擦力则随着时间而增加,表明切割组织所需的力小于穿刺组织表面所需的力,摩擦力在恒速移动下可反映刺入深度;(D)为(C)结束到针开始上拉的阶段,由于组织的黏度,其间所有的力都呈指数级下降,尖端力保持正值不为零说明针尖依旧在压缩组织;(E)为(D)结束直到针再次停止,在此期间力下降得更剧烈,组织边缘对针的拉拽力使静摩擦力减小,针的牵引使动摩擦力减小,尖端力在(E)的末端变为负值。整个过程结束后观察到,即使针已处于组织原始表面的位置,但针能留在组织内,说明组织被针拉高,即存在粘滑(stick slip)现象。
1.3 皮肤力学模型
由于皮肤的物理特性复杂,还具有各向异性——不同方向的应力-应变响应不同[42],研究者常将复杂的皮肤简化成理想的超弹性体模型来评估其性能,建立皮肤的本构模型并进行有限元分析。Fung等[43]提出指数形式应变能函数,并提出拟弹性假说,以线性理论描述局部范围内加载或卸载过程中应力-应变的关系,极大简化了皮肤本构关系的求解问题;Kong等[44]利用Neo-Hookean本构开发了二维多层超弹性皮肤模型,采用Von Mises屈服标准,模拟计算微针刺入皮肤的裂纹扩展路径;Shu等[45]以三维边界条件和皮肤动态特性为前提建立三维超弹性、各向异性的预应力多层材料模型,突破前人单个微针的局限,量化了相邻的微针对微针阵列贴片整体的影响。但皮肤不是单纯的线性弹性体,在其厚度方向具有明显的层状结构,且每层具有不同的组织成分和物理特性,故而在力学实验中表现出滞后、松弛、蠕变等特征。本构模型目前只在一定范围内模拟皮肤,评估微针穿刺动态过程的建模仍然需要充分考量皮肤的各种物理特性。
1.4 皮肤物理特性的分类
基于主题研究以及物理和数值模拟的统计调查对于表征皮肤更有意义,通过实验采集皮肤物理特性的数据是建立切实可行皮肤模型的基础,通常皮肤的物理特性以厚度、弹性、硬度、韧性等进行表征[46]。
1.4.1厚度
皮肤组织的纵向尺寸为厚度。厚度是皮肤物理特性的基础,皮肤的机械行为与皮肤组织的成分和构造密切相关。因皮肤类型的不同,其厚度的数量级为微米或毫米,通常借助组织切片、光学相干断层扫描法(OCT)、超声检测等成像方法和仪器,以及相关软件进行测量[47-49]。
1.4.2弹性
皮肤在负压或正压的作用下产生变形,当外加载荷消失时其恢复到原型的能力称为皮肤的弹性[50]。不同皮肤组织的机械性能和厚度影响并决定了皮肤的变形行为。弹性的量度为弹性模量E,单位为MPa或GPa等,计算公式如下:

其中,σ为应力,ε为应变。
据资料研究表明,皮肤是各向异性的特殊弹性材料[51-52],量化皮肤弹性相当复杂,研究者常将皮肤简化为各向同性的弹性材料,通常使用拉伸、压痕和抽吸等技术和实验手段量化皮肤的弹性特性。当然,由于测量技术的差异性,即使对于相同的皮肤样本,其结果也有所不同[53]。
1.4.3硬度
当一组加载点和边界条件施加在皮肤上时,皮肤对变形的抵抗力即硬度[50,54]。硬度和弹性在定义、量化皮肤机械特性方面都具有重要意义。不同的硬度测试方法有不同的标准,各种硬度标准的力学含义不同,相互不能直接换算,但可通过试验加以对比。测量皮肤硬度常用邵氏硬度计,其硬度测量的范围与皮肤接近,测试和校准相对简单,但邵氏硬度是一个综合值,包含各层皮肤组织的相互影响,不能单一进行修约、补偿。对此,有研究者通过纳米压痕试验测定不同皮肤组织的硬度[55]。
1.4.4韧性
对应于在给定皮肤的每单位表面上产生新裂纹面积所需的能量即韧性[56]。衡量韧性的量度为Jc,单位为kJ/m2,由以下公式得出:

其中,t为样品厚度(m);F为从开裂开始到结束所测量的力平均值(N)。
Purslow[56]以及Comley等[57]推行的撕裂试验(又称裤子试验)是一种测量可伸展结缔组织韧性的成熟方法,也是测定塑料薄膜、薄片的耐撕裂性能国家标准采用的试验方法(GB/T 16578.1-2008),用于确定撕裂模式下弹性材料的断裂韧性:沿其长度在中心切割一个矩形样品,从而形成两条腿,腿被拉向相反的方向,并测量切口开始产生的力。另外,Pereira等[58]通过剪刀切割试验限制裂纹的锐度,测量裂缝从缺口延伸时能量的损失为韧性。
1.5 皮肤物理特性的数据
显而易见,人们对完整皮肤的物理特性有一定的常识和了解,但对单层皮肤组织的机械行为知之甚少。许多研究者报告了不同皮肤组织的物理特性,采用不同测定方法和条件在不同时间对种属、身体部位、年龄和性别各不相同的皮肤进行了测定,所得结果存在较大变化范围(表2~5),但不妨碍对各自数据区间的判断,这些数据有助于加深对单层皮肤组织机械性能的理解,为建立与真实皮肤物理特性相近的皮肤模型提供参照依据。
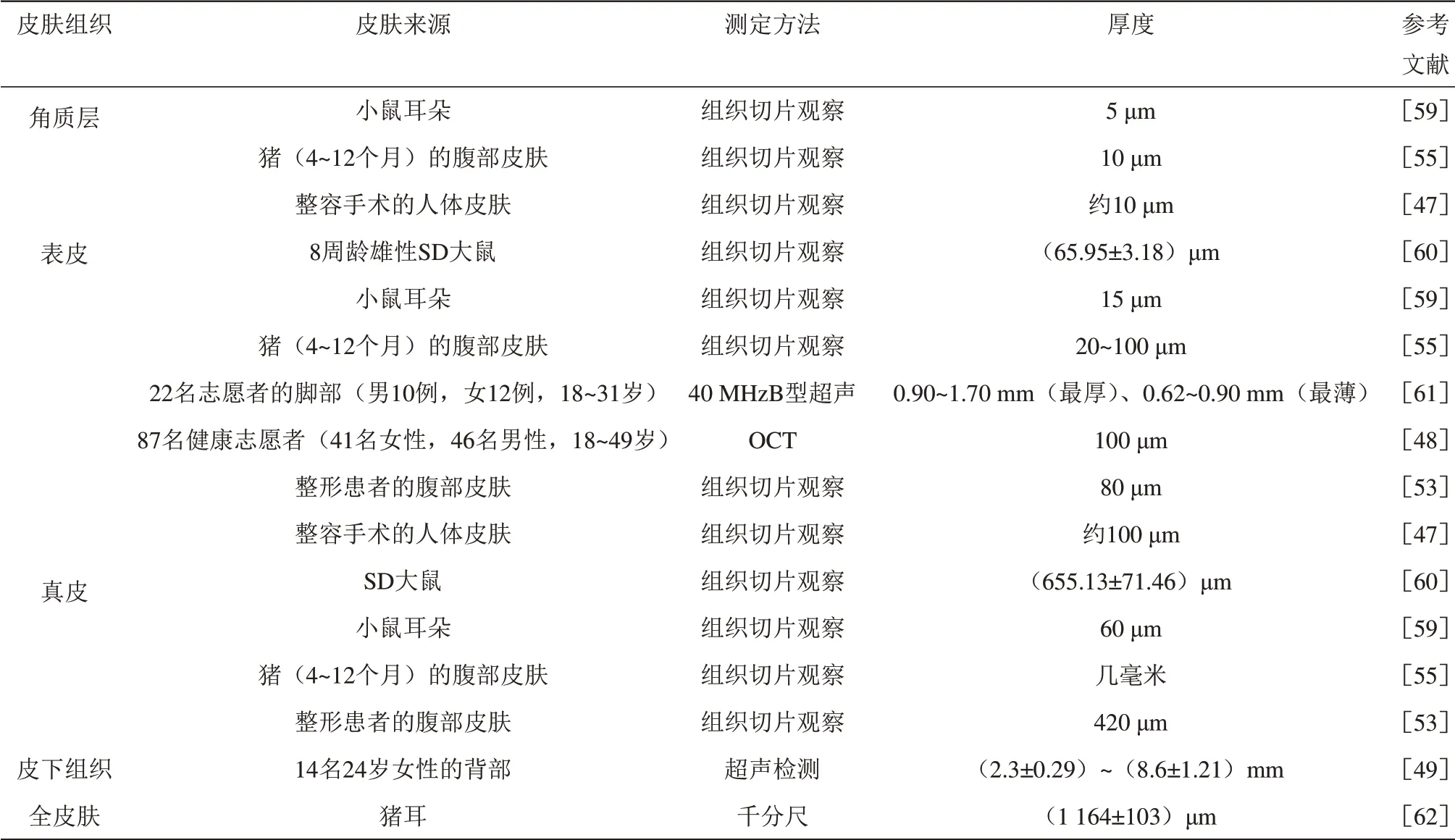
Table 2 The thickness of different skin tissues表2 不同皮肤组织的厚度
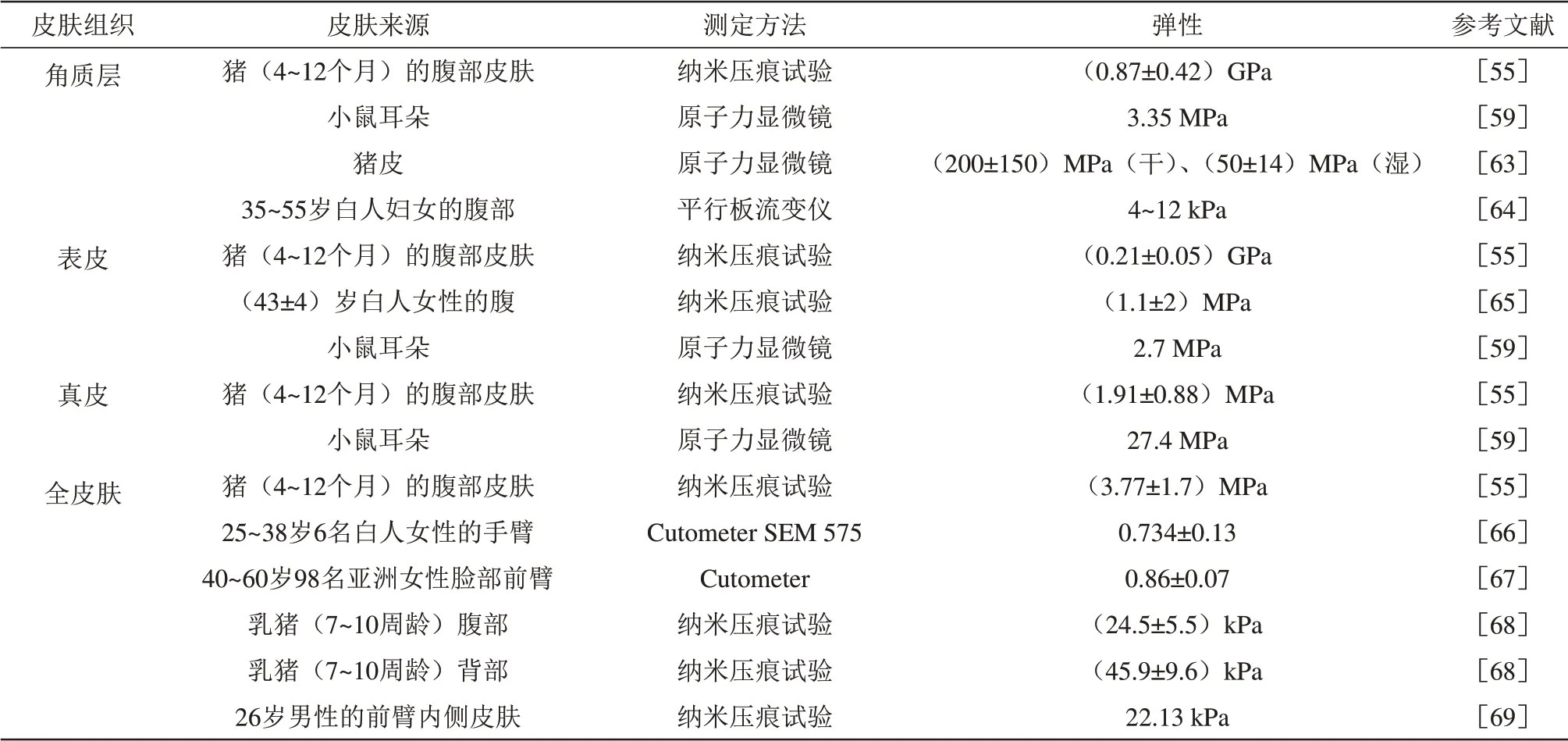
Table 3 The elasticity of different skin tissues表3 不同皮肤组织的弹性

Table 4 The hardness of different skin tissues表4 不同皮肤组织的硬度

Table 5 The toughness of different skin tissues表5 不同皮肤组织的韧性
2 皮肤模型的制备及应用
3R原 则[74],即 减 少(reduction)、替 代(replacement)和优化(refinement),广泛用于指导研究人员和审查人员,许多国家将3R原则明确规定在管理实验动物使用的法规中。其中,替代指避免或替代在研究中使用动物的方法。皮肤模型顺应了3R原则,且具有制备成本低、操作性强、均一性高、易标准化、易储存等优点而受到广泛关注。根据皮肤的不同特性、功能,衍生出许多不同种类的皮肤模型(图3),包括机械皮肤模型、渗透皮肤模型、组织皮肤模型和屏障皮肤模型等,表6整理了文献中常用皮肤模型的应用、制备方法及特点。不同皮肤模型的应用虽有差别,但其制备方法值得互相借鉴,因为皮肤本身就具备了这4种皮肤模型的性质和功能,完美的皮肤模型也应能从皮肤的各个方面进行模拟,但目前尚未能实现。因此,了解各种模型的制备方法及其特点应用有助于设计和制备出更加完善的皮肤模型。
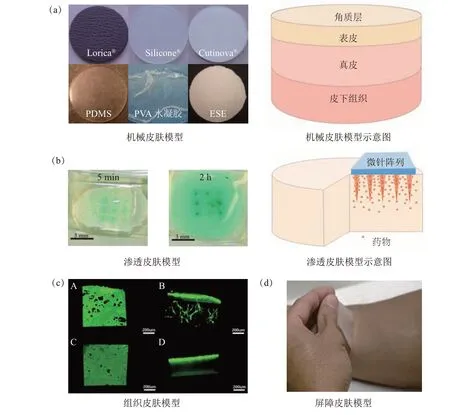
Fig.3 Skin models for different purposes图3 不同用途的皮肤模型
2.1 机械皮肤模型
研究者根据实验所需针对某一或一些皮肤机械特性制备的机械皮肤模型,应用于评价注射针、微针等经皮递送系统的机械性能,也可用于织物、敷料等的摩擦作用及医用缝合训练等。从上文对皮肤物理特性的介绍可知,皮肤的不同结构与成分为皮肤提供了弹性、韧性和硬度,研究者也常将皮肤简化为超弹性材料(图3a),制备机械皮肤模型常通过组合不同材料来模拟皮肤的不同结构及其性质:使用弹性体如PDMS、聚氨酯、硅橡胶等,胶状物质如明胶、琼脂等来模拟真皮、皮下组织的力学特性,使用纤维织物、薄膜等模拟坚硬的角质层,通过调节处方比例制备符合要求的皮肤模型[21,26,70,78]。图3a也展示了一些商用和研究者自制的机械皮肤模型。除常规机械皮肤模型外,研究者发现石蜡膜(Parafilm®)具有良好的均一性、柔韧性、延展性及颜色透明易观察等特点,研究者[79]将其层叠代替复杂的皮肤,用简单的公式反映微针的穿刺性能,但因石蜡膜不能完全模拟皮肤性能,而准确度不高。
2.2 渗透皮肤模型
渗透皮肤模型主要模拟皮肤的渗透能力,模型需具备一定的润湿性、孔隙率,常用明胶(图3b)、琼脂、PVA等材料制备[80]。主要适用于评价经皮递送的小分子药物的渗透性,评估渗透动力学[77,81]。渗透皮肤模型可代替传统的Franz cell法评价可溶性微针的渗透情况(图3b),但尚不能模拟皮肤内环境,无法评估药物与生物组织、器官的相互作用。
2.3 组织皮肤模型
组织皮肤模型是利用先进的组织工程技术,将人源皮肤细胞培养于特殊的插入式培养皿上构建而成(图3c),其在基因表达、组织结构、代谢活力等方面高度模拟人体皮肤[76],常用的商业化组织皮 肤 模 型 有EpiSkin®、EpiDerm®、SkinEthic®、EpidermFT®和StrataTest®等。组织皮肤模型适用于模拟和预测皮肤行为,也适用于研究药物的输送、分布及刺激性物质的毒理学。但作为单一的组织模型,无法测试组织和其他器官、生物系统的相互作用,可暴露时间较短,不能长时间多次使用,价格较高,难以大规模试验应用。
2.4 屏障皮肤模型
屏障皮肤模型主要模拟皮肤的屏障功能[77],为皮炎、烧伤患者的创面提供闭塞治疗,保护并减少水分流失(图3d)。

Table 6 Skin models for different purposes表6 不同用途的皮肤模型
3 微针穿刺性能的评价方法及指标
真实皮肤和机械皮肤模型在微针穿刺性能评价中应用广泛,可用于评价微针的刺入力、刺入率和刺入深度,渗透皮肤模型可用于评价微针的溶解速度和渗透量,组织皮肤模型可用于角质层模拟及其相关评价,鉴于篇幅所限,本文着重对微针穿刺性能评价作介绍。
3.1 穿刺性能评价方法
研究者根据实验主题选择合适的穿刺样本及评价方法,评价微针穿刺性能的方法主要有力学试验、染色法、表皮水分流失法(TEWL)、电阻法、OCT、电子计算机断层扫描(CT)、荧光染色标记法、组织切片法、石蜡膜穿刺法等[3,88]。每种方法都有其适用范围和应用限制,目前还没有一种方法能够完全地、精确地评价微针在实际应用中的穿刺性能。
力学试验通过质构仪、万能试验机等力学设备快速测定微针穿刺皮肤或皮肤模型所需的力和变形等[89];染色法、TEWL法和电阻法可以简便快速直观地判断微针是否成功刺入,但不能直接测定微针的刺入深度[90-93];OCT、CT、荧光染色标记法等光学方法可以无损在体分析微针刺入皮肤或皮肤模型后的刺入深度,观察微针刺入的孔道形态,但数据精确度、图像清晰度与仪器设备、光源波长等直接相关,存在局限性[94-98];组织切片法等对微针穿刺的皮肤组织进行石蜡包埋、染色切片,观察微针刺入的孔道形态,皮肤样品在处理过程中受到外界压力后会损失一些刺入深度、破坏原有的孔道形态[99]。除常规方法外,有其利用自身特性的、简单便捷的皮肤模型,如石蜡膜穿刺法用八层石蜡膜堆叠替代真实皮肤,微针穿刺后可以留下清晰的孔洞,可直接计数每层石蜡膜的孔洞数,通过公式间接计算刺入深度,该方法虽然简单便捷,均一性好,可观察微针阵列穿刺后的分布形态,虽不能反映实际的刺入深度,且结果存在一定的误差[100],但目前仍是评价微针穿刺性能的主流皮肤模型。
3.2 微针穿刺性能评价指标
3.2.1刺入力
皮肤是一种复杂的生物粘弹性材料,且皮肤表面不平整、有沟壑,微针刺入时不能垂直进入皮肤,皮肤的各层结构如角质层、真皮层也会对微针刺入造成阻碍[101-102]。微针能够刺破皮肤所需的最小力即刺入力。刺入力的测定受到微针参数、施加力、测定方法、皮肤种类、环境条件等诸多因素的影响[44,103-104]。Witting等[89]用质构仪测定出长度为300μm、800μm的金属微针能够以(0.88±0.01)N和(0.21±0.01)N的刺入力刺破猪角质层。侯俊杰[83]通过有限元软件对单个微针刺入皮肤过程建模,分析发现皮肤硬度越大,刺入力越小;微针锐度、针尖半径越小,刺入力越小;微针的夹角存在一个最优值,既能保证较小的刺入力,又能避免微针的断裂破坏。Olatunji等[105]通过有限元建模理论分析发现刺入力随微针间距的增加而减小,并穿刺猪皮进行验证,发现两者相一致。而Ranamukhaarachchi等[21]同时用微针穿刺人和猪的腹部皮肤、PDMS皮肤模型发现,PDMS皮肤模型产生的刺入力虽大于人和猪的腹部皮肤,但仍处于人和猪皮肤的力学范围内,代表一种更加坚韧的皮肤,用此模型进行微针评价能够确保微针应用于真实皮肤的有效性。评价刺入力也是反映微针机械强度的方法之一,刺入力应小于微针断裂力[106],这样才能确保微针在使用时不会断裂失效。设计微针施加力时还要确保大于刺入力以使微针有效刺入皮肤,同时要控制力的强度以尽可能减少对使用者造成的痛感。
3.2.2刺入率
刺入率指微针阵列够刺破表皮的微针数量与阵列中全部微针数量之比。刺入率是评价微针机械性能的参数之一,刺入率高表明微针能有效突破表皮屏障进行药物递送。一般微针的刺入率在90%~100%为良好[107]。李蓉蓉等[100]将可溶性微针刺入小鼠皮肤后,用亚甲蓝溶液染色,去除多余的染料后,计算刺入率。Arya等[90]将罗丹明载入可溶性微针中,刺入皮肤后即可溶解,将孔洞染色,更加直接观察微针的刺破情况。Larraneta等[108]发现,聚氨酯膜虽然常用于普通注射针的穿透实验,但因其弹性高,微针很难穿透,不易评价其刺入率,而微针刺入柔软的石蜡膜后能够留下清晰的孔洞。说明用于评价微针性能的皮肤模型不仅要模拟皮肤的特性,也要能够便于分析评价结果。
3.2.3刺入深度
刺入深度指微针刺入皮肤后微针针尖至皮肤表面的通道距离,良好的刺入深度应能突破角质层,有效提高药物的输送效率,但不触及疼痛神经。微针刺入深度与微针长度、形状、间距、阵列面积和皮肤种类、年龄、厚度、生理环境等因素有关[3]。Yu等[99]将异硫氰酸荧光素(FITC)标记的胰岛素加载到可溶性MN中,微针刺入SD大鼠皮肤后保留5 min,用激光共聚焦显微镜(CLSM)观察进入SD大鼠皮肤的渗透深度及胰岛素在不同深度区域的扩散。研究者[109-111]也常在微针中载入荧光染料如罗丹明等,通过冷冻切片观察微针的刺入深度。Larraneta等[108]将微针分别刺入新生猪皮肤、八层石蜡膜和聚氨酯膜中,通过OCT观察微针的刺入形态(图4),聚氨酯膜的刺入深度远小于猪皮肤,而石蜡膜的刺入深度虽比猪皮肤的刺入深度低(P<0.05),但差异小于总针长的10%。结果表明,石蜡膜仍是可能替代生物组织进行插入研究的有前途的材料。

Fig.4 OCT images of microneedle inserted into different materials图4 微针插入不同材料的OCT图像
4 总结与展望
本文整理概括了皮肤的物理特性、皮肤模型的制备及应用,以及真实皮肤与模拟皮肤在评价微针穿刺性能方面的具体应用。微针穿刺皮肤的力学行为复杂,前人做了大量针刺皮肤的实验,总结出一般力学行为,但很难阐明皮肤不同结构与成分对力学行为的具体影响,因为皮肤具有复杂的特性,致密坚固的角质层,束状交织的结缔组织构成弹性高、韧性强的真皮,以及受力形变大的皮下组织。研究皮肤的物理特性具有很大的意义,通常将皮肤的物理特性概括为厚度、弹性、硬度、韧性等方面,物理特性的测定与皮肤种属、身体部位、生理环境及测定方法密切相关,已有文献测定的物理特性可提供理论认知及参数范围。研究皮肤的物理特性对构建模拟皮肤的本构模型,对设计微针递送系统的针形结构、阵列密度、面积及制备材料等也至关重要。因为真实皮肤在实际应用中存在差异性大、不易标准化、不易获得、储存且存在伦理道德等问题,而皮肤模型可很好地解决这些问题,制备简单、易获得、重复性高、可标准化,因此成为发展的趋势。
皮肤模型具有多样性,在材料、结构、外观的选择上各有不同。皮肤模型的开发与其应用有密切的关系,机械皮肤模型、渗透皮肤模型、组织皮肤模型和屏障皮肤模型针对皮肤不同的特性及不同实验需求制作而得,研究者可根据自己的需要选择相应的皮肤模型。虽然模型涉及的材料本身与真实皮肤的物理特性不同,不能完全模拟真实皮肤的化学成分和分布、组织结构及皮肤组织与其他器官之间的相互联系,但皮肤模型具备可方便调整或提供与皮肤相媲美的特性材料和体系。至于微针构建的材料如金属、单晶硅和聚合物材料等的不同所造成的固有硬度差异,可能对真实皮肤或皮肤模型的刺入率和刺入深度也相应不同,可以通过设定皮肤模型时提供不同刚性微针刺入时的差异化判断方法及制定不同指标来解决,勿需专门为不同微针设计专用的皮肤模型。
在微针递送系统的研究中,皮肤是评价微针是否成功给药的关键,经验证的皮肤模型可取代真实皮肤在微针递送系统设计、开发和性能评价中的应用。在微针穿刺性能评价中,更多的考虑皮肤和皮肤模型的机械性能,皮肤模型需具备较难刺破的屏障、与真实皮肤类似的硬度、弹性和韧性,以及模型对微针刺入后的反作用力。另外,涂层微针或可溶性微针因涂覆或装载药物,需对其溶解性能进行评价。微针刺入在体皮肤时,皮肤间质液可提供药物溶解和药物扩散渗透的环境条件,药物被真皮内的毛细血管吸收,分布至全身,因此皮肤模型必须含有水分或适宜溶剂,具有与人或动物皮肤相近的渗透性,使之能为不同溶解性和渗透性尤其是生物药剂学分类 (biopharmaceutics classification system,BCS)[112]Ⅰ~Ⅲ类的生物活性分子提供溶出和扩散条件,甚至需要保证释放介质满足漏槽条件(sink condition)[113],使药物分子能从微针针体溶解扩散到皮肤。这也是期望皮肤模型在一定程度上代替真实皮肤时必须要考虑和改进的方面。现有的皮肤模型与真实皮肤的物理特性仍存在的差距是在制备这类模型材料时需要首先解决的问题。
皮下组织因个体差异、身体部位的脂肪、肌肉含量厚度以及距离骨骼远近的不同形成支撑作用不同,均一性差且受力易形变的特点对微针穿刺皮肤的影响很大,成为微针商业化生产准确评价的主要障碍,是研究者不可忽视的研究对象。亦有研究者[68]指出,皮下组织对微针性能的具体作用尚未清楚,难以可靠地预测微针应用皮肤后对皮下组织的特性反应。不管怎样,评估皮下组织的力学作用,衡量皮下组织的力学特性范围来筛选构建皮肤模型皮下组织类似物亦是亟待需要解决的难题。
目前评价微针穿刺的刺入力、刺入率能够通过质构仪、染色法直接获得,简单快捷,而观察刺入深度常需借助如OCT、CLSM、组织学切片等成像仪器和方法。除此之外,利用荧光光谱[114]、拉曼光谱[115]、CLSM[99]、MALDI-MSI(激光解吸/电离质谱成像)[116]可以评价微针递送的生物活性分子在模拟和真实皮肤内扩散和分布、消除等药代动力学,解析靶向行为,揭示分子作用机制。但某些检测设备较大型且昂贵,并不利于在微针评价中大规模应用普及。同时,因为微针通常以阵列形式刺入皮肤而不是单根微针,根本无法模拟注射针类似的刺穿力试验[117]。注射针的针尖锋利度或刺穿力试验,通常采用一定厚度的单层铝箔或聚氨酯膜为模拟刺入对象。微针阵列的刺入过程中,即使是针对单层膜,阵列中不同位置的微针跟膜接触先后不同,发生在不同位置、不同刺入深度的各根微针上的力学反应不尽相同,其综合叠加会对刺入的力学分析带来极大困难,需要建立更精准有效的方法来分析和模拟。
未来,针对现有的问题,研究者将对皮肤模型的制备及其相应简便的评价体系的建立进一步深入研究。随着新技术、跨学科或其他物理方法的发展将促进皮肤模型的开发,使其实现更多的皮肤特性和功能,适用于更广泛的条件和应用,如孙俊奇教授团队[118]利用PU网络中存在可逆氢键和受阻脲键开发了一种离子皮肤,不仅接近真实皮肤的弹性,还能实现自愈功能;Jung等[119]近期公布了一种新型复合材料,由在超薄橡胶膜内以单层形式紧密排列的金属纳米线组成,能够传输电信号,具备导电性、高拉伸性和易于图案化的特性。组织工程技术也有望帮助建立可替代真实皮肤的可仿真物理特性、可感觉、可愈合的体外3D皮肤模型[120-121]。
开发可调节、可控制的皮肤模型及以此为基础的模拟体系,能够更准确地模拟响应微针刺激下的皮肤行为,可更客观地观察其特性变化。通过建立标准化的评价模型,无疑有助于推进相关研究,也能促进微针阵列技术更好地产业化和商业化应用。
