溶瘤病毒的免疫学机制及临床研究进展*
2022-08-20张绍庚杨鹏辉
杨 豪 张绍庚 杨鹏辉**
(1)中国人民解放军总医院第五医学中心,北京 100039;2)河北北方学院,张家口 075000)
全球大约1/6的死亡由恶性肿瘤造成(International Agency for Research on Cancer,IARC,2019),是全球第二大死因,每年导致约1千万人死亡[1-2]。肿瘤的临床治疗需要根据患者的身体状况、肿瘤的病理类型、侵犯范围等情况,综合采用手术、化疗、放疗、免疫治疗、中医中药治疗、介入治疗、微波治疗等手段,以期较大幅度地提高治愈率,改善患者的生活质量[3-5]。然而,多数肿瘤患者的临床疗效并不理想,亟需新的治疗策略和手段,改善患者预后。
近年来,溶瘤病毒研究领域的迅猛发展,使其应用于当前最具潜力的肿瘤免疫疗法之中。溶瘤病毒可以是天然的或基因修饰的病毒,其抗肿瘤活性涉及多种机制,包括病毒、肿瘤细胞和免疫系统之间的相互作用。此外,将溶瘤病毒注射到肿瘤局部可产生富集作用,周边未受感染的肿瘤也会产生免疫反应。这种富集效应通过溶瘤病毒的分步活动发生,从肿瘤细胞的选择性复制开始,然后诱导免疫细胞死亡,进而促进抗肿瘤免疫反应。此外,溶瘤病毒可以通过基因工程技术来表达治疗基因,从而进一步增强抗肿瘤活性。
溶瘤病毒可以直接破坏肿瘤细胞,还会刺激机体产生抗肿瘤免疫反应[6-7]。目前已有4种溶瘤病毒产品获得批准应用于临床肿瘤治疗,超过50种溶瘤病毒产品已进入临床试验阶段,个别产品已进入到临床III期(https://ClinicalTrials.gov)[8-10]。尽管溶瘤病毒疗法已成为重要的肿瘤免疫治疗手段[11-12],但是以溶瘤病毒疗法为基础,试验不同的治疗方案,产品的临床转化也面临诸多挑战。为了让溶瘤病毒更有效更特异性地针对肿瘤细胞,病毒与免疫检查点基因的结合以提高对肿瘤的特异性靶向作用,成为肿瘤免疫治疗的新视角[13-16]。分子生物学和基因工程技术的发展使病毒基因组改造技术逐渐成熟,溶瘤病毒在靶向性、安全性及溶瘤效果方面都有了显著进步[17-18]。本文综述了溶瘤病毒的发展史、溶瘤病毒的作用机制,以及目前溶瘤病毒的种类、面临的挑战等。
1 溶瘤病毒的发展历程
1904年,《柳叶刀》(The Lancet)杂志报道,一位患有慢性白血病的妇女无意间感染流感病毒后,白血病症状意外好转,这一奇特的现象使人们开始意识到病毒和肿瘤作为医学上两大难以攻克的疾病,或许可以相互影响,开创了病毒治疗肿瘤的先河[19]。1912年,意大利医生Depace,发现一位宫颈癌患者,在接种减毒狂犬病疫苗后肿瘤自发地消退缩小,自此,揭开了病毒治疗肿瘤的历史,溶瘤病毒登上肿瘤免疫治疗的舞台[20]。此后,溶瘤病毒作为一种有前途的肿瘤治疗方式被大量的研究,1950~1980年间,许多科学家直接利用多种野生型病毒(例如肝炎病毒、西尼罗河病毒、登革病毒、黄热病毒等)感染治疗数百个病例不同的肿瘤,但由于医疗条件差、技术水平低,对病毒及肿瘤机制的科学认识不足等因素影响,疗效极不理想,溶瘤病毒发展非常缓慢[21-24]。1991年,首次对单纯疱疹病毒1型(HSV-1)进行胸苷激酶(thymidine kinase,TK)敲除的基因改造,溶瘤病毒的研究开始突飞猛进[25]。1996年,研究证明带有E1B55k基因突变的腺病毒可选择性地在p53缺陷的肿瘤细胞中复制[26],因此可以作为溶解肿瘤的病毒来发挥作用,随后基因改造的腺病毒ONYX-015进入I期临床试验[27]。2004年拉脱维亚批准一款非致病性的人肠道细胞病变孤儿病毒(enteric cytopathic human orphan virus) ——RIGVIR,用于黑色素瘤的临床治疗,成为第一款获得监管机构批准的用于肿瘤治疗的溶瘤病毒[28-29]。2005年,经改造的腺病毒H101(Oncorine,重组人5型腺病毒注射液,安柯瑞)在中国获批上市[30-31]。2015年10月,FDA批准T-VEC(Talimogene laherparepvec,Imlygic)上市,T-VEC是一种经过基因修饰的1型单纯疱疹病毒(HSV-1),用于治疗晚期黑色素瘤,它可以在肿瘤细胞内复制并表达粒细胞-巨噬细胞集落刺激因子(GM-CSF),这是首个获得FDA批准的溶瘤病毒类治疗药物[32-33]。2016年分别在欧洲和加拿大获批上市,标志着溶瘤病毒技术的成熟和对溶瘤病毒疗效的正式认可。2017年9月,《细胞》(Cell)报道溶瘤病毒T-VEC与PD-1抗肿瘤药物Keytruda联合用药用于治疗黑色素瘤,肿瘤缓解率高达62%,其中33%为完全缓解,掀起了溶瘤病毒联合疗法研究的热潮[34-35]。2021年11月1日,日本第一三共制药股份有限公司宣布第三代HSV-1溶瘤病毒产品Delytact(Teserpaturev/G47Δ)被批准上市,这是首个获批上市用于治疗恶性胶质瘤的溶瘤病毒产品,也是目前全球获批上市的第4款溶瘤病毒产品。该产品具有更强的复制能力和更高的抗肿瘤活性,其在治疗神经胶质瘤、乳腺癌、前列腺癌、神经鞘瘤、鼻咽癌、肝细胞癌、结肠直肠癌、恶性周围神经鞘瘤和甲状腺癌均有效[36]。溶瘤病毒发展历程见图1。溶瘤病毒疗法发展至今,已成为临床上最有希望的癌症免疫治疗手段,受到国内外的广泛关注。
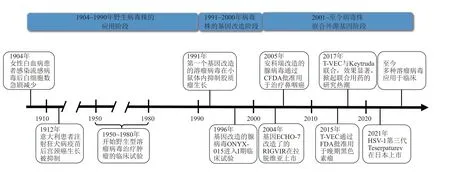
Fig.1 Development of oncolytic virus图1 溶瘤病毒发展历程
截止目前,全球已批准上市的有4款溶瘤病毒产品(表1),包括拉脱维亚Sia Latima公司治疗黑色素瘤和其他恶性肿瘤的RIGVIR、上海三维生物公司治疗鼻咽癌的安科瑞H101、美国Amgen旗下Biovex治疗黑色素瘤的T-VEC以及日本第一三共公司治疗胶质细胞瘤的Delytact(Teserpaturev)。
2 溶瘤病毒分类
前期研究表明,溶瘤病毒是小颗粒,病毒大小多数分布在20~200 nm之间,在肿瘤细胞中的选择性复制是可用于肿瘤免疫疗法非常重要的特性,复制能力取决于病毒感染能力、肿瘤细胞的特性以及宿主抵抗力[37]。病毒主要由遗传物质和蛋白质组成,由单链或双链RNA或DNA组成基因组(附件表S1);外面包裹着一层有规律排列的蛋白质亚单位被称为衣壳[38]。肿瘤免疫治疗的溶瘤病毒的选择取决于许多特性,包括潜在的致病性、免疫原性、编码治疗能力的基因,在制造过程中可实现的病毒滴度和病毒稳定性。病毒生命周期有5个不同的阶段——吸附、进入和脱壳、复制、组装、释放。在每个阶段均可利用基因工程技术对病毒基因组进行调节,并可以设计成靶向肿瘤细胞内分泌和复制[39]。此外,病毒表现出的致病性和免疫原性,因病毒种类、剂量、接种途径、原宿主免疫等因素而异,是能够促进有效抗肿瘤免疫的特征[40]。
目前在Clinical Trials网站注册的溶瘤病毒主要有:痘病毒、腺病毒、HSV-1、呼肠孤病毒、麻疹病毒、新城疫病毒、柯萨奇病毒、水泡型口炎病毒、脊髓灰质炎病毒等,其中以痘苗病毒、腺病毒和单纯疱疹病毒最多(附件表S1)[41]。由于腺病毒基因重组制备比较容易,临床开发广,试验开展最多,而HSV-1和痘苗病毒等因其基因组比较大,可加入任意的外来基因,在基因改造或修饰方面具有很大优势,应用备受青睐[42]。本课题组前期创新性利用流感病毒反向遗传学技术,建立了成熟的流感病毒为载体的重组溶瘤病毒技术体系,成功获得了嵌合外源基因GM-CSF、免疫检查点PD-1、CTLA4抑制剂抗体等的多株重组溶瘤流感病毒,体内外实验证实溶瘤病毒具有良好的安全性、有效性和稳定性,有望为临床肿瘤免疫治疗提供新策略[43-44]。
3 溶瘤病毒靶向杀伤肿瘤细胞的免疫学机制
溶瘤病毒是当前肿瘤治疗中极具前景的免疫治疗药物,其抗肿瘤活性通过影响肿瘤免疫周期的多种机制介导。溶瘤病毒杀伤肿瘤细胞的机制尚未完全研究清楚,目前公认的机制主要有:溶瘤病毒通过自我复制在肿瘤细胞中大量增殖,最终裂解肿瘤细胞,进而释放更多的溶瘤病毒,引起肿瘤溶解;溶瘤病毒可以诱导全身及局部抗肿瘤免疫,激活T细胞靶向杀伤肿瘤细胞,使肿瘤消退[45]。
a.靶向肿瘤细胞裂解作用:作为有前途的肿瘤基因治疗剂,溶瘤病毒具有在肿瘤细胞中大量复制并导致肿瘤细胞衰退甚至死亡的独特能力,在正常组织中不复制,进一步导致肿瘤相关抗原暴露引起机体免疫反应[46]。溶瘤病毒这种肿瘤嗜性(溶瘤病毒在肿瘤细胞中的选择性复制能力)是溶瘤病毒作为肿瘤免疫疗法非常重要的特性[47]。尽管有些病毒表现出天生的抗肿瘤倾向性,但其他病毒必须通过基因工程技术加工后选择性感染肿瘤细胞[48]。感染后,病毒会利用肿瘤细胞的蛋白质工厂,使肿瘤细胞无法产生足够的蛋白质满足生长需要,从而破坏肿瘤细胞的正常生理过程[49]。
b.抗肿瘤免疫应答:溶瘤病毒诱导局部和全身特异性抗肿瘤免疫。诱导机体肿瘤特异性免疫反应是溶瘤病毒根除肿瘤的关键因素[50]。溶瘤病毒的治疗效果取决于直接肿瘤细胞溶解和间接激活抗肿瘤免疫反应的组合。在感染溶瘤病毒后,肿瘤细胞启动由内质网(endoplasmic reticulum,ER)和基因毒性应激组成的抗病毒反应。这种反应导致活性氧(ROS)的上调和抗病毒细胞因子的产生[51]。活性氧和细胞因子,特别是I型干扰素(IFN),从受感染的肿瘤细胞释放并刺激免疫细胞(抗原呈递细胞、CD8+T细胞和自然杀伤(NK)细胞)[52]。溶瘤病毒感染肿瘤细胞死亡,引起肿瘤溶解,随后释放肿瘤相关抗原,子代病毒、病原体相关分子模式(PAMP)、危险相关分子模式信号(DAMP)和包括新抗原在内的肿瘤相关抗原(TAAs),可促进适应性免疫反应,通过激活Toll样受体(TLR)等受体刺激免疫系统[53-54]。
溶瘤病毒作为内源性抗原如何进入ER、如何与主要组织相容性复合体(MHC)I类分子结合及APC细胞中如何提呈给CD8+T细胞是一个复杂的过程。人类MHC表达在不同细胞表面。MHC基因调节机体对各种病原体产生最佳免疫应答,以适应多变的内外环境[55-56]。在T细胞分化发育中是必不可少的,且对免疫应答的启动和调节发挥着重要作用。抗原递呈细胞(antigen-presenting cell,APC)是一类具有摄取、加工、递呈胞外(外源)抗原,激活CD4+T细胞的细胞,且都可表达MHCⅠ类分子[56]。APC细胞包括巨噬细胞(macrophage,Mф)、树突细胞(dendritic cell,DC)和B淋巴细胞,其中树突状细胞在体内数量很少,但分布很广[57]。已有研究表明DC在外周摄取病毒抗原、肿瘤相关抗原/新生抗原后被激活,进入引流淋巴结,分化为成熟的DC[58]。失去主动摄取抗原的能力,上调并高表达MHC分子、协同刺激分子和黏附分子[59]。淋巴结中的DC主要集中在T细胞区,它们已不具有吞噬功能,当溶瘤病毒进入细胞,DC对它们进行加工呈递。通过MHCⅠ类和Ⅱ类分子呈递病毒抗原,激活CD4+和CD8+T细胞。加工呈递的抗原分为内源性抗原和外源性抗原。溶瘤病毒感染后进入胞质属于内源性抗原,被宿主细胞识别后被蛋白酶水解,产生的肽段被抗原加工相关转运蛋白(TAP)有选择性地从胞质转运到ER,并在此与新合成的MHCⅠ类分子结合[60]。而后一起表达于细胞膜上,在这里被CD8+T细胞上的TCR识别。内源性抗原肽加工、Ⅰ类分子与抗原肽结合过程结束。结合肽后的Ⅰ类分子结构稳定,从ER进入高尔基体经糖基化修饰后,通过胞吐转运到细胞表面,供CD8+T细胞识别[61]。经过加工的抗原以MHC/肽复合物形式表达在靶细胞或APC表面,由表达特异性TCR的CD4+T细胞或CD8+T细胞对之进行选择性识别[62]。未致敏T细胞在周围淋巴器官与APC相遇并被激活,而已致敏的T细胞则离开周围淋巴器官,经血流到达远端肿瘤部位发挥效应功能。
在由此产生的免疫刺激环境中,抗原呈递细胞释放并吸收TAAs和NEO(新生抗原),在未暴露于病毒的远处肿瘤部位介导肿瘤消退。这些会激活抗原特异性CD4+和CD8+T细胞反应[63]。一旦被激活,CD8+T细胞可以扩展为细胞毒性效应细胞,能够进入已确定的肿瘤生长部位,并在抗原识别后介导抗肿瘤免疫(图2)[64]。
然而,病毒诱导机体抗病毒免疫反应的能力可能通过中和抗病毒抗体和细胞毒性T细胞介导的免疫反应清除病毒。病毒中和作用对肿瘤免疫诱导的影响程度是复杂的,可能受到许多变量的影响,最显著的是病毒和肿瘤微环境的特征。肿瘤相关抗原的释放,特别是与局部细胞因子和DAMP释放相结合,有利于诱导针对肿瘤细胞的先天性和适应性免疫反应(图2)[65]。这种效应对于在未注射或未暴露于病毒的远处肿瘤部位调节肿瘤消退可能极为重要。临床前研究已经证明肿瘤特异性CD8+T细胞在溶瘤病毒介导的肿瘤免疫反应中的重要性[66]。I型干扰素和DAMP也可以直接激活NK细胞,这是天然免疫应答反应的重要部分。NK细胞可以杀死MHC I类表达下调的靶细胞,这在肿瘤细胞中很常见[67]。NK细胞的影响可能取决于宿主种类和病毒的特征[68-69]。此外,NK细胞通过清除病毒感染的细胞而损害溶瘤病毒的效力[70]。多种因素综合产生针对病毒感染肿瘤细胞的免疫反应,以及针对未感染的肿瘤细胞上表达TAAs/NEO抗原的从头免疫反应[71]。但影响免疫介导的病毒清除和诱导抗肿瘤免疫之间平衡的因素尚不完全清楚。
总之,溶瘤病毒破坏病毒感染的肿瘤细胞,释放细胞因子,减少肿瘤生长,并从即将死亡的肿瘤细胞中获取病毒和肿瘤抗原,以呈现和激活T细胞,激活机体的局部和全身免疫,起到抗肿瘤的效果[72]。
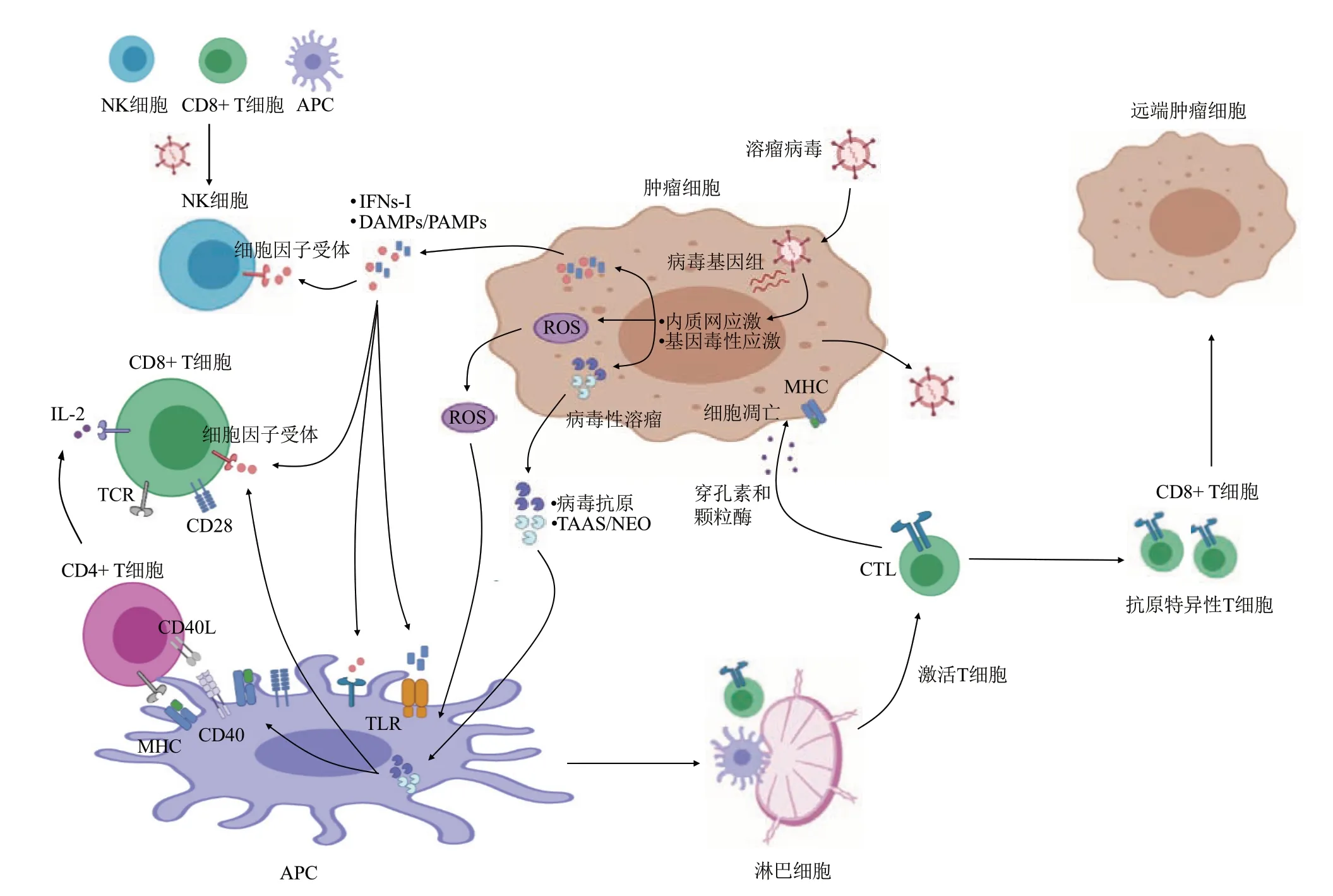
Fig.2 Mechanism of action of oncolytic viruses图2 溶瘤病毒的作用机制
4 挑战与展望
近年来,随着基因工程技术的发展,人们对病毒基因功能和结构的认识不断深入,优化设计和操作病毒基因组以产生非致病性病毒已成为溶瘤病毒研究的方向,极大推动了溶瘤病毒疗法的进步。经基因修饰的溶瘤病毒,可以靶向感染肿瘤细胞,增强机体免疫反应,毒副作用降低,成为更稳定的表达载体。2015年T-VEC被批准用于晚期黑色素瘤患者临床治疗,2021年Delytact被批准用于恶性胶质瘤的临床治疗,溶瘤病毒疗法在癌症治疗中取得了重大飞跃,溶瘤病毒疗法已成为肿瘤免疫治疗的一种重要手段。
尽管诸多临床试验结果证实溶瘤病毒疗法具有良好的安全性、有效性和稳定性,但该疗法仍存在一定的局限性亟待解决。本课题组[44]在拯救重组溶瘤流感病毒的过程中也遇到诸多难题。a.如何从基因序列源头优化设计病毒,提高溶瘤病毒靶向性,避免对正常细胞的影响,降低个体差异性;b.如何避免溶瘤病毒在进入肿瘤细胞前被人体免疫系统清除;c.溶瘤病毒疗法的生物安全性还需进一步研究,基因重组的溶瘤病毒是否会基因重排、基因突变,甚至产生超级病毒;d.目前用于临床治疗或试验的溶瘤病毒类型有限,是否有其他对人类更友好且更易操作的病毒有待进一步探索。为解决以上问题,进一步提高溶瘤病毒疗法的治疗效果,使患者获益,仍需要更多的临床试验来保证溶瘤病毒疗法的安全性和有效性,确定最佳的给药剂量和给药途径以达到最优的治疗效果,此外应尽快构建更多类型的溶瘤病毒用于临床治疗[73]。
溶瘤病毒与化疗或免疫治疗药物联合治疗,甚至多种溶瘤病毒药物联合应用,可能会更有效地控制肿瘤进展或治愈肿瘤,为肿瘤患者提供极具潜力的临床治疗选择。现有临床证据表明,溶瘤病毒可以加强肿瘤对免疫调节检查点抑制剂、CAR-T细胞等免疫治疗方法的反应率,是联合治疗策略中的理想对象。相信随着溶瘤病毒研究的不断深入,溶瘤病毒疗法在治疗人类疾病中将会发挥更广泛、更深入的作用。附件 PIBB_20210340_Table S1.pdf请见本文网络版(www.pibb.ac.cn或www.cnki.net)

Table 1 Oncolytic virus products on the market表1 已上市的溶瘤病毒产品
