基于分子对接技术探讨大黄治疗阿尔茨海默病的作用机制及活性成分
2022-08-20陈大宝李静雅赵春春
张 蒙,陈大宝,李静雅,赵春春,王 艳,2,蔡 标,2,3,周 鹏,2,3
(1. 安徽中医药大学中西医结合学院,安徽合肥 230012;2. 安徽省中医药科学院中西医结合研究所,安徽合肥 230012;3. 中药复方安徽省重点实验室,安徽合肥 230012)
阿尔茨海默病(Alzheimer′s disease,AD)是以进行性痴呆为主要临床表现的中枢退行性疾病,其主要临床表现为认知功能障碍、记忆障碍及人格精神异常等[1],主要病理特征为β-淀粉样蛋白(amyloid β-protein,Aβ)在神经组织中沉积形成的老年斑(senile plaque,SP)、tau 蛋白在细胞内异常磷酸化聚集形成的神经元纤维缠结(neuro fibrillary tangles,NFTs)以及广泛的海马神经元丢失[2]。研究证明,在各类型炎症中,NLRP3 炎症小体是神经退行性疾病中最具特征的,特别是在AD 中[3]。NLRP3 炎性小体的激活导致小胶质细胞中Caspase-1 介导的白介素IL-1β 和IL-18 的生成,可以通过调节神经炎症作为治疗AD 的关键性分子靶标[4]。NLRP3 信号通路作为AD 炎症反应中重要的信号通路,其下游Caspase-1 和GSDMD 信号通路同样可能与AD 的发生有一定联系[5]。
大黄为蓼科植物掌叶大黄、唐古特大黄或药用大黄的根茎,别名黄良、火参、肤如、将军等,具有攻积滞、清湿热、泻火、活血、祛瘀、解毒等功效[6,7]。其主要成分包括大黄酚、大黄素、大黄酸、芦荟大黄素、大黄素甲醚、番泻苷等,重要的活性成分是蒽醌类化合物及其衍生物[8]。中医认为,AD 属“痴呆”范畴,主要病位在脑,其病因属本虚标实,本虚多为肾精亏虚、脑髓失充,标实多涉及痰浊、瘀血,其治疗原则可考虑以补肾填精为本兼以活血、化瘀、祛痰[9]。因此,大黄所具备活血、祛瘀的功效能针对AD 中“脑髓失养、痰浊瘀血”的病机,从而改善AD患者的认知功能。
现代药理学研究表明,大黄具有抗菌、抗肿瘤、抗病毒、保护脑及心脏等活性,同时还可以改善大脑记忆功能[10,11],其有效成分可以通过产生抗炎、抗凋亡、抗氧化应激等作用起到治疗AD 的效果,为后续临床治疗AD 提供理论依据[12]。然而,大黄治疗AD 的作用机制尚不明确,因此,深入探讨大黄的作用靶点,采用分子对接的方法来探讨大黄的主要活性成分是否能通过NLRP3/Caspase-1/GSDMD 通路作用于AD,并寻找其潜在活性成分,为后期临床研究和开发新药提供理论依据。
分子对接技术主要针对一个或多个与靶向疾病相关的靶蛋白,利用相关软件对中药复方库进行虚拟筛选,根据对接后的Vina 评分结果,寻找与疾病靶蛋白特异性结合的候选化合物,从中筛选出具有活性的化合物。该方法提高了化学活性评价的效率,为中药资源的进一步研究提供了新方向[13]。本研究借助分子对接技术,将大黄中的主要活性化合物与NLRP3/Caspase-1/GSDMD 炎症信号通路中的关键靶点进行分子对接,探讨大黄治疗AD 的相关作用机制,为今后中药防治AD 的研究提供方向和思路。
1 资料与方法
1.1 大黄活性成分筛选
通过中药系统药理学数据库与分析平台TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)[14],以“大黄”为关键词,检索大黄的所有化学成分,根据药动学特征(ADME)对化学成分的口服利用度(oral bioavailability,OB)和类药性(drug likeness,DL)进行筛选,并设置OB≥30%及DL≥18%作为活性分子的筛选条件,筛选出大黄的活性成分有16 个。结合相关文献研究,增加大黄酚(MOL001729)[15,16]、大 黄 素(MOL000472)[17,18]、大 黄 素 甲 醚(MOL000476)、大黄酚葡萄糖苷(MOL002244)、大黄素蒽酮(MOL003353)、覆盆子酮(MOL002287)6个活性化合物[19,20],共22 个有效成分,下载化合物的MOL 格式的结构(表1)。

表1 大黄的主要化学成分Tab 1 The main chemical components of Radix et Rhizoma Rhei
1.2 靶点筛选
以“NLRP3”、“Caspase-1”“GSDMD”为关键词,从蛋白质三维结构数据库PDB(http://www1.rcsb.org/)[21]检索出AD 相关蛋白靶点,并结合相关文献确定最佳靶点为6npy[22]、1rwx[23]、5wqt[24],并下载其pdb 格式三维结构。
1.3 成分-靶点分子对接
以根据条件筛选出的大黄活性成分为配体,通过PDB 数据库查找的蛋白靶点为受体,通过CBDOCK 网站(http://clab.labshare.cn/cb-dock/php/blinddock.php)进行分子对接[25]。分别得到每个化合物与3 个靶点的对接得分值(Vina score),Vina score 是用Vina 程序以相应的口袋参数对受体和配体进行分子对接所得到复合物的得分,得分值越低,配体与受体结合越稳定。另外,考虑到结合位点尽量一致,以NLRP3、Caspase-1、GSDMD 的抑制剂MCC950、ML132、LDC7559 与相应的靶点对接结果为阳性参照,筛选出对接结果。
2 结果
分子对接结果显示,大黄的主要化学成分均与NLRP3、Caspase-1、GSDMD 靶点具有较好结合。其中,大黄化学成分与NLRP3 蛋白靶点结合亲和力较高的前3 位是β-胡萝卜素氧化物、β-谷甾醇、大黄素甲醚双葡萄糖苷。见表2、图1。

图1 大黄活性成分与NLRP3 靶点对接示意图Fig 1 Schematic diagram of active ingredients of Radix et Rhizoma Rhei docking with NLRP3

表2 大黄主要化学成分与NLRP3 蛋白靶点的对接情况Tab 2 The docking results of the main chemical components of Radix et Rhizoma Rhei with the NLRP3
与Caspase-1 蛋白靶点结合亲和力前3 位为β-胡萝卜素氧化物、大黄素-1-O-β-D-吡喃葡萄糖苷、大黄素甲醚双葡萄糖苷。见表3、图2。
表3 大黄主要化学成分与Caspase-1 蛋白靶点的对接情况Tab 3 The docking results of the main chemical components of Radix et Rhizoma Rhei with the Caspase-1

图2 大黄活性成分与Caspase-1 靶点对接示意图Fig 2 Schematic diagram of active ingredients of Radix et Rhizoma Rhei docking with Caspase-1
与GSDMD 蛋白靶点结合亲和力前3 位为β-胡萝卜素氧化物、大黄素甲醚双葡萄糖苷、大黄素-1-O-β-D-吡喃葡萄糖苷。见表4、图3。
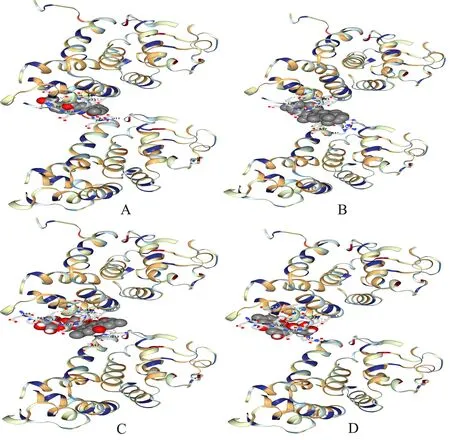
图3 大黄活性成分与GSDMD 靶点对接示意图Fig 3 Schematic diagram of active ingredients of Radix et Rhizoma Rhei docking with GSDMD

表4 大黄主要化学成分与GSDMD 蛋白靶点的对接情况Tab 4 The docking results of the main chemical components of Radix et Rhizoma Rhei with the GSDMD
综上所述,大黄主要化学成分与AD 相关NLRP3、Caspase-1、GSDMD 靶点的对接结果中,均有β-胡萝卜素氧化物和大黄素甲醚双葡萄糖苷,说明其可能是潜在活性成分,其中,结合效果最佳的是β-胡萝卜素氧化物,与NLRP3、Caspase-1、GSDMD 靶点的Vina 得分最低,分别为-11.9、-9.0、-7.6,结合效果均优于特异性抑制剂。
3 讨论
NLRP3 是一种核苷酸寡聚化结构域样受体家族蛋白,是一种细胞内传感器,可检测各种微生物基序、内源性危险信号和环境刺激物,从而导致NLRP3 炎性体的形成和激活[26]。在各种类型的炎性小体中,NLRP3 炎性小体在神经退行性疾病中,尤其是在AD 中最具特征。有研究发现,在APP/PS1转基因小鼠中沉默Caspase-1 和抑制GSDMD 的表达后,小鼠皮层和海马中Caspase-1 表达降低,细胞焦亡减少,同时改善了小鼠的认知功能,提示NLRP3/caspase-1 途径介导的细胞焦亡与AD 的发病有关;同时在体外实验中发现Aβ 诱导的皮层神经元中NLRP3/caspase-1 途径表达的增加会使皮层神经元发生细胞焦亡。Aβ 的沉积和错误折叠蛋白的聚集会激活NLRP3-ASC-pro-Caspase-1 炎性小体,继而激活Caspase-1,促进炎症因子IL-1β 和IL-18的分泌,引发细胞焦亡,进而导致细胞死亡,致使神经元丢失,最终引发AD[27-30]。因此,通过调节神经炎症,NLRP3 炎性体可能是AD 的关键治疗分子靶标。
目前,中药因具有作用平稳、毒副作用小、耐受性高、多组分、多靶点、多途径起效的特点,尤其是在慢性炎症方面发挥着独特的优势。但是由于受到各方面条件的限制,关于抗炎药物及其作用机制方面的研究面临困难。分子对接技术在中药活性成分的虚拟筛选和确定作用靶标等方面已成功运用。通过对接中药活性成分与信号通路相关靶点,筛选出与特定靶点结合紧密的活性成分,从而构建了药物-疾病-靶点之间的关系[31]。然而,分子对接技术在中药领域的研究思路和方法仍存在一定的局限性,对接得分最低的化合物也未必是最佳的配体,需要与其他方法相结合,或者进行进一步的体内外实验验证。
本研究运用分子对接进行分析,借助TCMSP可知中药大黄中22 种主要活性成分,对NLRP3/Caspase-1/GSDMD 信号通路中的关键靶点具有较好的结合,体现了中药复方“多成分-多靶点”的作用特点。结果发现大黄中的主要活性成分中,其与NLRP3 蛋白靶点结合亲和力较强的10 个化合物中,最优化合物是β-胡萝卜素氧化物,其次是蒽醌类化合物,主要包含7 个蒽醌化合物,分别为大黄素甲醚双葡萄糖苷、大黄素-1-O-β-D-吡喃葡萄糖苷、大黄酚葡萄糖苷、大黄酸、大黄酚、大黄素和大黄素蒽酮。与Caspase-1 蛋白靶点结合亲和力最强的是β-胡萝卜素氧化物,其他排名靠前的蒽醌类化合物有大黄素-1-O-β-D-吡喃葡萄糖苷、大黄素甲醚双葡萄糖苷、大黄素、大黄素蒽酮、番泻苷E_qt、番泻苷D_qt 和大黄酸。与GSDMD 蛋白靶点结合亲和力最强为β-胡萝卜素氧化物,其他化合物以蒽醌类化合物为主,主要有大黄素甲醚双葡萄糖苷、大黄素-1-O-β-D-吡喃葡萄糖苷、大黄酚、番泻苷E_qt 和大黄素。由此说明,大黄可能通过作用于NLRP3/Caspase-1/GSDMD 信号通路发挥抗炎作用,为揭示大黄防治AD 的抗炎作用机制提供理论依据。除此之外,大黄中与NLRP3/Caspase-1/GSDMD 信号通路中的三个靶点结合最强的化合物是β-胡萝卜素氧化物,其次是蒽醌类化合物为主,说明β-胡萝卜素氧化物和蒽醌类化合物有望作为单体或者先导化合物进行结构修饰后参与AD 的治疗,为后期进一步进行体内外实验验证以及深入研究大黄防治AD的抗炎机制提供科学假设和理论依据。
作者贡献度说明:
张蒙:课题实施及撰写全文;陈大宝:课题实施,图片编辑;李静雅:课题实施,图片编辑;赵春春:课题实施,图片编辑;王艳:修改论文;蔡标:修改论文、课题来源;周鹏:课题设计、修改论文、课题来源。
