肾损伤患者高尿酸血症关联糖脂代谢的横断面研究)
2022-08-19张伟东朱博文宋娜娜
张伟东 朱博文 李 阳 宋娜娜 方 艺 赵 栓
高尿酸血症(hyperuricemia,HUA)是体内尿酸生成增多或肾脏排泄尿酸减少所致的嘌呤代谢紊乱性疾病。中国社区人群HUA患病率逐年快速升高,截至2017年已达到18.4%[1]。HUA与高血压、肾脏病、心血管疾病(cardiovascular disease, CVD)、高脂血症、胰岛素抵抗密切相关,且各疾病之间相互促进,加速恶化,严重影响了疾病预后和患者生活质量[2-3]。据估计,70%的HUA由肾脏排泄障碍所致,且肾损伤常伴随血尿酸(serum uric acid,sUA)水平的升高[4-7]。因此,在肾损伤患者中评估糖脂代谢与HUA的关联可以有效监测该人群的疾病进展和预后。中国健康与营养调查(China Health and Nutrition Survey, CHNS)是一项正在进行的全国性队列研究,旨在探讨国家和地方政府的健康、营养和计划生育等政策对居民健康生活的影响[8]。CHNS始于1989年,在1991-2015年共计完成9次随访。本研究提取2009年CHNS数据库纳入的社区肾损伤患者资料,探究该人群糖脂代谢与HUA的相关性,旨在为延缓肾损伤患者的疾病进展提供有效干预策略。
1 对象与方法
1.1 研究对象 本研究为横断面研究,研究对象来源于CHNS数据库2009年调查的社区人群资料[8]。排除标准:①年龄<18岁或>75岁;②妊娠期女性;③sUA检测前3 d内高蛋白饮食(3 d内平均蛋白质摄入量>110 g/d);④血生物化学指标缺失;⑤估算的肾小球滤过率(estimated glomerular filtration rate, eGFR)>60 mL/(min·1.73 m2)。最终筛选并纳入研究对象707例,提取其人口、行为学、体格检查、血生物化学指标等信息,根据数据库赋予的ID号进行人群匹配与合并,分为HUA组与非HUA组。
1.2 观察指标 CHNS数据库于2009年采集≥7岁研究对象的空腹血液样本12 mL,血液采集前3 d内研究对象保持正常生活模式,共收集血液生物标志物26项,详见网站http:∥www.cpc.unc. edu。本研究摘录的血液生物标志物如下:sUA、血肌酐(serum creatinine, sCr)、载脂蛋白α(Apoα)、载脂蛋白β(Apoβ)、TG、HDL-C、LDL-C、TC、脂蛋白A(LipoA)、血糖和HbA1c。
1.3 主要变量定义 根据CKD-EPI公式计算eGFR[9]。肾损伤定义为eGFR<60 mL/(min·1.73 m2)。HUA定义为男性sUA≥7 mg/dL或女性sUA≥6 mg/dL。BMI分类为瘦弱(<18.5 kg/m2)、标准(18.5~23.9 kg/m2)、超重(24.0~27.9 kg/m2)和肥胖(≥28.0 kg/m2)。

2 结 果
2.1 两组一般特征及糖脂代谢指标的比较 707例肾损伤患者中,HUA患病率为37.1%(262例)。HUA组男性占42.7%(112/262), 显著高于非HUA组的34.4%(153/445,P=0.027)。HUA组eGFR显著低于非HUA组(P<0.001)。HUA组受教育程度较高、存在代谢综合征、BMI较高、血脂紊乱的患者比例,以及舒张压水平和蛋白质摄入量均显著高于非HUA组(P值均<0.05)。见表1。HUA组Apoβ、TG、TC及血糖水平均显著高于非HUA组(P值均<0.05),HDL-C水平显著低于非HUA组(P<0.05)。见表2。
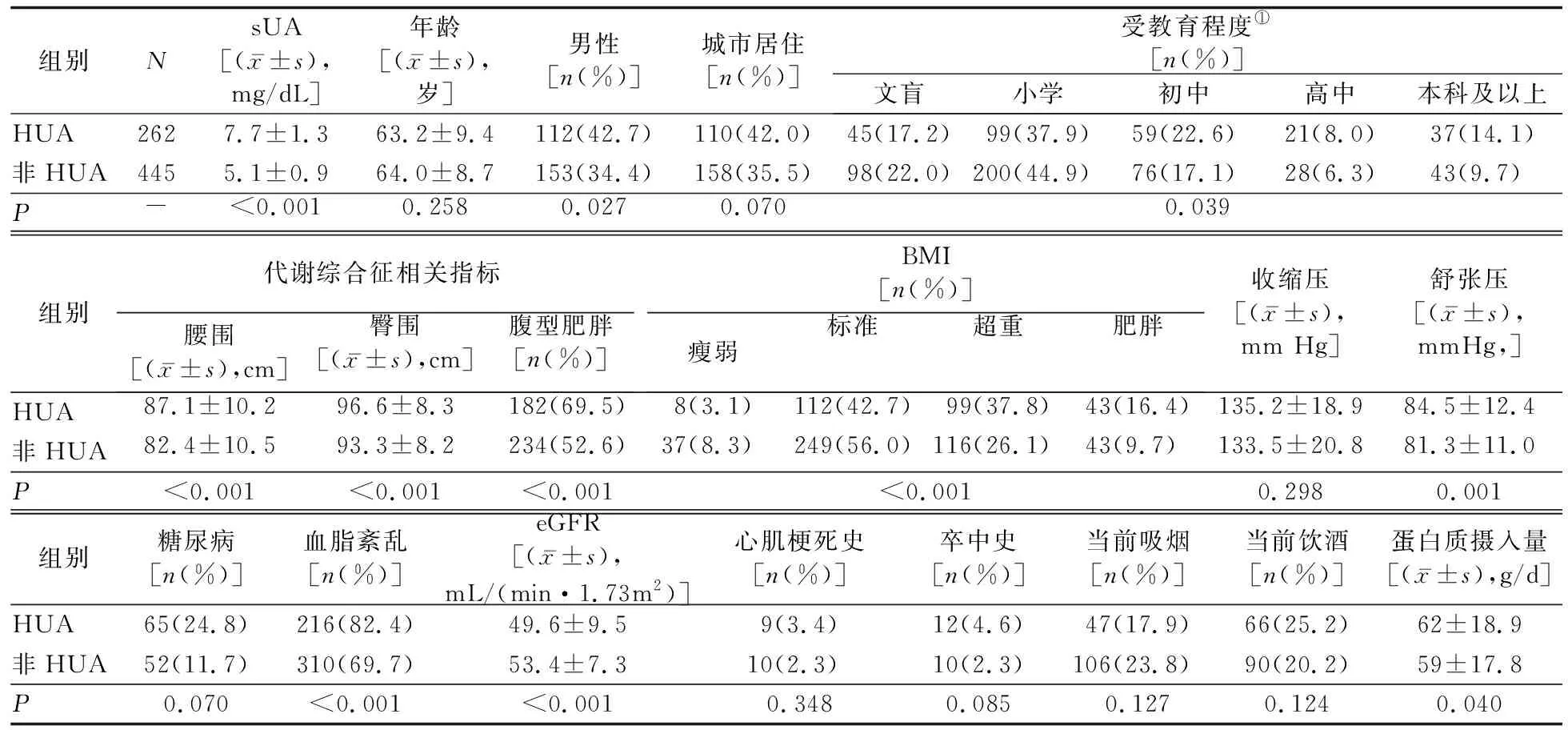
表1 两组患者的一般特征比较
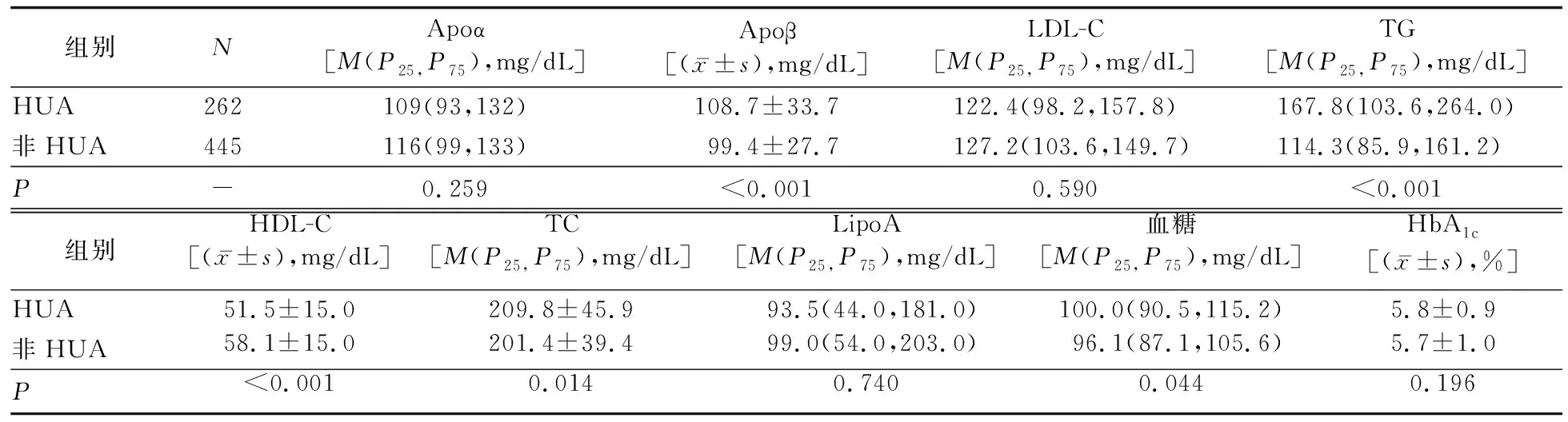
表2 两组糖脂代谢指标的比较
2.2 HUA与糖脂代谢指标的相关性分析 单因素logistic回归模型分析显示,sUA与Apoβ (OR=2.79,95%CI为1.61~4.82)、TG(OR=1.01,95%CI为1.00~1.01)和TC(OR=2.55,95%CI为1.18~5.50)水平均呈正相关(P值均<0.05),与HDL-C(OR=0.97,95%CI为0.96~0.98)水平呈负相关(P<0.05)。模型2和3进一步控制混杂因素后,Apoβ、TG 、TC和HDL-C与sUA的关联程度(即OR值)基本一致,血糖仅在多因素logistic模型中与sUA呈微弱的正相关(OR=1.01,95%CI为1.00~1.01)。见表3。在将sUA作为连续性变量与糖脂代谢的相关性分析中,sUA与Apoβ(r=0.17)、TG(r=0.31)、TC(r=0.12)和血糖(r=0.08)均呈正相关(P值均<0.05),与HDL-C呈负相关(r=-0.24,P<0.05)。见表4。

表3 糖脂代谢指标与HUA的logistic回归分析

表4 糖脂代谢指标与sUA的相关性分析
2.3 糖脂代谢指标与代谢综合征组分的相关性分析 校正年龄、性别、饮酒和吸烟因素后,Apoβ、TG、TC和血糖与BMI、腰围、臀围、腰臀比、收缩压及舒张压的关联程度呈多样性。其中,HDL-C与BMI、腰围、臀围、腰臀比呈独立负相关(P值均<0.05)。TG与BMI、腰围、臀围、腰臀比、收缩压、舒张压均呈独立正相关,且与BMI的关联程度最高(r=0.27,P<0.001),而TC仅与舒张压呈独立正相关(r=0.10,P=0.017)。见表5。
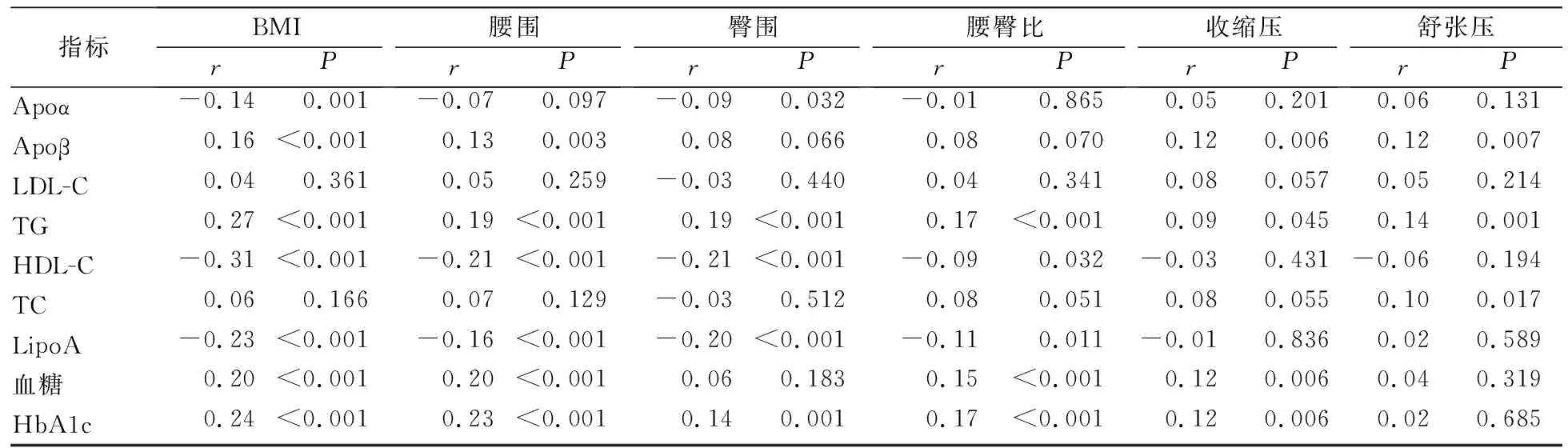
表5 糖脂代谢指标与代谢综合征组分的相关性分析
3 讨 论
当前HUA已成为全球重要的公共卫生问题。除外由HUA引起的痛风和关节损害的显性临床表现,HUA还会引发血管内皮损伤和肾脏慢性损害,促进胰岛素抵抗,增加糖尿病、代谢综合征、高血压、冠心病和脑卒中等的发生风险[10-13]。HUA通常先于代谢性疾病发生[14],因此,可将sUA作为全面评估心血管疾病的危险因素。在本研究的肾损伤患者中,Apoβ、TG、TC、血糖和HDL-C等糖脂代谢指标与HUA发生具有独立相关性。调整传统CVD风险因素后,上述指标与HUA的关联趋势稳定,提示sUA水平对糖脂代谢存在独立预测作用。
一项为期6年的人群随访研究[15]显示,TG可独立预测HUA的发生,并呈线性递增趋势,且两者交互增加心血管事件和肾损伤的发生风险。此外,针对中国人群的研究发现TC与HUA在女性人群中呈独立正相关[16]。一项中国人群大型队列研究[17]结果显示,TG/HDL-C比值与HUA发生风险呈正相关,且在女性和正常体重人群中具有显著性关联。基于欧美人群的研究[18]结果显示,Apoβ水平升高可增加HUA人群痛风的发生风险(风险比为5.6)。值得注意的是,仅在多因素模型中血糖与HUA发生的关联显著。而HbA1c作为受干扰因素较少的指标,与sUA均无统计学关联[19],提示血糖与sUA的调节机制可能受年龄、性别和生活方式等风险因素的影响。研究[20-21]发现,肾功能正常人群中血糖水平与sUA水平存在生物学关联,但本研究尚未明确两者的关系,未来仍需大样本队列研究进一步确认。
在本研究中,肾损伤患者HUA的患病率为37.1%,低于一项国内医院肾损伤患者HUA的患病率(52.0%)[22]。一项随访5年的研究[23]发现,高水平sUA增加日本社区人群LDL-C水平升高的风险,本研究未发现该关联,可能的原因为LDL-C易受生活方式和其他脂肪细胞异常的影响[24]。虽然,Apoβ是LDL-C的主要结构蛋白,本研究中肾损伤患者的Apoβ水平与sUA水平的关联性更为密切。此外,已有研究[25]提出,Apoβ是比LDL-C更稳定的CVD风险预测参数,进一步验证了本研究结论。
前期研究[26]提示,脂代谢标志物可以通过游离脂肪酸代谢降低肾小球滤过率,导致尿酸排泄障碍,同时胰岛素抵抗刺激肾脏对尿酸盐的重吸收,进一步促进sUA水平升高。此外,游离或结晶状态的尿酸盐都能诱导肝脏脂肪积累和葡萄糖产生,诱导脂肪组织介导的炎症失衡,引起亚临床炎症反应和胰岛素抵抗[27-28],进一步促进肾损伤的发生、发展[29]。本研究中,糖脂代谢分别与BMI、腰臀围、血压等代谢综合征指标呈不同程度关联,结合前期研究结果,本课题组推测中国社区肾损伤患者的Apoβ、TG、TC、血糖和HDL-C水平与HUA水平相互调控,可能直接参与代谢综合征的发生、发展,促进肾脏等靶器官的损伤。
前期研究中的对象多聚焦于住院患者,受用药、肾脏替代治疗和饮食等院内因素影响,结果仅能代表住院肾损伤人群。本研究样本覆盖中国9个省份或自治区(辽宁、江苏、山东、河南、湖北、湖南、广西、贵州和黑龙江),样本量大、代表性强、糖脂代谢相关指标完善,结果能够外推至肾损伤程度轻[本研究平均eGFR为(52.0±8.4) mL/(min·1.73 m2)]的多数社区人群。本研究尚存在局限性:①无因果推断,本研究为横断面研究,结果仅提示糖脂代谢指标与HUA的关联,但尚不能明确Apoβ、TG、TC和HDL-C是HUA的预测因子或仅为生物学标志物,且糖脂代谢的动态变化无法捕捉。②虽然已调整年龄、性别、血压、腰臀比、BMI、饮酒和吸烟作为协变量,仍有部分混杂因素(如体力活动、经济状况)未被纳入与校正。
虽然,近年来相关研究对HUA在代谢性疾病发生、发展中的关注度显著提高,但干预手段及控制目标未完全明确。本研究结果提示,应加强对存在HUA的肾损伤患者血液脂质水平的监测,以预防心血管等并发症的发生。未来仍需大型队列和机制研究验证糖脂代谢与HUA的因果关联、分子调控机制,以及有效降低sUA水平的治疗方案。
