从无到有:构建精子发生障碍诊疗体系)
2022-08-19欧宁静姚晨成
欧宁静 姚晨成 李 铮
针对精子发生障碍,依靠多学科研究团队,指导规范化样本收集,深入开展转化应用研究,建立体内体外干细胞分化的研究模型。以此为基础,制订精子发生障碍诊疗新路径,解析精子发生障碍表观遗传诊疗新靶点,建立人精原干细胞向单倍体精子细胞定向分化新体系,提出睾丸显微手术取精“三步法”,建立稀少或单精子冻存新方法。本研究团队的主要创新成果如下。
1 提出生精障碍诊疗新路径,制订男性不育诊疗指南与共识
男性不育的病因复杂,国内外尚无统一的诊疗流程,治疗效果参差不齐。在深入研究男性生殖系统病理生理学基础,总结男性不育临床诊疗经验后,李铮教授提出了无精子症“三分法”诊疗路径(图1),并编写《无精子症规范化诊疗专家共识》[1]。同时,在男性生殖系统发育的基础研究方面,本研究团队编写了高等教育教材《生殖系统》、全国高等学校医学规划教材《组织学与胚胎学》,主译《精子细胞:生成-成熟-受精-再生》。在临床方面,本研究团队总结相关文献及临床经验,编写了《精索静脉曲张诊疗专家共识》[2],建议将显微镜下精索静脉结扎术作为精索静脉曲张手术治疗金标准。2016年组织编写《Y染色体微缺失专家共识》,2017年组织成立中国Y染色体筛查质控联盟,2018年进行了全国第1次质控筛查,为国内Y染色体筛查的质控工作提供了标准。对于梗阻性无精子症,本研究团队组织编写了《射精管梗阻与精道内镜技术专家共识》[3],是该领域第1本诊疗共识,为国内单位开展此类项目提供了规范化诊疗流程。
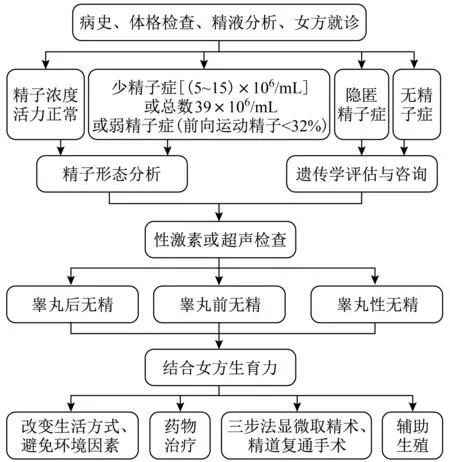
图1 男性不育“三分法”诊疗路径
2 构建生精障碍临床数据库, 解析精子发生障碍表观遗传诊疗新靶点
精子发生包括精原干细胞自我更新与分化、精母细胞减数分裂、精子细胞变形3个主要阶段[4],其中任一环节异常都可导致精子发生障碍。由于精子发生过程中调节机制相对复杂,目前关于人生精障碍的分子机制尚未被完全阐明。对于生精障碍主要集中于以小鼠为模型的研究中,但在临床实践过程中发现,导致人生精障碍的主要原因与小鼠存在差异;且人群之间亦存在异质性,增加了生精障碍的诊治难度。因此,建立5 000余例生精障碍的临床样本数据库(图2),为揭示人精子发生障碍和男性不育分子机制提供了更好的研究平台,也为解决实际临床问题奠定了基础。
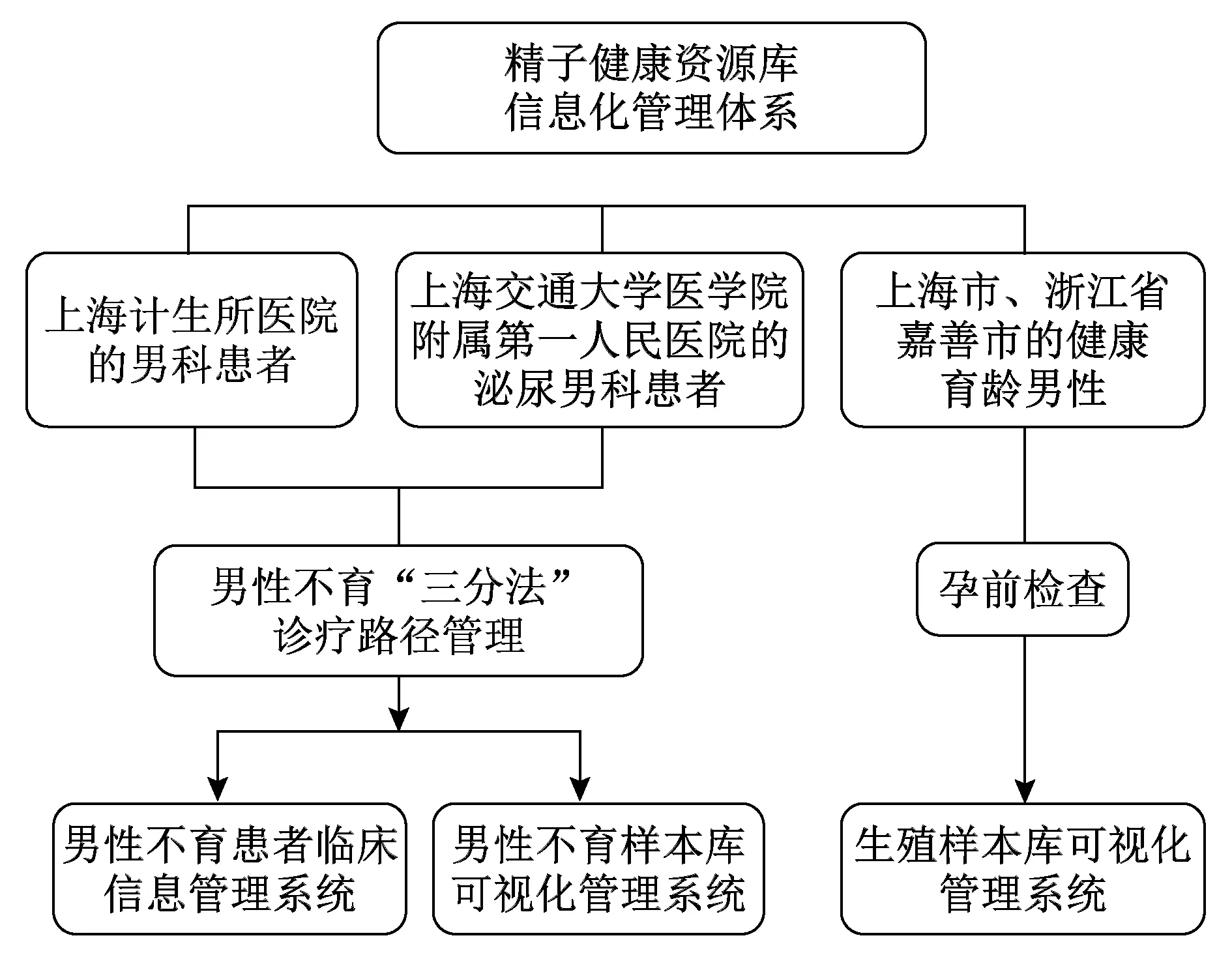
图2 精子健康资源库信息化管理体系建立流程
表观遗传学调控在精子发生中发挥重要作用,本研究团队基于前期建立的生精障碍临床样本数据库,探索精子发生障碍的表观遗传调控新位点。采用梯度密度方法,优化分选精子发生障碍患者的精原细胞、初级精母细胞、精子细胞系统(发明专利名称为“一种分离人精原干细胞的方法”,授权专利号为ZL201110321189.9),与精子发生正常者的同类细胞进行比较;经RNA深度测序后验证,在精原细胞中有显著差异的微RNA(microRNA)有396种,初级精母细胞中有395种,单倍体精子细胞中有375种,同时预测了重要microRNA调控基因靶点,并进行聚合酶链反应(polymerase chain reaction, PCR)验证。本研究项目基于人精子发生研究平台,从表观调控方面进一步认识了精子发生过程和无精子症的病因学机制,为男性不育的治疗提供新靶点[5]。
3 建立人精原干细胞体外诱导分化新体系,并证实其具有受精潜能
基于精子发生障碍睾丸组织库,建立干细胞与支持细胞相互作用的研究平台,探索精原干细胞定向分化模型。对于精子发生障碍患者的治疗,从其睾丸中获取精原干细胞,经体外培养诱导分化获取具有受精功能的精子,为精子发生障碍的研究建立体外分化新体系。本研究项目从隐睾患者的睾丸中获取干细胞,经视黄酸(RA)与干细胞因子(SCF)等条件培养基体外诱导培养,分选获取精子细胞;行精子细胞卵母细胞注射,证明其具备受精能力,并能发育至囊胚阶段[6];证明人精原干细胞能够体外分化为单倍体精子,并具备受精潜能(图3)。本研究团队在国际上首次报道,将隐睾患者的精原干细胞体外诱导定向分化为精子细胞,并证明其具备受精潜能,为临床治疗精子发生障碍提供了新的理论基础。
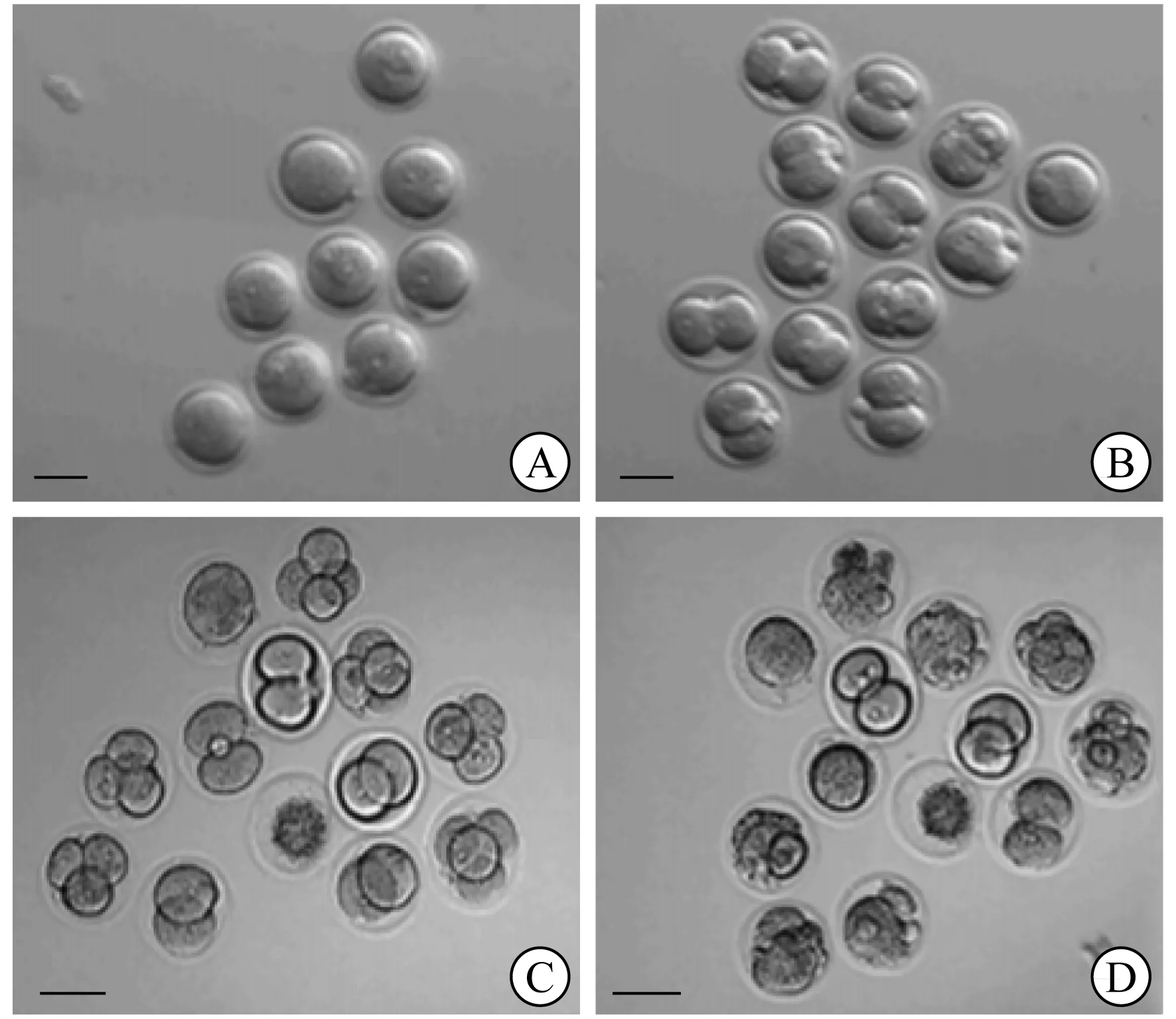
A 双原核胚胎 B 2细胞 C 4细胞 D 8细胞图3 隐睾患者精原干细胞培养为圆形精子卵泡内单精子注射(ICSI)后具备胚胎发育潜能
4 构建精子发生障碍治疗新技术
4.1 提出“三步法”取精手术体系 显微外科取精技术是近年无精子症治疗的里程碑,目前显微镜下睾丸取精术(micro-testicular sperm extraction,micro-TESE)是无精子症患者手术取精的“金标准”。相对于睾丸穿刺取精(testicular sperm aspiration,TESA)和睾丸活组织检查(简称活检)取精(testicular sperm extraction,TESE),micro-TESE的取精成功率较高,但睾丸切开大范围寻找精子,不可避免地会损伤部分血管及睾丸间质组织,可能影响睾丸血供,甚至导致睾丸内分泌功能减退,同时对于二次取精影响较大。通过回顾病例的资料及相关文献发现,不同病因非梗阻性无精子症(non-obstructive azoospermia, NOA)患者显微手术取精成功率的差异较大,如睾丸炎、克氏综合征、Y染色体AZFc区缺失患者显微手术取精成功率显著高于特发性无精子症患者[7-8]。因此,对于不同病因的患者选择不同的取精方式,以期在保证手术取精成功的同时,尽可能地减少手术给患者造成的损伤。本研究团队提出“三步法”取精手术体系(图4),对于手术取精成功率较高的患者,首先进行穿刺取精或小切口表面活检,穿刺找到精子,即停止进一步扩大切口;如穿刺取精未成功,则进行多点活检取精(multiple-testicular sperm extraction,multiple-TESE),其为传统切开取精的改良方法,于睾丸横轴同一平面不同部位多个小切口行活检取精,可在减少睾丸组织、血管损伤的同时,提高取精成功率;如multiple-TESE未成功,再进行micro-TESE,以期尽可能地提高取精成功率。
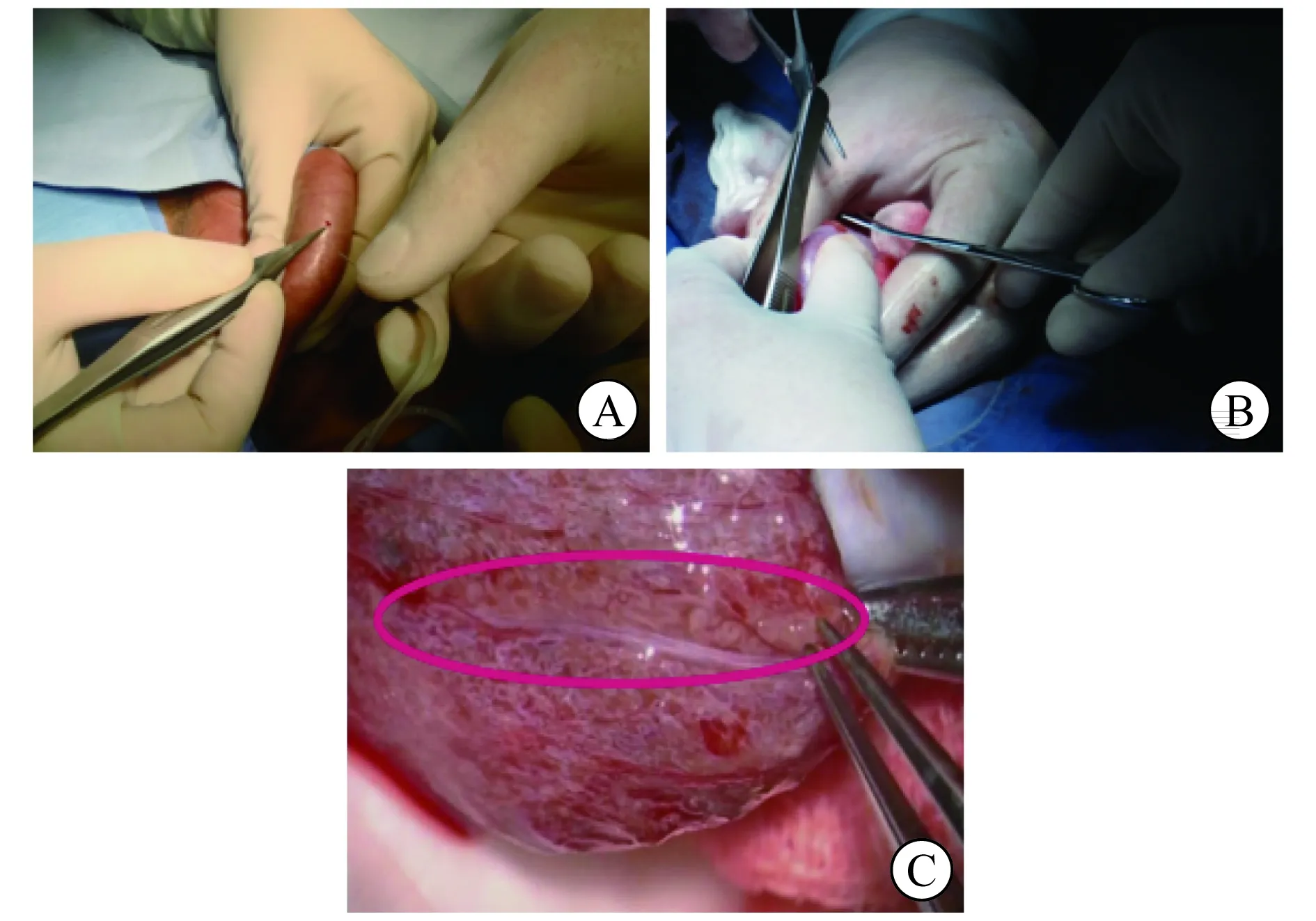
A TESA B multiple-TESE C micro-TESE图4 “三步法”取精手术体系
4.2 建立稀少精子冻存新方法 严重稀少精子实施冷冻保存是世界性难题,对于严重少精子症患者或经过治疗得到少量精子的NOA患者而言,稀少精子冷冻是结合辅助生殖技术,帮助患者生育健康子代的关键手段。精子对温度变化非常敏感,精子细胞膜容易在冷冻复苏过程中受损,本研究团队通过研究精子冷冻损伤机制,改进精子冷冻保存的方法和装置(发明专利名称为“液氮熏蒸冷冻及储运配子一体化装置”,授权专利号为ZL201210058038.5),探索出适合稀少精子冷冻保存的方法,即使用一种新型超细麦管结合稀少精子体外培养液,实现了对稀少精子冷冻保存(发明专利名称为“一种稀少精子体外培养液”,授权专利号为ZL201410270739.4)。与0.25 mL和0.5 mL麦管相比,超细麦管使稀少精子冷冻复苏后活力更高(超细麦管、0.25 mL麦管、0.5 mL麦管分别为38.5%、27.4%、25.6%),这种方法为严重少精子症及经过治疗精液中出现少量精子的“从无到有”患者提供了更好的生育力保存方法。
综上所述,本研究项目着眼于男性不育的基础与临床研究,主要针对严重少弱精子症、无精子症患者的生育力检测、诊断、治疗及精道重建等关键问题。找到新病因,阐明新机制,为推动中国男性不育患者的诊断和治疗提供更多的依据和方法。路漫漫其修远兮,本研究团队将上下求索,帮助患者实现从无精到有精。
