酵解黑莓提取物对HUVEC细胞氧化损伤的保护作用
2022-08-17姚凤丽孟少珂延海莹万国韶田迎樱杜春影
姚凤丽,孟少珂,延海莹,万国韶,杨 青,田迎樱,杜春影,王 鹏*
(1 中国海洋大学食品科学与工程学院 山东青岛 266003 2 中华人民共和国黄岛海关 山东青岛 266000 3 青岛海济润生生物科技有限公司 山东青岛 266000 4 山东省海洋食品营养研究院 山东威海 264200)
氧化-还原反应与多个复杂的生化过程相关,对于细胞稳态和宿主防御机制至关重要[1]。细胞内活性氧(ROS)水平是反映细胞氧化-还原状态的一项指标,正常情况下,细胞中存在的抗氧化剂和抗氧化酶可以及时清除ROS[2]。当细胞产生过多的ROS,超过其自我清除能力时,会使细胞抗氧化系统失衡,处于氧化应激状态,进而导致组织损伤和细胞死亡[3]。研究发现,氧化应激是许多生理和病理现象的基础,与炎症、衰老、癌症、心脑血管疾病、神经退行性疾病等密切相关[4]。
黑莓(Rubus fruticosus L.)在欧洲和北美广泛种植[5],近年来已逐渐引入中国。黑莓富含酚类物质,具有抗氧化、抗衰老、抑菌、抗肿瘤等多种活性。黄酮类是植物多酚最常见的类别之一,有6 个主要的亚类:花色苷、黄酮、黄酮醇、黄烷酮、黄烷醇和异黄酮[6]。花色苷可能是黄酮类物质中最受关注的分类,也是黑莓中具有代表性且含量较高的酚类化合物。花色苷具有良好的抗氧化活性,其中矢车菊素-3-葡萄糖苷可通过提高细胞活力,减少自由基氧化,增强抗氧化酶活力等,实现减轻细胞氧化应激损伤[7]。
植物多酚的提取及生物活性研究是天然活性物质开发领域的研究热点。甲醇或乙醇萃取法是从植物中分离酚类物质的常用方法,而溶剂萃取过程具有低生物安全性和环境污染等缺点[8]。酶解和发酵降解可以通过分解细胞壁基质来促进细胞内组分的溶出,在不产生有害杂质的同时,实现细胞内组分的高效提取。
黑莓营养丰富,风味独特,且富含多酚类生物活性物质,具有较高的利用价值。然而,黑莓鲜果极难贮存,目前黑莓的加工利用方式也较为单一,仅有冻果、果汁及发酵果酒等粗加工产品,形式较常见,因此研究黑莓加工工艺及生物活性成分具有重要意义。本研究针对酵解黑莓提取物,分析其成分组成,通过探究其对HUVEC 氧化损伤模型活性氧(ROS)和丙二醛(MDA)水平、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活力及细胞活力等指标的影响,评价其抗氧化能力,进而确定酵解工艺的可行性,为黑莓的高值化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黑莓,新鲜冻果,由青岛金凤凰庄园提供;酸性果胶酶,上海蓝季生物有限公司;矢车菊素-3-葡萄糖苷、96%甲酸、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜、叔丁基过氧化氢(t-BHP),美国Sigma 公司;HUVEC 细胞系,由山东省医学科学院基础医学研究所提供;DMEM 培养基,美国Gibco 公司;胎牛血清,杭州四季青公司;ROS 化学荧光试剂盒、LDH、T-AOC、SOD 和MDA 试剂盒,南京建城生物工程研究所;所有其它化学药品和试剂均为国产分析纯级。
1.2 仪器与设备
UV-6000PC 紫外-可见分光光度计,上海元析仪器有限公司;Agilent 1260 高效液相色谱仪、Agilent 6530 Q-TOF 质谱仪,美国安捷伦公司;Model680 型酶标仪,美国Bio-Rad 公司;IX51 型倒置荧光显微镜系统,日本Olympus 公司;DLCJ-1N 型超净工作台,北京东联哈尔仪器制造有限公司;BJ5060UV 型CO2培养箱,德国Heraeus公司。
1.3 样品制备
黑莓匀浆后按总质量0.5%的添加量加入酸性果胶酶,50 ℃下搅拌酶解1 h,按总质量0.03%的添加量加入乳酸菌,28 ℃下密闭发酵24 h,过滤并冻干后即为酵解黑莓提取物(BF)。黑莓匀浆、过滤、冻干,即为未酵解黑莓提取物(BH)。
1.4 基础成分测定
总糖含量通过苯酚-硫酸法测定,在波长490 nm 处比色[9]。可溶性蛋白质含量通过Folin-酚法测定[10]。总酸含量的测定参考GB/T 12456-2008《食品中总酸的测定》[11]。维生素C 含量的测定参考GB 14754-2010《食品添加剂维生素C(抗坏血酸)》[12]。总酚含量的测定采用Folin-Ciocalteau法[13]。总黄酮的测定采用NaNO2-Al(NO3)3-NaOH比色法[14]。花色苷的测定采用pH 示差法[15]。
鞣花酸含量参照Paterson 等[16]的方法,用HPLC 法测定。色谱柱:Agilent ZORBAX SB-C18色谱柱(5 μm,4.6 mm×250 mm);流动相:以甲醇(A)和0.2%的磷酸(B)为流动相,比例为45%A 和55%B;流速为1.0 mL/min,柱温为25 ℃,检测波长为254 nm,进样量为10 μL。
1.5 HPLC-MS 法测定花色苷组成
花色苷种类及含量使用配有1290 Infinity II光电二极管阵列检测器的Agilent 6530 Q-TOF质谱仪分析。色谱柱:ZORBAX SB-C18 色谱柱(5 μm,4.6 mm×250 mm)。流动相:以10%甲酸(A)和100%乙腈(B)作为流动相;洗脱梯度:0~0.5 min为96%~91%A,0.5~4 min 为91%A,4~10 min 内为91%~87%A,10~20 min 内为87%~70%A,20~30 min 内为70%~96%A;流速为1.0 mL/min,检测波长为524 nm;扫描方式:全扫描模式,扫描范围(m/z)20~2 000,周期为1.0 s。
1.6 t-BHP 诱导HUVEC 细胞氧化损伤模型的建立
用0.25%胰酶消化对数生长期的HUVEC 细胞,用DMEM 完全培养基(含10%胎牛血清,1×105U/L 青霉素,1×105μg/L 链霉素)配制成密度为5×105个/mL 的细胞悬液,按每孔100 μL 接种到96 孔板中,置于37 ℃,5%CO2的培养箱中培养。培养24 h 至细胞培养贴壁后,吸弃培养基。分别按50,100,200,300,400,500 μmol/L 的浓度加入t-BHP,每个浓度设置4 个复孔,每孔加样200 μL。继续培养4 h 后吸弃培养基,用MTT 法测定细胞活力。空白对照组细胞存活率设为100%,选择存活率接近50%时,t-BHP 的浓度为最佳作用浓度。
试验共设置6 组,分别是正常对照组(N)、模型组(M)、200 μg/mL BH 组(LBH)、200 μg/mL BF组(LBF)、400 μg/mL BH 组(HBH)和400 μg/mL BF 组(HBF)。细胞接种到96 孔板并黏附24 h 后,吸弃培养基,正常对照组和模型组每孔加入200 μL 培养基,其余各组加入200 μL 含对应浓度受试物的培养基,孵育24 h 后,吸弃液体,正常对照组每孔加入200 μL 培养基,其余各组每孔加入200 μL 300 μmol/L 的t-BHP,继续培养4 h 后,用MTT 法测定细胞活力。
1.7 ROS 的测定
细胞培养条件及受试物处理条件与1.6 节一致。细胞与受试物孵育并经t-BHP 处理后,在含有10 μmol/L 二氯二氢荧光素-乙酰乙酸酯(DCFH-DA) 的无血清DMEM 培养基中孵育45 min,弃去上清液,用PBS 缓冲液洗涤3 次,向每个孔中加入200 μL PBS,并使用荧光酶标仪检测吸光度,激发波长为485 nm,发射波长为525 nm。
1.8 细胞形态观察与LDH、MDA、T-AOC 和SOD 的测定
试验分组与1.6 节一致。取对数生长期的HUVEC 细胞,用DMEM 完全培养基配制成密度为5×105个/mL 的细胞悬液,加入6 孔培养板中,每孔2 mL。培养24 h 后,吸弃培养基,正常对照组和模型组加入2 mL 培养基,其余各组加入2 mL含对应浓度受试物的培养基。孵育24 h 后,吸弃液体,正常对照组每孔加入2 mL 培养基,其余5组每孔加入2 mL 300 μmol/L t-BHP,继续培养4 h,观察细胞形态并拍照,参照试剂盒说明书测定LDH 的含量。
细胞与受试物孵育并经t-BHP 处理后,收集细胞,冰浴破碎,按照对应试剂盒说明书测定细胞内MDA、T-AOC 和SOD 水平。
1.9 数据处理
使用Excel 和SPSS 22.0 进行数据处理,结果表示为 “平均值±标准差”;用单因素方差分析(ANOVA)进行显著性分析,以P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 基础成分
比较了BH 和BF 中不同成分的水平,以探究酵解过程对黑莓提取物成分的影响,结果如表1所示。BF 中总糖、可溶性蛋白质和维生素C 的含量与BH 中的差异不大,说明酵解过程未造成明显的营养物质损失。由于酶解和发酵过程破坏了细胞壁,促进了黄酮、花色苷及鞣花酸等酚类物质的溶出[17],BF 中总酚、总黄酮、花色苷及鞣花酸含量均显著高于BH(P<0.05),分别增加了43.4%,15.9%,41.7%,44.4%。

表1 BH 和BF 的成分对比Table 1 Composition comparison of BH and BF
2.2 花色苷组成
黑莓花色苷的HPLC 图有4 个主要峰(图1),结合表2中HPLC-MS 的鉴定结果,4 个峰分别是矢车菊素-3-葡萄糖苷(峰1,m/z 449/287)、矢车菊素-3-木糖苷(峰2,m/z 419/287)、矢车菊素-3-丙二酰葡萄糖苷(峰3,m/z 535/287)和矢车菊素-3-二草酰葡萄糖苷(峰4,m/z 593/287),这与Cho等[18]的结论一致。BF 中花色苷总含量及4 种花色苷含量均高于BH,说明酵解过程促进了花色苷的释放。与BH 相比,BF 中矢车菊素-3-葡萄糖苷含量增加最多,为63.7%,矢车菊素-3-木糖苷、矢车菊素-3-丙二酰葡萄糖苷和矢车菊素-3-二草酰葡萄糖苷的含量分别增加了41.2%,38.8%,32.9%。

图1 BH(a)和BF(b)中花色苷组分的HPLC 分析Fig.1 HPLC analysis of anthocyanins in BH (a) and BF (b)

表2 BH 及BF 的花色苷组成Table 2 Anthocyanin composition of BF and BH
2.3 t-BHP 最佳作用浓度
不同浓度的t-BHP 对HUVEC 细胞活力的影响如图2所示。不同浓度的t-BHP 作用于HUVEC 细胞4 h 后,细胞活力均有所下降,且呈现剂量依赖性。t-BHP 浓度为300 μmol/L 时,细胞活力最接近50%。因此,选择300 μmol/L 作为t-BHP 诱导HUVEC 细胞氧化损伤的最佳作用浓度。

图2 t-BHP 浓度对HUVEC 细胞活力的影响Fig.2 Effects of t-BHP concentration on the cell viability of HUVEC
2.4 BH 和BF 对细胞形态的影响
图3显示了不同样品对HUVEC 细胞形态的影响。正常对照组的HUVEC 细胞表面光滑,具有长突触。用t-BHP 处理的HUVEC 细胞呈圆形,呈现突触萎缩和氧化损伤,表明成功建立了氧化应激模型。BH 和BF 处理均能预防氧化损伤并维持细胞形态。BF 组圆形细胞占比少于BH 组,表明酵解黑莓提取物能更有效地减少t-BHP 对细胞结构的破坏损害,维持细胞正常形态。

图3 BH 和BF 对HUVEC 细胞形态的影响Fig.3 Effects of BH and BF on the morphology of HUVEC
2.5 BH 和BF 对细胞活力的影响
不同处理方式对HUVEC 细胞活力的影响如图4所示,模型组经t-BHP 处理后,细胞活力降低至正常对照组的51.3%。BH 和BF 均能显著提高细胞活力(P<0.05),且作用具有剂量依赖性。付鑫景[19]研究发现,黑米中的多酚类物质可减轻H2O2引起的氧化应激,提高细胞活力,并表现出剂量依赖性。HBF 组细胞活力显著高于HBH 组(P<0.05),相较模型组分别提高了38.7%和44.7%,表明BF 能更有效地减轻细胞的氧化应激损伤,防止细胞死亡,这与酵解过程中酚类物质释放量增加有关。

图4 BH 和BF 对细胞活力的影响Fig.4 Effects of BH and BF on cell viability
2.6 BH 和BF 对ROS 的影响
如图5所示,模型组t-BHP 处理显著增加了细胞内ROS 水平。Fallah 等[20]的研究表明,花色苷可通过降低ROS 含量来阻断NF-κB 途径,从而减少炎症和氧化应激。BH 和BF 处理均能降低ROS 相对含量,表明BH 和BF 中的花色苷可以抑制ROS 积累,且在一定浓度范围内其作用效果与样品浓度呈正相关。HBF 组ROS 释放量显著低于HBH 组(P<0.05),分别较模型组降低了41.3%和56.5%。上述结果表明,酵解过程中黑莓花色苷的释放增强了提取物对ROS 积累的抑制效果。
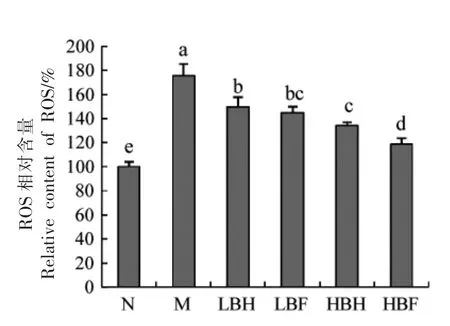
图5 BH 和BF 对ROS 的影响Fig.5 Effects of BH and BF on ROS
2.7 BH 和BF 对LDH 的影响
LDH 位于细胞质内,是糖酵解过程中的重要酶之一,当细胞受到氧化损伤时,细胞膜结构被破坏,LDH 被释放到细胞外,因此上清液中LDH 水平可以反映细胞的损伤程度[21]。用t-BHP 处理后,上清液中LDH 含量显著增加,表明t-BHP 引起HUVEC 细胞膜损伤并导致LDH 释放。BH 和BF均显著抑制LDH 释放(P<0.05),说明BH 和BF都能减少t-BHP 对HUVEC 细胞的损伤,保护细胞膜完整性。HBH 组和HBF 组LDH 释放量比模型组分别降低了38.3%和44.2%,表明BF 对细胞膜结构的保护效果更好。
2.8 BH 和BF 对MDA 的影响
MDA 是由氧化应激引起的脂质过氧化的产物,细胞内MDA 水平能够反应细胞膜的脂质过氧化程度[22]。如图7所示,模型组MDA 水平显著高于正常对照组,说明t-BHP 处理可以诱发HUVEC 细胞脂质过氧化。游庭活[23]研究发现,桑葚多酚类化合物具有很好的抗氧化活性,可以有效抑制脂质过氧化,降低D-半乳糖诱导的衰老小鼠血清及脑、肝脏和心脏组织中MDA 含量。与模型组相比,BH 和BF 处理均以剂量依赖性方式显著降低MDA 水平,且400 μg/mL BF 作用下,细胞内MDA 水平与正常对照组差异不显著(P>0.05),说明黑莓提取物中的多酚类物质对细胞膜脂质过氧化有显著的抑制作用,且酵解过程有效提高了其抑制脂质过氧化的能力。

图6 BH 和BF 对LDH 的影响Fig.6 Effects of BH and BF on LDH

图7 BH 和BF 对MDA 的影响Fig.7 Effects of BH and BF on MDA
2.9 BH 和BF 对T-AOC 和SOD 的影响
T-AOC 代表总抗氧化剂水平,SOD 是清除细胞内自由基的关键酶。BH 和BF 对HUVEC 细胞中抗氧化系统的作用可以通过T-AOC 和SOD 活力来表征。如图8所示,模型组的T-AOC 和SOD水平显著低于正常对照组,说明在氧化应激状态下,细胞抗氧化系统功能受损。与模型组相比,400 μg/mL 的BH 和BF 均可显著增加T-AOC 水平,且400 μg/mL BF 组T-AOC 水平显著高于同浓度BH 组。同时,BH 和BF 处理能够以剂量依赖的方式提高SOD 活力,且相同浓度下BF 组SOD活力稍高于BH 组。Wu 等[24]研究发现,甜樱桃花色苷可通过增加SOD 和谷胱甘肽过氧化物酶(GSH)的活力来抑制氧化应激。本文所采取的酵解工艺促进了花色苷的溶出,使酵解黑莓提取物对细胞抗氧化系统的保护作用增强。

图8 BH 和BF 对T-AOC(a)和SOD(b)的影响Fig.8 Effects of BH and BF on T-AOC (a) and SOD (b)
3 结论
本研究通过对2 种黑莓提取物BH 和BF 的主要成分进行对比分析,发现BF 的总糖、可溶性蛋白质、维生素C 等营养成分含量与BH 相当,总酚、总黄酮、花色苷和鞣花酸含量显著高于BH,其中矢车菊素-3-葡萄糖苷含量比BH 高63.7%,表明酵解过程有助于黑莓活性物质的溶出。BF 对t-BHP 诱导的HUVEC 细胞氧化应激损伤具有很好的保护作用,可以维持氧化应激状态下HUVEC细胞的正常形态,抑制ROS 积累,保护细胞膜完整性,抑制脂质过氧化并提高细胞内抗氧化酶活力。该酵解工艺促进了花色苷等酚类活性物质的释放,提高了黑莓提取物的抗氧化能力,因此相同浓度下BF 对HUVEC 细胞氧化损伤的保护作用优于BH。本研究证明了酵解工艺的可行性,在分析提取物成分的基础上,深入分析了其抗氧化能力,为黑莓的高值化利用提供理论依据。
