肿瘤患者血浆D-二聚体、FDP、抗凝血酶Ⅲ活性的测定及其临床价值分析
2022-08-17田丽平
田丽平
大庆市中西医结合医院机关,黑龙江大庆 163000
肿瘤是指人体在各种致瘤因子作用下,局部组织细胞增生而形成,多呈现占位性的块状凸起,故而也被称为赘生物[1]。与正常细胞代谢相比,肿瘤细胞能够通过糖酵解和氧化磷酸化之间转化来适应代谢环境的改变,因此肿瘤细胞生存能力远高于正常细胞,难以被灭杀[2]。目前,临床将肿瘤依照细胞特性与机体危害程度分为良性肿瘤与恶性肿瘤两类,良性肿瘤生长缓慢、不转移,通常经相应治疗后即可痊愈,对患者生命安全无威胁;而恶性肿瘤生长迅速,多侵袭性生长,与周围组织粘连,且易转移,即使采取相应治疗,也存在复发可能,对患者生命安全威胁较大[3]。因此,临床对肿瘤鉴别诊治工作尤为重视。近年来,诸多研究证实,血浆D-二聚体(D-dimer,DD)、纤维蛋白(原)降解产物(fibrinogen degradation products,FDP)、抗凝血酶Ⅲ(antithrombin-Ⅲ,AT-Ⅲ)活性与肿瘤发生发展关联密切,检测D-D、FDP、AT-Ⅲ水平可有效鉴别诊断肿瘤性质,观察肿瘤严重程度,并评估患者预后,引发了广泛的关注[4-6]。对此,本文选择2018 年12 月—2020 年12 月大庆市中西医结合医院接收肿瘤患者200 例,探究肿瘤患者血浆D-D、FDP、AT-Ⅲ活性测定的临床价值,现报道如下。
1 资料与方法
1.1 一般资料
选择本院肿瘤科接收肿瘤患者200 例作为研究对象,依照患者肿瘤性质分为良性组(n=100)和恶性组(n=100)。良性组中男56 例、女44 例;年龄42~76岁,平均(60.28±6.42)岁;肿瘤类型:肺部肿瘤28 例、胃部肿瘤23 例、乳腺肿瘤17 例、头颈部肿瘤16 例、其他肿瘤16 例。恶性组中男55 例、女45 例;年龄43~78 岁,平均(60.26±6.43)岁;肿瘤类型:肺部肿瘤27 例、胃部肿瘤23 例、乳腺肿瘤18 例、头颈部肿瘤17 例、其他肿瘤15 例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会批准。
1.2 纳入与排除标准
纳入标准:①患者均确诊肿瘤,符合诊断标准[7]。②患者临床资料完整。③患者及家属均知情同意。
排除标准:①合并血液系统疾病患者。②重要脏器功能严重损伤患者。③检查依从性较差患者。
1.3 方法
两组患者均行血浆D-D、FDP、AT-Ⅲ活性测定,具体过程如下:检查前,由检测人员指导患者做好相应准备工作,于次日清晨空腹状态下抽取静脉血液4 mL,先行枸橼酸钠抗凝,并使用离心机离心处理,离心机速率3 000 r/min,离心时长10 min,弃上清,而后使用德国美创血凝仪Coatron3000 及北京美创液体血凝相关试剂检测FDP、血浆D-D、AT-Ⅲ活性,检测过程全程严格遵照仪器说明书进行;且德国美创血凝仪Coatron3000经校准合格,北京美创液体血凝试剂质控检测合格。
1.4 观察指标
比较两组患者血浆D-D、FDP、AT-Ⅲ活性水平,并分析不同分期恶性肿瘤患者3 项指标水平的差异。①血浆D-D 正常范围参考:<0.5 mg/L;FDP 正常范围参考:<10 mg/L;AT-Ⅲ活性正常范围参考:80%~120%[8]。②分期标准遵照《国际抗癌联盟(UICC)第8版肺癌分期方案的验证》[9]、中国(第七届)肿瘤微创治疗学术大会[10]提出的相关标准。
1.5 统计方法
采用SPSS 26.0 统计学软件处理数据,计量资料符合正态分布,以(±s)表示,组间差异比较采用t检验;计数资料以频数和百分率(%)表示,组间差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血浆D-D、FDP、AT-Ⅲ活性水平比较
恶性组血浆D-D、FDP水平高于对照组,AT-Ⅲ活性低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
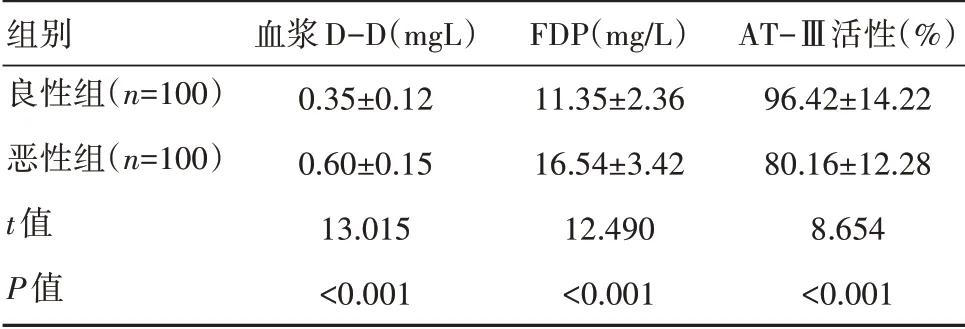
表1 两组患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
组别良性组(n=100)恶性组(n=100)t值P值血浆D-D(mgL)0.35±0.12 0.60±0.15 13.015<0.001 FDP(mg/L)11.35±2.36 16.54±3.42 12.490<0.001 AT-Ⅲ活性(%)96.42±14.22 80.16±12.28 8.654<0.001
2.2 恶性肿瘤患者肿瘤分期分析
恶性肿瘤患者肿瘤分期分为TNM 分期、T 分期和N分期,各分期例数见表2。
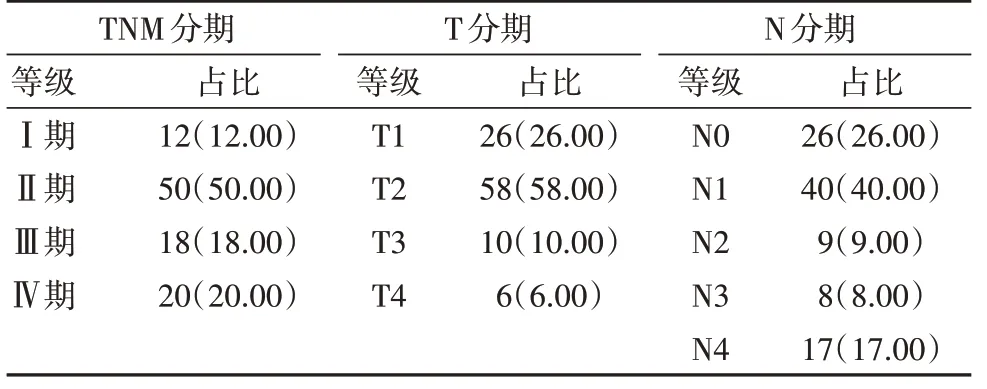
表2 恶性肿瘤患者肿瘤分期分析[n(%)]
2.3 恶性肿瘤不同TNM 分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较
不同TNM 分期的恶性肿瘤患者TNM 分期越高,血浆D-D、FDP 越高,AT-Ⅲ活性越低,差异有统计学意义(P<0.05)。见表3。
表3 不同TNM分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)

表3 不同TNM分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
注:*表示同I期同指标水平比较,P<0.05;#表示同Ⅱ期同指标水平比较,P<0.05;µ表示同Ⅲ期同指标水平比较,P<0.05
TNM分期Ⅰ期(n=12)Ⅱ期(n=50)Ⅲ期(n=18)Ⅳ期(n=20)F值P值血浆D-D(mg/L)0.53±0.05(0.57±0.06)*(0.61±0.06)*#(0.67±0.07)*#µ6.638 0.008 FDP(mg/L)13.22±1.22(16.42±1.42)*(18.22±1.51)*#(20.13±1.64)*#µ8.164<0.001 AT-Ⅲ活性(%)86.67±6.42(82.15±4.63)*(76.14±4.58)*#(73.12±4.55)*#µ8.128<0.001
2.4 恶性肿瘤不同T分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较
恶性肿瘤患者T 分期越高,FDP 水平越高,差异有统计学意义(P<0.05)。见表4。
表4 不同T分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
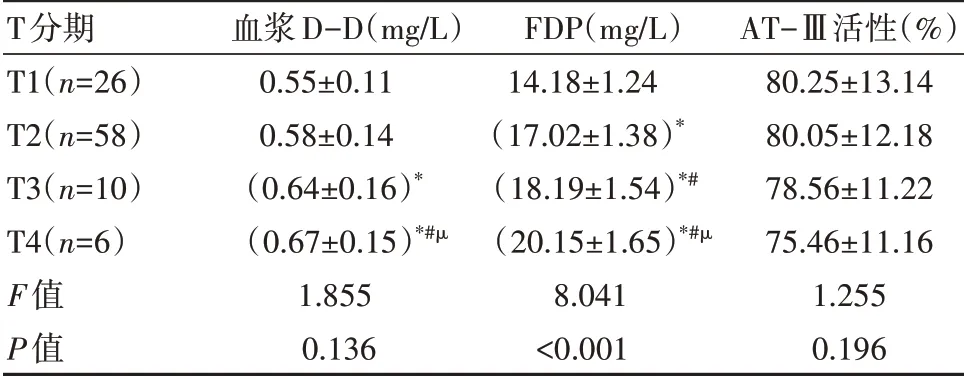
表4 不同T分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
注:*表示同T1 期同指标水平比较,P<0.05;#表示同T2 期同指标水平比较,P<0.05;µ表示同T3期同指标水平比较,P<0.05
T分期T1(n=26)T2(n=58)T3(n=10)T4(n=6)F值P值血浆D-D(mg/L)0.55±0.11 0.58±0.14(0.64±0.16)*(0.67±0.15)*#µ1.855 0.136 FDP(mg/L)14.18±1.24(17.02±1.38)*(18.19±1.54)*#(20.15±1.65)*#µ8.041<0.001 AT-Ⅲ活性(%)80.25±13.14 80.05±12.18 78.56±11.22 75.46±11.16 1.255 0.196
2.5 恶性肿瘤不同N 分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较
恶性肿瘤患者N 分期越高,FDP 水平越高,差异有统计学意义(P<0.05)。见表5。
表5 不同N分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
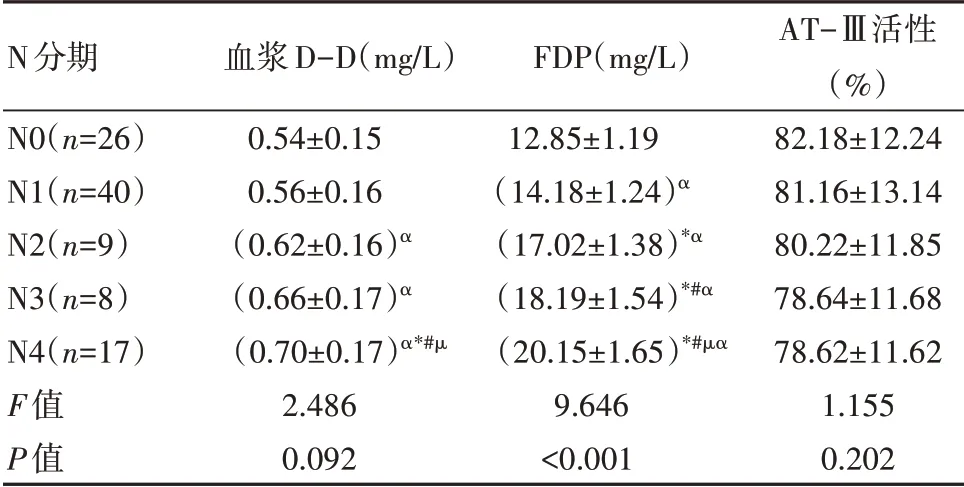
表5 不同N分期患者血浆D-D、FDP、AT-Ⅲ活性水平比较(±s)
注:α表示同N0 期同指标水平比较,P<0.05;*表示同N1 期同指标水平比较,P<0.05;#表示同N2 期同指标水平比较,P<0.05;µ表示同N3期同指标水平比较,P<0.05
N分期N0(n=26)N1(n=40)N2(n=9)N3(n=8)N4(n=17)F值P值血浆D-D(mg/L)0.54±0.15 0.56±0.16(0.62±0.16)α(0.66±0.17)α(0.70±0.17)α*#µ2.486 0.092 FDP(mg/L)12.85±1.19(14.18±1.24)α(17.02±1.38)*α(18.19±1.54)*#α(20.15±1.65)*#µα 9.646<0.001 AT-Ⅲ活性(%)82.18±12.24 81.16±13.14 80.22±11.85 78.64±11.68 78.62±11.62 1.155 0.202
3 讨论
相关研究表明,恶性肿瘤浸润和血管生成均与凝血/纤溶相关细胞和因子存在联系[11-12]。其中肿瘤细胞起牵头作用,组织因子、癌促凝因子活化凝血酶原,从而促进肿瘤浸润、转移。且肿瘤发展、凝血相关因子、细胞活化间可形成恶性的循环,故能够通过检测凝血相关因子、间质表皮转化因子等指标鉴别诊断肿瘤[13-14]。
本研究中,恶性组患者血浆D-D(0.60±0.15)mg/L、F D P(1 6.54±3.42)mg/L 水平高于对照组,AT-Ⅲ活性(80.16±12.28)%低于对照组(P<0.05)。由此可见,不同性质的肿瘤患者血浆D-D、FDP、AT-Ⅲ活性等指标水平也存在较大差异,与既往研究结果大致相同。张夏等[15]对多发性骨髓瘤初诊患者40 例进行研究,结果显示,初诊患者D-D(6.94±3.84)mg/L、FDP(45.33±27.08)µg/L 水平高于健康人,AT-Ⅲ活性(64.65±16.49)%低于健康人(P<0.05),这与该研究结果大致相同。
D-D是人体中最简单的纤维蛋白降解产物。正常情况下,人体D-D 水平多维持在较低的水平,当恶性肿瘤发生后,患者机体可逐渐发展出高凝状态,并引起继发性的纤溶亢进,从而提升D-D 水平。也因此,D-D指标被认为是弥漫性血管内凝血、新鲜血栓形成诊断的高敏感性指标[16]。FDP 则是纤维蛋白原、纤维蛋白被血浆素分解后产生的降解物质,该物质具有抑制纤维蛋白形成的作用,还能够抗凝血酶、抑制血小板粘附聚集和释放[17]。但也有研究表明,人体FDP 含量与体内纤溶活性强度关联密切,FDP能够为肿瘤浸润、转移提供支架作用,促使肿瘤细胞、血小板黏附和结合更为紧密,从而促进恶性肿瘤细胞的浸润、转移[18]。而AT-Ⅲ则是一种丝酶抑制蛋白,能够不可逆地抑制组织因子与部分凝血因子结合形成的复合体,并于凝血酶相结合,使该复合体灭活,发挥抗凝调节作用[19]。
不同TNM 分期的恶性肿瘤患者分期越高,血浆D-D、FDP 越高,AT-Ⅲ活性越低(P<0.05)。恶性肿瘤患者T分期、N 分期越高,FDP水平越高(P<0.05)。由此可见,不同分期的恶性肿瘤患者血浆D-D、FDP、AT-Ⅲ活性水平也存在一定的差异。恶性肿瘤患者恶性肿瘤细胞纤溶酶水平较高,且肿瘤细胞能够分泌大量的Fbg 激活物,溶解纤维蛋白,从而提升D-D 水平;而肿瘤细胞又可与患者血管内皮细胞以及血小板发生相互的作用,分泌血管生成因子,激活血小板,从而提升FDP 水平;此外,恶性肿瘤易引起脏器功能的衰竭,导致凝血及抗凝血系统失衡,凝血因子大量激活,消耗AT-Ⅲ,从而降低AT-Ⅲ的活性[20]。
但本研究纳入患者样本数量较少,且纳入患者均为该院收治患者,受我国区域性因素肿瘤发生发展因素影响,纳入患者无法作为临床肿瘤患者发生标准,研究结果准确性和实用性尚待验证。该院将在今后工作中继续检测血浆D-D、FDP、AT-Ⅲ活性水平,后续纳入更多的肿瘤患者样本,进行深入的研究和分析,以提高结果准确性和实用性,为临床提供更多的参考。
综上所述,测定肿瘤患者的血浆D-D、FDP、AT-Ⅲ活性意义重大,能够为肿瘤分期、性质鉴别提供依据,利于治疗方案的制订,值得推广。
