SARS-CoV-2 刺突蛋白受体结合域的可溶性表达及功能鉴定
2022-08-17杨洵金佳佩马家秀卢卉双蔡雪飞
杨洵,金佳佩,马家秀,卢卉双,蔡雪飞
重庆医科大学感染性疾病分子生物学教育部重点实验室,重庆 400016
目前,全球共计215个国家和地区受到新型冠状病毒肺炎(Coronavirus Disease 2019,COVID-19)疫情的影响。COVID-19 住院患者死亡率高达16.9%[1],给人类社会带来极大的健康威胁和经济损失。COVID-19 的致病菌为严重急性呼吸综合征冠状病毒 2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2),其为β 属冠状病毒,是有包膜的正向单链RNA 病毒,基因组全长为29 891 bp,编码包含多聚糖蛋白(orf1 /ab)、刺突蛋白(spike protein,S)、小包膜蛋白(envelope protein,E)、膜糖蛋白(membrane protein,M)、核衣壳蛋白(nucleocapsid protein,N)等在内的20 余种蛋白质[2-3]。刺突蛋白为一种糖蛋白,含1 273个氨基酸,相对分子质量约为141 000[4]。其活性形式为三聚体,由两个亚单位S1 和S2 组成。S1 亚基包含受体结合域(recepter binding domain,RBD),有助于病毒识别宿主细胞表面的血管紧张素转换酶 2(angiotensin-converting enzyme 2,ACE2)[5];S2 亚基介导病毒颗粒与宿主细胞的膜融合过程,有助于病毒入胞[6]。冠状病毒的S2 亚基保守性较高,而S1 亚基很易发生突变,并由此决定宿主的种属特异性、致病性及传播方式[7]。根据目前对SARS-CoV和MERS-CoV 的研究,S 蛋白是引发机体免疫反应的主要抗原,因此成为疫苗和抗病毒特效药开发的重要靶点。利用S 蛋白开发的抗病毒药物主要包括阻断S1、S2 亚基剪切的蛋白酶抑制剂、RBD-ACE2阻断剂、膜融合抑制剂和siRNA 等[8-9]。本研究对S蛋白RBD 区进行原核可溶性表达,以期为后续抗病毒特效药的开发及疫苗大规模接种后的评价奠定基础。
1 材料与方法
1.1 菌株、载体、细胞及血清 大肠埃希菌Rosetta 由中国科技大学臧建业教授惠赠;大肠埃希菌DH5α和原核表达载体pGEX 6P-1 为本实验室保存;过表达ACE2 的HEK293 细胞为本实验室唐霓教授课题组惠赠;康复期患者血清由本实验室龙泉鑫教授捐献[10];正常人血清由本课题组健康献血员捐献。
1.2 主要试剂及仪器 鼠抗SARS-CoV-2 RBD 单克隆抗体、GST 重组蛋白为本课题组保存;限制性内切酶BamHⅠ、HindⅢ和T4 DNA 连接酶均购自美国NEB 公司;DNA 聚合酶 PrimerStar、DNA marker 2000和digested EcoT14 DNA ladder 均购自日本TaKaRa公司;质粒小量纯化试剂盒、胶回收和PCR 产物纯化试剂盒均购自广州美基生物科技有限公司;ACE2重组蛋白(Cat:D621624)、细胞裂解液(RIPA Lysis Buffer)、IPTG、脱脂奶粉、氨苄青霉素、卡那霉素和蛋白预染分子量标准(Protein Prestain marker)均购自生工生物工程(上海)股份有限公司;溶菌酶购自美国Solarbio 公司;蛋白酶抑制剂(Complete Tablets,mini-EDTA free,EASYpack)购自瑞士 Roche 公司;重组 ACE2 兔源单克隆抗体[EPR4436](ab208109)购自英国 Abcam 公司;BCA 试剂、GST 兔源单克隆抗体(Cat:AG768)购自上海碧云天生物技术有限公司;HRP 标记的羊抗人IgG 购自天津三箭生物技术公司;HRP 标记的羊抗鼠和羊抗兔IgG 均购自美国BBI 生命科学公司;Glutathione Sepharose 4B beads和 PVDF 膜(0.22 μm)均购自美国 GE Healthcare life science 公司;ECL 显色试剂购自重庆葆光生物技术有限公司;凝胶成像系统(ChampChemi500)购自北京赛智创业科技有限公司;蛋白电泳和转印系统(Bio-Rad Protean MP4+)购自美国 Bio-Rad 公司;超声波细胞破碎仪(Sonics Material VCX750)购自美国Sonics Material 公司;多功能酶标仪(Synergy H1)购自美国BioTek 公司。
1.3 RBD 区序列的优化 从GenBank 中获得SARSCoV-2 的全长基因组序列(NCBI Reference Sequence:NC_045512.2),选取刺突蛋白(spike protein)RBD区的 DNA 序列(22 524-23 255 nt),利用 http:/ /www.jcat.de / 网站在线工具,将 RBD 区 DNA 序列中大肠埃希菌的稀有密码子进行优化替换。
1.4 重组表达质粒的构建 优化后的RBD 基因序列由擎科生物技术有限公司进行DNA 全序列体外合成,用T4 DNA 连接酶将RBD 基因序列与pGEX 6P-1 原核表达载体连接,转化大肠埃希菌DH5α,通过菌落PCR 筛选阳性克隆。提取质粒DNA,用BamHⅠ和HindⅢ双酶切鉴定,阳性克隆送擎科生物技术有限公司测序。将获得的含有RBD 基因的表达质粒命名为pGEX 6P-1 / RBD。
1.5 重组RBD 蛋白的诱导表达及纯化 将pGEX 6P-1 / RBD 重组质粒转化大肠埃希菌 Rosetta 感受态细胞,均匀涂布于含 100 μg / mL Amp 的 LB 固体培养基,37 ℃培养14 ~16 h;挑取单菌落接种于2 mL含 100 μg / mL Amp 的 LB 液体培养基,37 ℃培养12 h;吸取阳性菌培养液,用含 100 μg / mL Amp 的LB 液体培养基扩大50 倍体积,培养至A600为0.6时,取1 mL 菌液作为对照,其余菌液加入终浓度为0.1 mmol / L 的 IPTG,25 ℃继续培养 6 h;收集菌体,0 ℃冰浴条件下,超声破菌5 min(200 W,超声3 s,间隔 6 s),破菌全液于 4 ℃,13 804 × g 离心 20 min,分离破菌上清液和沉淀。破菌上清液中加入适量Glutathione Sepharose 4B 凝胶,4 ℃颠倒混匀 30 min,将混合物加入重力柱,过滤除去液体部分,用50 倍填料体积的溶液 A(20 mmol / L Tris-HCl,pH 8.8,300 mmol / L NaCl)洗涤,最后用 5 倍填料体积的蛋白洗脱液(20 mmol /L Tris-HCl,pH 8.8,300 mmol / L NaCl,100 mmol / L 还原型谷胱甘肽)洗脱柱上结合的蛋白,蛋白洗脱液置于0 ℃冰浴中保存,BCA 法测定纯化蛋白浓度。
1.6 重组RBD 蛋白的Western blot 分析 取纯化阶段各步骤的蛋白样品,经12% SDS-PAGE 分离后,电转印至PVDF 膜,用含5%脱脂奶粉的TBST 溶液室温封闭 1 h;TBST 洗膜 10 min,共 3 次,加入鼠抗RBD 单克隆抗体(1 ∶1 500 稀释)或 GST 标签抗体(1 ∶10 000 稀释),4 ℃孵育过夜;加入 HRP 标记的羊抗鼠 / 羊抗兔 IgG(1 ∶10 000 稀释),室温孵育 2 h;加入ECL 发光液,化学发光成像仪器显影曝光。
1.7 重组RBD 蛋白与ACE2 蛋白的Pull-down 结合试验 收集培养2 d 的过表达ACE2 的HEK293细胞,加入RIPA-PI 裂解液,摇床冰浴裂解20 min;4 ℃,13 804 × g 离心 20 min 后保存上清,BCA 法检测细胞裂解液总蛋白浓度。向含500 μg 总蛋白的细胞裂解液中加入30 μL Glutathione Sepharose 4B 凝胶,4 ℃混匀 1 h,将上清液移入新 EP 管,加入 50 μg纯化的 RBD 蛋白,4 ℃混合 2 h;再加入 60 μL Glutathione Sepharose 4B 凝胶,4 ℃混合 1 h;弃上清,洗涤3 次 beads,加入 30 μL 蛋白 Loading buffer,沸水浴10 min,设置GST 蛋白与过表达ACE2 的HEK293细胞裂解液为阴性对照。取各阶段样品,进行12%SDS-PAGE 后转印至PVDF 膜,5%脱脂牛奶室温封闭1 h;在相对分子质量为100 000 的位置剪膜,相对分子质量较大的膜孵育ACE2 兔源抗体(1 ∶10 000稀释),相对分子量较小的膜孵育GST 兔源抗体(1 ∶10 000 稀释),4 ℃过夜;加入 HRP 标记的羊抗兔 IgG(1 ∶10 000 稀释),室温孵育 2 h;加入 ECL 发光液,化学发光成像仪器显影曝光。
1.8 康复期患者血清中和抗体的检测 采用ELISA法。将纯化的重组 GST-RBD 蛋白(0.2 mg / mL)按1 ∶5、1 ∶10、1 ∶50、1 ∶100、1 ∶200、1 ∶500、1 ∶1 000、1 ∶5 000 的比例稀释,加入 96 孔板,每孔 100 μL,4 ℃包被过夜;TBST 洗板5 次,加入5%脱脂奶粉溶液,37 ℃封闭 2 h;TBST 洗板 5 次,每孔加入 100 μL 20 号康复期患者血清(1 ∶200 稀释),37 ℃孵育 2 h;TBST 洗板 5 次,每孔加入 100 μL HRP 标记的羊抗人 IgG(1 ∶10 000 稀释),37 ℃孵育 2 h;TBST 洗板5 次,每孔加入 100 μL TMB 显色液,37 ℃避光 10 min;每孔加入 50 μL 3 mol / L H2SO4终止反应,酶标仪测定波长450 nm 处的吸光度值。以PBS 溶液为阴性对照,同时设置GST 蛋白包被过夜(每孔100 ng)的对照组。
用 RBD 蛋白包被 96 孔板,每孔 100 ng,4 ℃包被过夜。将 20 号康复期患者血清按 1 ∶200、1 ∶500、1 ∶1 000、1 ∶2 000、1 ∶5 000、1 ∶10 000、1 ∶20 000、1 ∶32 000 的比例分别稀释,作为一抗,其余操作同上。阴性对照以PBS 溶液作为一抗。
用 RBD 蛋白包被 96 孔板,每孔 100 ng,4 ℃包被过夜。选取20 例不同康复期患者的血清(1 ∶200稀释)作为一抗,其余操作同上。阴性对照选取正常人血清作为一抗。
2 结 果
2.1 RBD 区序列的优化 优化后RBD 基因序列在大肠埃希菌(strain K12 衍生株系)中的表达难易值(CAI)由0.215 提高至1.0,更利于大肠埃希菌原核表达系统的识别与翻译,见图1。

图1 密码子优化前后的RBD 基因序列比对结果Fig.1 RBD gene sequence alignment before and after codon optimization
2.2 重组表达质粒的鉴定 重组质粒pGEX 6P-1/RBD的菌落PCR 及双酶切产物经1.2%琼脂糖凝胶电泳分析,在约950 bp 处均可见特异性条带,大小与预期相符,见图2 和图3。基因测序结果与GenBank中公布的RBD 基因序列一致,表明质粒构建正确。

图2 pGEX 6P-1 / RBD 重组质粒的菌液 PCR 鉴定Fig.2 Identification of recombinant plasmid pGEX 6P-1 /RBD by colony PCR
图3 pGEX 6P-1/RBD 重组质粒的双酶切(BamHⅠ/HindⅢ)鉴定Fig.3 Restriction map of recombinant plasmid pGEX 6P-1 /RBD(BamHⅠ/ HindⅢ)
2.3 重组蛋白表达及纯化产物的鉴定 BCA 法测得纯化蛋白浓度为 1.2 mg / mL。12% SDS-PAGE 和Western blot 分析显示,获得的重组GST-RBD 蛋白相对分子质量约60 000,为可溶性蛋白,纯度约82%,同时,由于蛋白酶切序列的存在,纯化的目的蛋白带有相对分子质量26 000 的GST 降解蛋白。见图4 ~6。
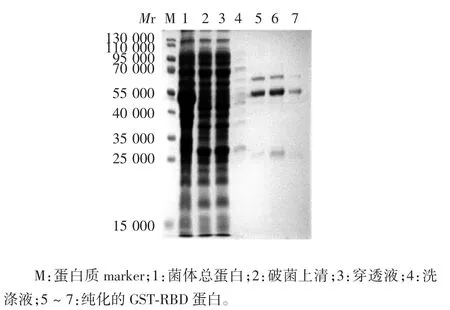
图4 重组GST-RBD 蛋白的SDS-PAGE 分析Fig.4 SDS-PAGE profile of recombinant protein GST-RBD
2.4 重组RBD 蛋白与ACE2 蛋白的Pull-down 结合试验 Western blot 分析显示,加入ACE2 单克隆抗体时,RBD 与ACE2 蛋白孵育组、细胞裂解液组在相对分子质量100 000 附近有阳性杂交条带;加入GST 单克隆抗体时,GST 蛋白组、GST 与 ACE2 蛋白孵育组在相对分子质量25 000 附近有阳性杂交条带,GST-RBD 蛋白组和 GST-RBD 与 ACE2 蛋白孵育组在相对分子质量55 000 附近有阳性杂交条带。见图7。表明重组RBD 蛋白可与ACE2 蛋白发生特异性结合。

图6 以抗RBD 单克隆抗体为一抗的重组GST-RBD 蛋白的Western blot 分析Fig.6 Western blotting of recombinant GST-RBD protein using anti-RBD monoclonal antibody as primary antibody
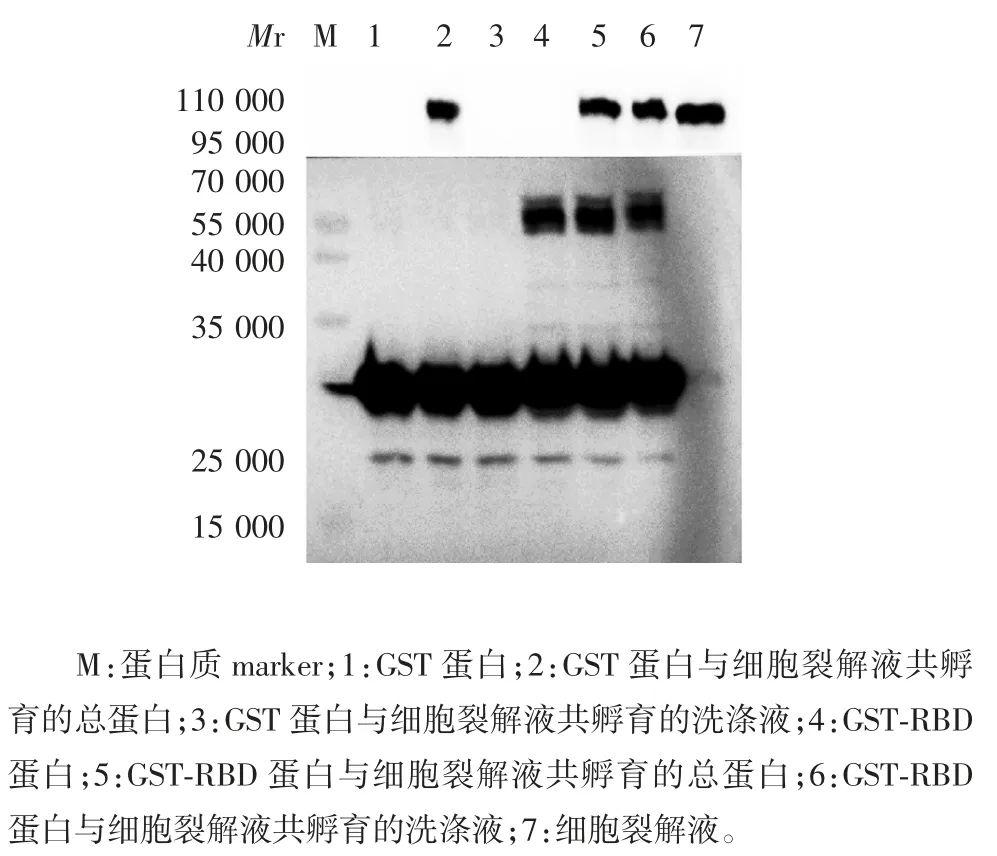
图7 Pull-down 试验检测重组RBD 蛋白与ACE2 蛋白的结合作用Fig.7 Determination of binding effect of recombinant RBD protein to ACE2 protein by pull-down assay
2.5 康复期患者血清中抗RBD 抗体水平 ELISA结果显示,GST-RBD 蛋白能与康复期患者血清中的特异性抗体发生结合反应,每孔低至10 ng 时也可检测出血清中存在的特异性抗体,见图8;血清以1 ∶2 000 比例稀释时,RBD 蛋白仍能检测到特异性抗体,灵敏度较好,见图9;对于随机选取的20 例不同康复期患者血清,5 号和15 号血清的A450值与阴性对照相差不大,可能与该患者血清滴度下降有关,见图10。
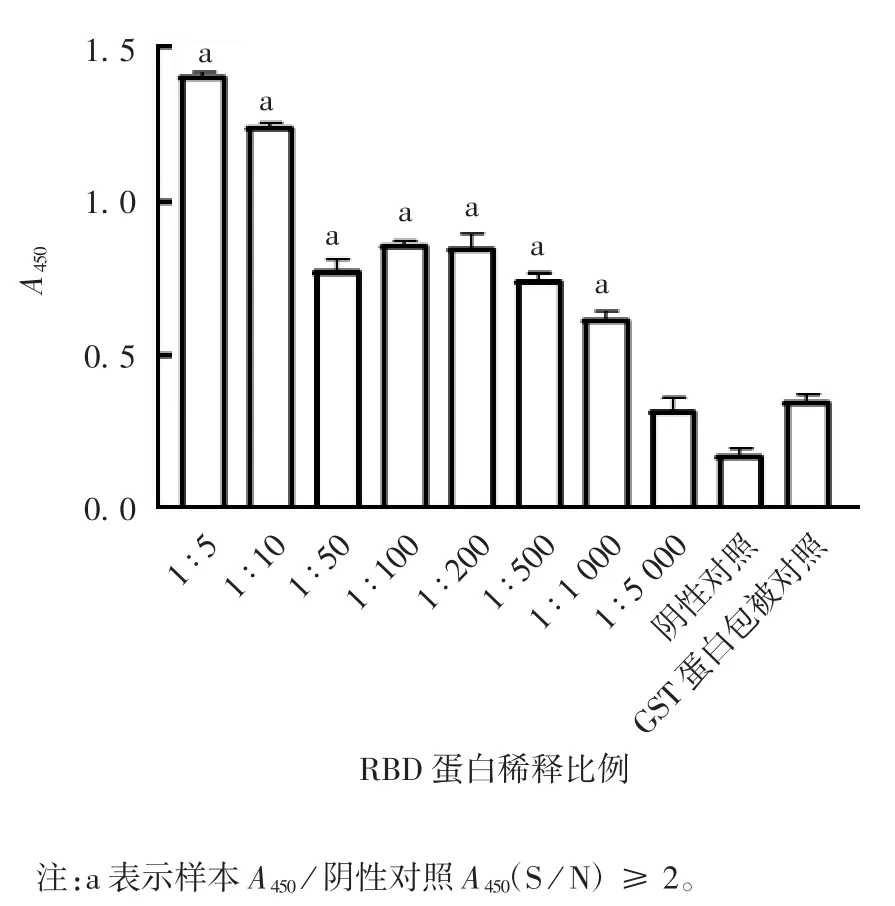
图8 不同稀释倍数的RBD 蛋白与康复期患者血清的抗体反应Fig.8 Antibody reaction of RBD protein at various dilution folds with sera of convalescent patients

图9 RBD 蛋白与不同稀释倍数康复期患者血清的抗体反应Fig.9 Antibody reaction of RBD protein with sera at various dilution folds of convalescent patients
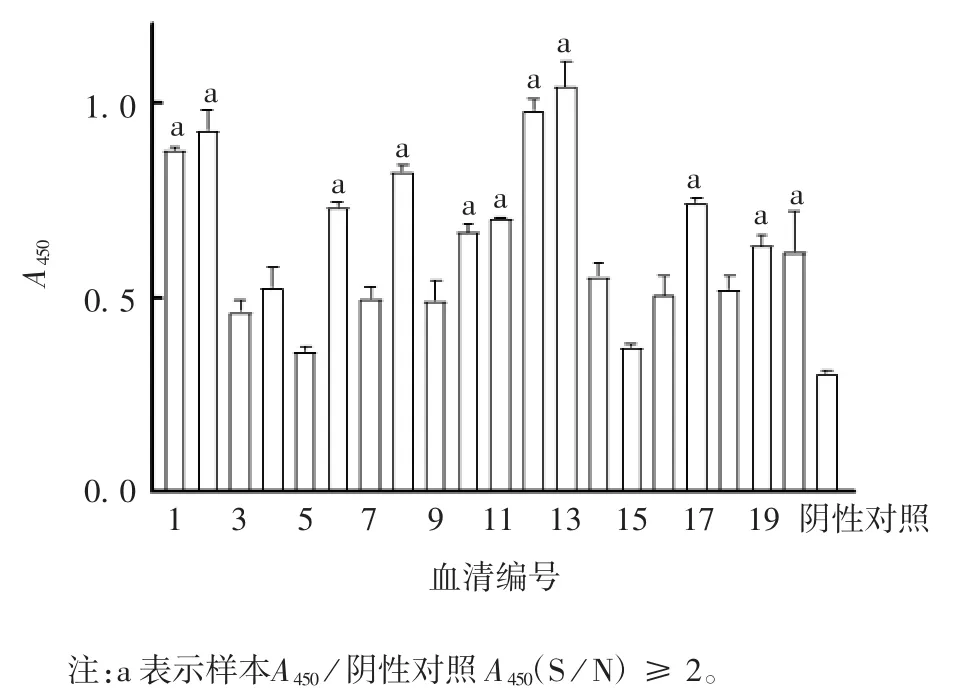
图10 RBD 蛋白与不同康复期患者血清的抗体反应Fig.10 Antibody reaction of RBD protein with sera of patients at various convalescent stages
3 讨 论
据全基因组测序分析,SARS-CoV-2 与SARSCoV 基因的同源性可达 82%[11],S 蛋白序列相似度为76%[12]。而根据体外结合试验,SARS-CoV-2 RBD区与ACE2 的亲和力比SARS-CoV 高出10 ~20 倍[13],这可能是由于 SARS-CoV-2 传染力更强、传播更迅速、传播范围更广泛。疫情发展至今,病毒几经变异,但仍未发现靶向SARS-CoV-2 的特效抗病毒药物,因此,大规模接种疫苗、产生群体免疫是防止病毒进一步传播的有效措施。目前,中国研发的新冠病毒灭活疫苗保护效力为79.34%,在大规模接种后评估中和抗体滴度及抗体的有效保护期等十分必要,但当前尚无商品化的测定中和抗体试剂盒上市。利用杜克-新加坡国立大学医学院团队的替代病毒中和试验[14],仅使用纯化的RBD 蛋白和ACE2 蛋白,即可采用类似ELISA 的操作方法快速、大量测定特异性中和抗体,因此,建立一种快速、低成本制备大量RBD 蛋白的方法十分必要。
长期以来,由于冠状病毒S 蛋白有许多糖基修饰位点[15],对S 蛋白的体外研究大多基于真核表达系统,但真核表达系统存在产量低、耗时长、成本高等不足之处。利用原核表达系统体外合成重组蛋白的技术较为成熟,有利于重组蛋白的大量制备和纯化[16]。本研究利用生物信息软件对RBD 区域核酸序列进行密码子优化,成功构建了RBD 原核表达质粒。GST-RBD 重组蛋白能够在体外实现原核可溶性表达(同时菌体内也有部分包涵体表达),破菌上清液经亲和层析纯化后得到了纯度较高的GST-RBD蛋白。GST 标签蛋白的相对分子质量为26 000 左右,融合在RBD 蛋白的N-末端,有助于重组蛋白的可溶性表达,但可能对RBD 的结构功能有一定的影响。Pull-down 试验证实,GST-RBD 重组蛋白能够与ACE2 蛋白特异性结合,表明该蛋白具有RBD 结构域最重要的生物学功能。另外,GST-RBD 蛋白具有GST 融合蛋白的弊端,由于蛋白酶酶切序列的存在,GST 易从融合区域断裂,因此,后续需研究如何保持GST-RBD 蛋白的稳定性,或进一步处理,将GST 从GST-RBD 重组蛋白上完全切除。
综上所述,本研究通过原核表达系统实现了大规模低成本制备具有生物学功能活性的重组SARSCoV-2 RBD 蛋白,可为抗病毒研究和注射疫苗后中和抗体滴度的评价奠定基础。
