气血舒颗粒质量控制研究
2022-08-16夏小健刘雨珍
夏小健,刘雨珍
(1 安徽中医药大学药学院,安徽 合肥 230012; 2 马鞍山市中医院,安徽 马鞍山 243021)
气血舒服颗粒剂(简称气血舒颗粒)是由白参、白术、茯苓、茯神、当归、川芎、白芍、熟地黄、夜交藤、炙远志、炙甘草11味中药组成的复方制剂,是马鞍山市中医院团队在经典名方四君子汤和四物汤复方基础加入远志、茯神、夜交藤佐使之用,以此作为肿瘤科使用的经典经验方。方中人参与熟地相配,益气养血,共为君药。白术、茯苓健脾渗湿,助人参益气补脾。当归、白芍养血和营,助熟地滋养心肝,均为臣药。川芎为佐,活血行气,使地、归、芍补而不滞。茯神、远志、夜交藤宁心安神。炙甘草为使,益气和中,调和诸药。主治气血亏虚型虚劳,是益气补血、健脾安神的代表方剂,在临床上得到较好的疗效[1]。
中药颗粒剂是在基于中医药理论的基础上联系临床用药的需求,将中药材及其饮片加工而成的一种新剂型。颗粒剂既具有传统中药汤剂易于吸收、作用快的特点又能够克服煎煮的以及携带的不便,在临床上目前广泛使用[2-4]。同时我们可以采用辅料添加或者薄膜包衣的形式提高药物稳定性、达到在体内缓释控释等目的[5]。目前关于颗粒剂的制备研究也在不断深入[6-7]以为临床用药方式提供参考,但关于中药颗粒剂的质量标准研究却没有一个明确的标准[8-9]。气血舒颗粒在临床上没有统一的质量标准,因此有必要对其进行质量标准研究。
TLC法可以很容易地对合成药物复方制剂或单方制剂进行原料分析,在鉴别物质方面广泛使用[10],本方采用TLC法对气血舒颗粒中除人参的10味药进行定性鉴别。方中君药人参中的主要活性成分人参皂苷作为定量指标,《中国药典》2020年版只对人参皂苷Rg1、人参皂苷Re、人参皂苷Rb13种人参皂苷含量做出规定,质量控制指标少[11],因此通过HPLC法进行人参皂苷Rg1、Rb1、Re的分离与含量测定,为气血舒颗粒临床质量标准提供参考。
1 仪器与材料
1.1 仪 器
Agilent 1260高效液相色谱仪,美国安捷伦科技公司;Agilent ZORBAX Eclipse Plus C18液相色谱柱(4.6 mm×250 mm, 5 μm);METTLER-TOLEDO AB204-SRS电子天平,瑞士METTLER公司;DHG-9070A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;紫外检测仪等。
1.2 材 料
人参皂苷Rg1(批号110703-201731)、人参皂苷Re(批号110754-201827)、人参皂苷Rb1(批号110704-201827)、白术对照药材(批号120925-201812)、茯苓对照药材(批号121117-201107)、当归对照药材(批号120927-201617)、阿魏酸(批号110773-201915)、藁本内酯(批号111737-201608)、川芎对照药材(批号120918-201411)、欧当归内酯A(批号11826-201203)、芍药苷(批号110736-201943)、毛蕊花糖苷(批号111530-201914)、首乌藤对照药材(批号120939-201908)、大黄素(批号110756-201913)、远志对照药材(批号120989-201107)、细叶远志皂苷(批号111849-201705)、甘草(胀果甘草)对照药材(批号121303-201704)、甘草酸单铵盐(批号110731-202021);气血舒颗粒剂自制(批号20201029、20201030、20201101);各阴性颗粒剂亦自制。硅胶GF254薄层板、硅胶G薄层板、硅胶H薄层板;乙醇、甲醇等试剂为分析纯;乙腈为色谱纯;水为纯净水。
2 方法与结果
2.1 薄层色谱法鉴别
2.1.1 炒白芍的鉴别
(1)供试品溶液的制备[12]
取本品颗粒3 g,研钵研细,20 mL 水溶解,20 mL 饱和正丁醇萃取 2 次,合并萃取液,蒸干,残渣加甲醇溶解定容至 2 mL,作为供试品溶液。
(2)对照药品溶液的制备。
取芍药苷对照品,加乙醇制成1 mg/mL溶液。阴性样品溶液的制备:称取2.14 g不含炒白芍的阴性样品,按照供试品溶液制备方法制备。
(3)鉴别
吸取上述新制备的3种溶液各10 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40:5:10:0.2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,105 ℃加热至斑点显色清晰。
(4)结果
实验结果见图1所示。供试品色谱中,在与对照品色谱相应的位置上,显相同的蓝紫色斑点,而阴性样品溶液无此相应斑点,亦无干扰。

图1 实验室条件下炒白芍薄层图Fig.1 Thin layers of fried white peony under laboratory conditions
2.1.2 首乌藤的鉴别
(1)供试品溶液的制备
取本品颗粒2 g,研钵研细,加乙醇50 mL,加热回流1 h,滤液浓缩至1 mL。
(2)对照药材溶液的制备
另取首乌藤对照药材0.25 g,研钵研细,同法制成对照药材溶液。对照药品溶液的制备:取大黄素对照品,加乙醇制成每1 mL含0.5 mg的溶液。
(3)阴性样品溶液的制备
称取1.07 g不含首乌藤的阴性样品,按照供试品溶液制备方法制备阴性样品溶液。
(4)鉴别[13]
吸取上述新制备的4种溶液各5 μL,分别点于同一硅胶H薄层板上,以甲苯-乙酸乙酯-甲酸(15∶2∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
(5)结果
实验结果见图2所示,供试品色谱中,在与对照品色谱相对应位置上显相同颜色的斑点,且阴性无干扰。
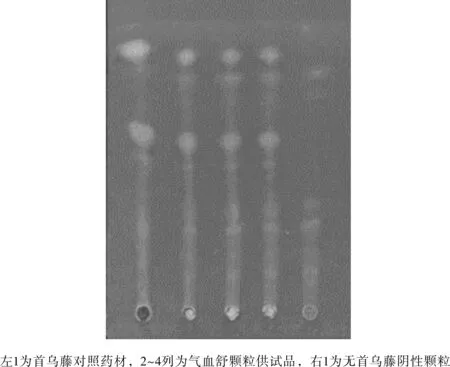
图2 实验室条件下首乌藤薄层鉴别结果Fig.2 Thin layer identification results of Radix Polygoni under laboratory conditions
2.1.3 白术的鉴别
(1)供试品溶液的制备
取本品颗粒7 g,研钵研细,加正己烷20 mL超声15 min,滤过,滤液浓缩至2 mL,取滤液即得。
(2)对照药材溶液
取白术对照药材1 g,加水煎煮1 h,滤过,滤液浓缩至 30 mL,乙酸乙酯振摇提取2 次,每次25 mL,合并乙酸乙酯液,蒸干,残渣加甲醇1 mL溶解。
(3)阴性样品溶液的制备
称取7.07 g不含炒白术的阴性样品,按照供试品溶液制备方法制备阴性样品溶液。
(4)薄层鉴别
吸取上述溶液各5 μL,分别点于同一硅胶G薄层板上,以二氯甲烷-丙酮-甲酸(19∶1∶0.1)为展开剂,展开,取出,晾干,在紫外光(365 nm)下检视,结果见图3所示[14]。
(5)结果
白术对照药材、气血舒颗粒与不含白术的阴性颗粒在相应位置上均显相同颜色的斑点,因而白术对照药材不能将气血舒颗粒阳性与阴性样品鉴定开,建议不收入标准正文。
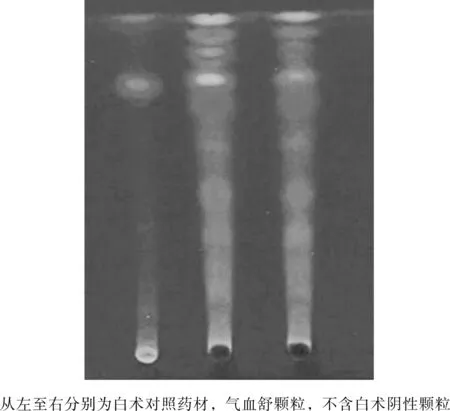
图3 白术专属性薄层图Fig.3 Thin layer map of Atractylodes atractylodes specificity
2.1.4 茯苓与茯神的鉴别
(1)供试品溶液的制备
取颗粒7 g,加20 mL乙醇,超声20 min,滤过,滤液蒸干,残渣加乙酸乙酯溶解。
(2)对照药材溶液的制备
取茯苓对照药材粉末0.5 g,同法处理,作为对照药材溶液。
(3)阴性样品溶液的制备:
①不含茯苓与茯神的阴性样品溶液1的制备:称取5.78 g的不含茯苓与茯神的阴性样品,按照供试品溶液制备方法制备阴性样品溶液1。②不含茯苓的阴性样品溶液2的制备:称取6.75 g的不含茯苓的阴性样品,按照供试品溶液制备方法制备出阴性样品溶液2。③不含茯神的阴性样品溶液3的制备:称取6.43 g的不含茯神的阴性样品,按照供试品溶液制备方法制备出不含茯神的阴性样品溶液3。
(4)薄层鉴别
照薄层色谱法(《中国药典》2020年版四部 通则0502)试验,吸取供试品溶液15 μL,对照药材溶液5 μL,分别点于同一硅胶G薄层板上,以甲苯-氯仿-丙酮-甲酸(9:3:1:0.5)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。
(5)结果
实验结果见图4所示。供试品色谱中,在与茯苓对照药材色谱相应的位置上,气血舒颗粒溶液、不含茯苓阴性颗粒、不含茯神阴性颗粒均显相同颜色的斑点,不含茯苓与茯神的阴性颗粒溶液无斑点。
2.1.5 甘草的鉴别
(1)供试品溶液的制备
取本品颗粒14.78 g,研钵研细,加乙醚40 mL,加热回流1 h,滤过,药渣加甲醇30 mL,加热回流1 h,滤过,滤液蒸干,残渣加水40 mL溶解,正丁醇提取3次,每次20 mL,合并正丁醇液,用水洗涤3次,弃去水液,正丁醇液蒸干,残渣加甲醇5 mL溶解,得供试品溶液。
(2)对照药材溶液的制备
另取甘草对照药材1 g,研钵研细,移至锥形瓶中,同法制成对照药材溶液。
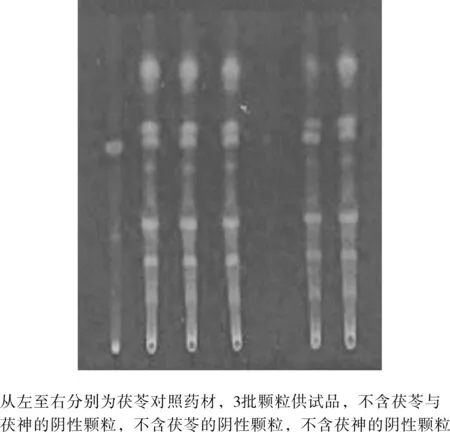
图4 室温条件下茯苓与茯神薄层鉴别结果Fig.4 Result of thin-layer identification of poria cocos and fushen at room temperature
(3)阴性样品溶液的制备
称取14.14 g不含炙甘草的阴性样品,按照供试品溶液制备方法制备阴性样品溶液。
(4)鉴别
吸取上述新制备的4种溶液各1~2 μL,分别点于同一用1%氢氧化钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲酸-冰醋酸-水(15:1:1:2)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。
(5)结果
实验结果见图5所示。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点,阴性样品溶液无此相应斑点,亦无干扰。
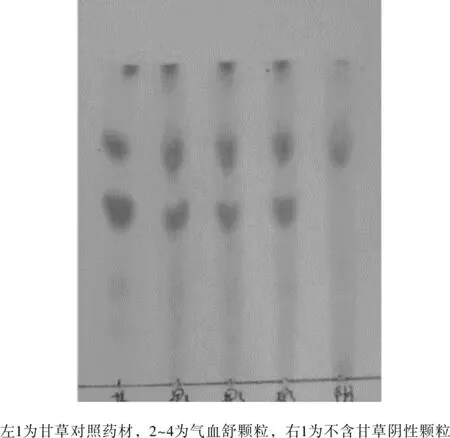
图5 室验室条件下甘草薄层鉴别结果Fig.5 Identification of glycyrrhiza uralensis Fisch by TLC under laboratory conditions
2.1.6 当归和川芎的鉴别[15]
(1)供试品溶液的制备
取本品颗粒15 g,研细,加乙酸乙酯 30 mL,超声处理 30 min,滤过,滤液蒸干,残渣加甲醇1 mL 使溶解,作为供试品溶液。
(2)对照药材溶液的制备
取当归、川芎对照药材各 1 g,加乙酸乙酯 30 mL,超声处理 30 min,滤过,滤液蒸干,残渣加甲醇 1 mL 使溶解,分别作为当归对照药材溶液与川芎对照药材溶液。
(3)阴性样品溶液的制备
取不含当归、川芎的其他药味,按处方比例制成缺当归、川芎的阴性对照样品溶液。
(4)鉴别
以环己烷- 乙酸乙酯(4∶1)为展开剂,上行展开8 cm,取出,晾干,置紫外光灯(365 nm)下检视。
(5)结果
结果见图6所示,当归对照药材、川芎对照药材薄层色谱图相同,二者不能鉴别,二者与气血舒颗粒在相应位置上均显相同颜色的斑点,当归与川芎对照药材不能将气血舒颗粒阳性与阴性样品鉴定开,建议不收入标准正文。
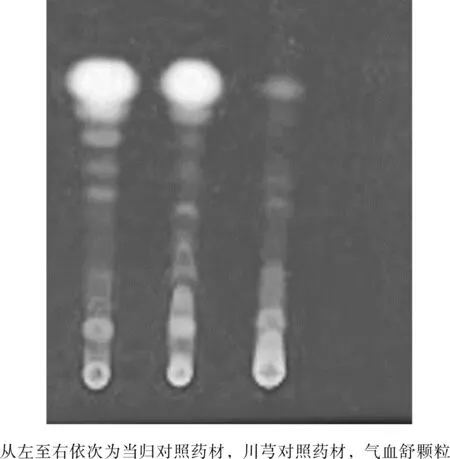
图6 当归与川芎专属性薄层图Fig.6 Thin-layer map of the specificity of Angelica sinensis and Ligusticum chuanxiong
2.1.7 地黄的鉴别
(1)供试品溶液的制备
取本品颗粒7 g,置于研钵内,研细,移至锥形瓶中,加80%甲醇50 mL,超声处理 30min,滤过,滤液蒸干,残渣加水5 mL使溶解,用水饱和正丁醇振摇提取4次,每次10 mL,合并正丁醇液,蒸干,残渣加甲醇2 mL使溶解,作为供试品溶液。
(2)对照药品溶液的制备
另取毛蕊花糖苷对照品,加甲醇制成每1 mL含0.5 mg的溶液,作为对照品溶液。
(3)阴性样品溶液的制备
称取6.75 g不含熟地黄的阴性样品,按照供试品溶液制备方法制备阴性样品溶液。
(4)鉴别
吸取上述新制备的供试品溶液与阴性样品溶液各5 μL、对照品溶液2 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-甲醇-甲酸(16:0.5:2)为展开剂,展开,取出,晾干,用0.1%的1,1-二苯基-2-苦肼基无水乙醇溶液浸渍,晾干。
(5)结果
实验结果见图7所示。供试品色谱中,在与对照品色谱相应的位置上,显相同的颜色斑点。而阴性样品溶液无此相应斑点,亦无干扰。
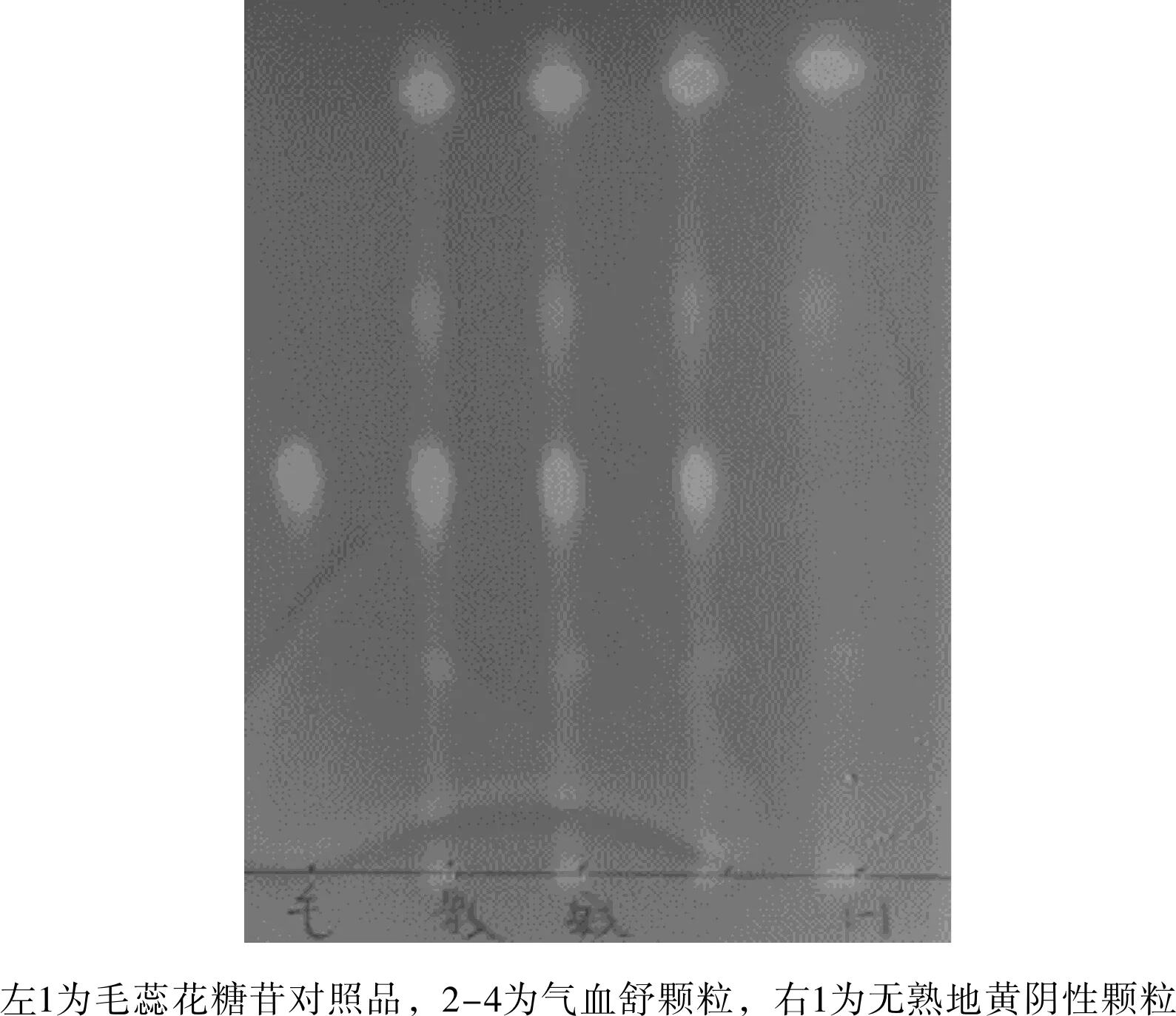
图7 实验室条件下熟地黄薄层鉴别结果Fig.7 Thin layer identification results of Rehmanniae rehmanniae under laboratory conditions
2.1.8 远志的鉴别
(1)供试品溶液1的制备
取本品颗粒3.69 g,置于研钵内,研细,移至锥形瓶中,加70%乙醇5 mL,超声处理15min,滤过,滤液作为供试品溶液1。
(2)对照药材溶液的制备
另取远志对照药材0.5 g,置于研钵内,研细,移至锥形瓶中,同法制成对照药材溶液。
(3)阴性样品溶液1的制备
称取3.37 g不含制远志的阴性样品,按照供试品溶液1制备方法制备阴性样品溶液1。
(4)供试品溶液2的制备
取本品粉末(过三号筛)约7.39 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 mL,称定重量,超声处理(功率400 W,频率40 kHz)1 h,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25 mL,置圆底烧瓶中,蒸干,残渣加10%NAOH溶液50 mL,加热回流2 h,放冷,用盐酸调节pH值为4~5,用水饱和的正丁醇振摇提取3次,每次50 mL,合并正丁醇液,回收溶剂至干,残渣加甲醇适量使溶解,转移至25 mL最瓶中,加甲醇至刻度,摇匀,即得供试品溶液2。
(5)阴性样品溶液2的制备
称取上述所制不含制远志阴性样品1共6.75g,按照供试品溶液2制备方法制备阴性样品溶液2。
(6)对照品溶液的制备
取细叶远志皂苷对照品适量,精密称定,加甲醇制成每 1 mL含2 mg的溶液,即得。
(7)鉴别
①吸取上述新制备的3种溶液各2 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-冰醋酸-水(55:13:13)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。实验结果见图8所示。图中可以发现气血舒颗粒供试品与不含远志的阴性颗粒溶液斑点相同,该薄层鉴别不能将二者鉴别,在远志对照药材色谱相应的位置上,有2个斑点相同2个斑点不同,而这不同的2个斑点,在气血舒颗粒供试品与不含远志的阴性颗粒溶液中均无,因而远志对照药材不能鉴定气血舒颗粒供试品。

图8 实验室条件下制远志薄层图(A)Fig.8 Preparation of polygalae thin-layer under laboratory conditions(A)
②吸取上述新制备的供试品溶液2与阴性样品溶液2各 10 μL,吸取对照品溶液10 μL,分别点于同一硅胶G薄层板上,以三氯甲烷-色谱甲醇-水(6:3:0.5)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。结果见图9所示。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。阴性样品溶液2无此斑点。
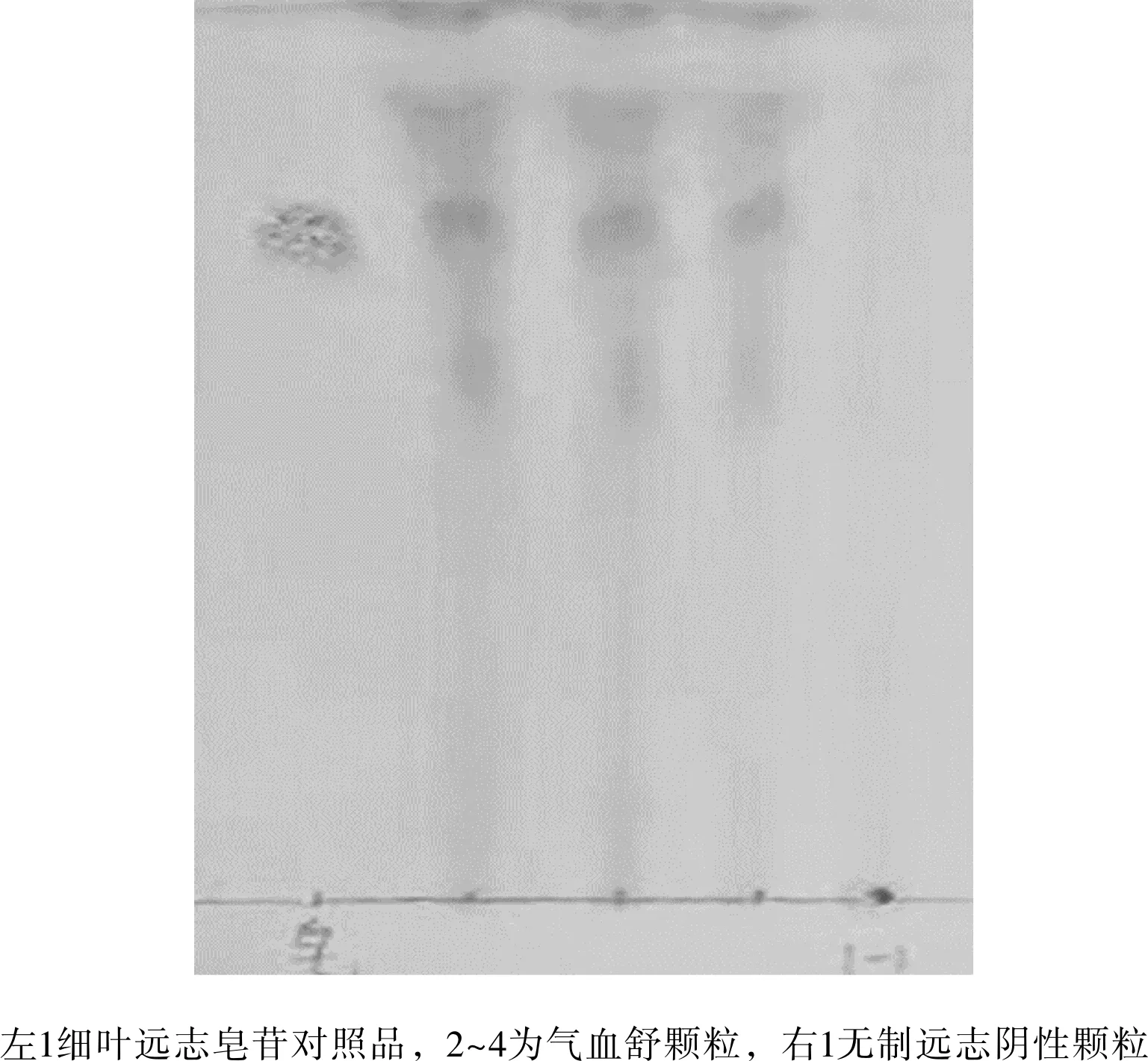
图9 实验室条件下制远志薄层图(B)Fig.9 Preparation of polygalae thin-layer under laboratory conditions(B)
2.2 人参皂苷的含量测定
2.2.1 色谱条件
流动相为乙腈(A)-水(B),采用Agilent ZORBAX Eclipse Plus C18液相色谱柱(4.6 mm×250 mm,5 μm),梯度洗脱,条件见表1所示。检测波长:203 nm,柱温25 ℃,理论板数按人参皂苷Rg1峰计算应不低于6000,如图10所示。
2.2.2 对照品溶液的制备
(1)对照品溶液1:精密称取人参皂苷对照品Rg12.57 mg(纯度92.4%)、人参皂苷Re对照品2.55 mg(纯度93.4%)及人参皂苷Rb1对照品2.87 mg(纯度91.2%),再加甲醇10 mL,摇匀,即得。
(2)对照品溶液2:精密称取人参皂苷Rg12.78mg(纯度92.4%)、人参皂苷Re 2.77 mg(纯度93.4%)及人参皂苷Rb1(纯度91.2%)3.10 mg,加甲醇制成1 mL含0.257、0.258,0.283 mg的混合溶液。
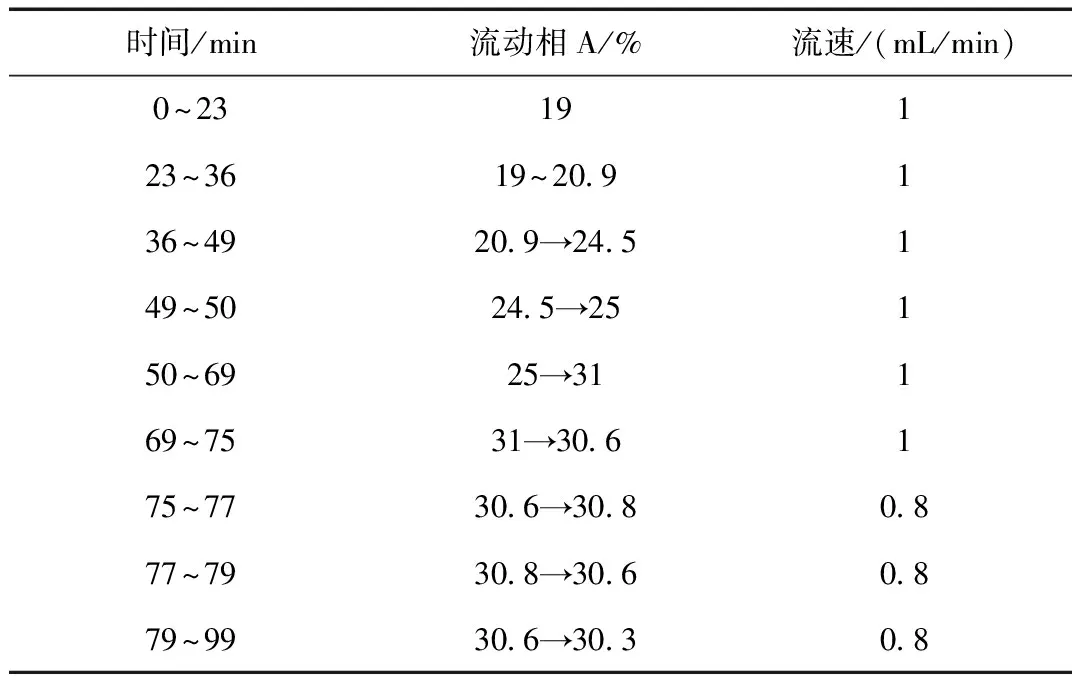
表1 水提工艺中人参皂苷HPLC测定流动相洗脱条件Table 1 HPLC determination of elution conditions of ginsenoside in extraction process
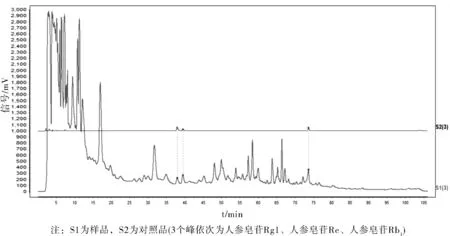
图10 气血舒颗粒中三种人参皂苷的HPLC图谱Fig.10 HPLC chromatogram of three ginsenosides in Qixueshufu granules
2.2.3 供试品溶液的制备
(1)供试品溶液1:取本品粉末置研钵研细,过四号筛后取20 g,加水150 mL,密塞,超声处理30 min,滤过,用水饱和正丁醇溶液萃取2次,合并水饱和正丁溶液,将萃取液旋转蒸发至干,残渣加甲醇5 mL溶解,蒸干甲醇,再加甲醇2 mL溶解,滤过,取续滤液,即得。
(2)供试品溶液2:按处方比称取11味药材共115 g,煎煮时保持微沸,加10倍量水,浸泡0.5 h后,煎煮30 min,滤过,第二次加8倍量水,煎煮30 min,滤过,将提取液浓缩至100 mL,100 mL正丁醇萃取三次,取正丁醇层蒸干,加甲醇转移至10 mL容量瓶,即得。
2.2.4 阴性样品溶液的制备
(1)阴性样品溶液1(未制颗粒):按处方量比例称取不含人参的其它10味药材共105 g,煎煮时保持微沸,加10倍量水,浸泡0.5 h后,煎煮30 min,滤过,第二次加8倍量水,煎煮30 min,滤过,将提取液浓缩至100 mL,100mL 正丁醇萃取三次,取正丁醇层蒸干,加甲醇转移至10毫升容量瓶,即得。
(2)阴性样品溶液2:按照处方比例取不含人参的其他 10味药材,按照已确定的气血舒颗粒的制备工艺制备出不含人参的阴性样品。称取6.8 g不含人参的阴性样品,按照供试品溶液制备方法制备阴性样品溶液。
2.2.5 样品测定
采用双标双样法测定,分别用对照品溶液1与对照品溶液2色谱峰计算含量,取其平均值作为该实验处理样品的含量。
2.2.6 颗粒样品测定
取三批气血舒颗粒制备供试品溶液,进样,结果见表2所示。
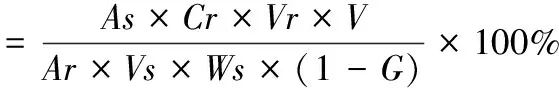
式中:As为供试品的峰面积;Ar为对照品的峰面积;Vr为对照品的进样量,μL;Vs为样品的进样量,μL;Ws为样品的称样量,g;Cr为对照品的浓度,mg/mL;G为水分含量;V为样品的稀释倍数。
人参皂苷Rgl与Re总含量为0.372~0.388 mg/g,平均值为0.380 mg/g,人参皂苷Rb1含量为0.311~0.323 mg/g,平均值为0.316 mg/g。
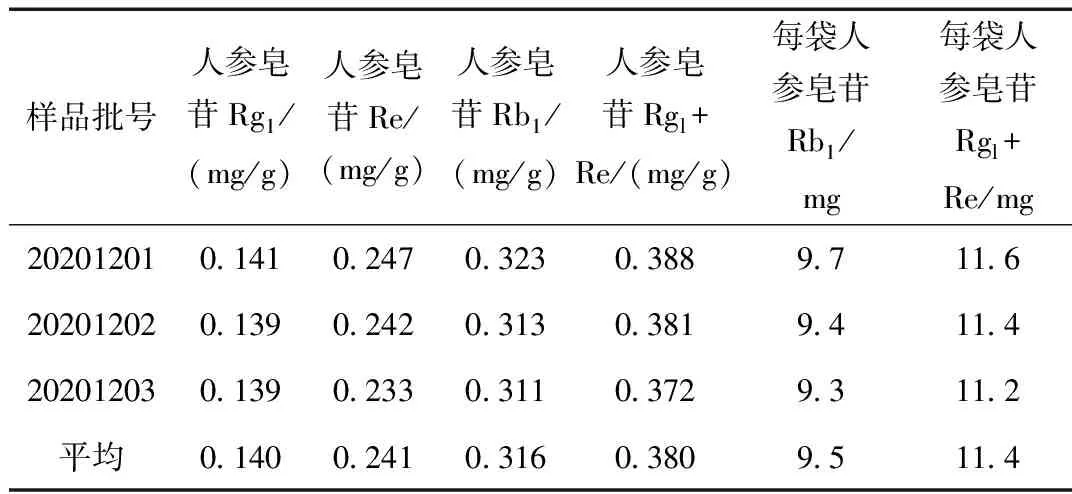
表2 气血舒颗粒人参皂苷含量Table 2 Contents of ginsenosides in Qixueshu granules
2.2.7 人参饮片的测定
取人参饮片,照药典方法制备供试品溶液,过0.22 μm微孔滤膜后,精密吸取10 μL进样,测定人参皂苷Rgl、Re与Rbl含量,测定结果见表3,结果达到2020版《中国药典》标准。
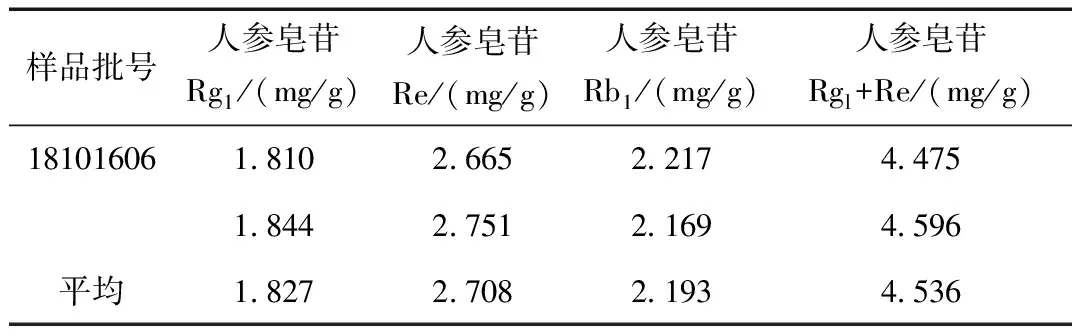
表3 人参中人参皂苷含量Table 3 The content of ginsenoside in ginseng
2.2.8 人参皂苷转移率的计算
可由下式计算人参皂苷转移率:
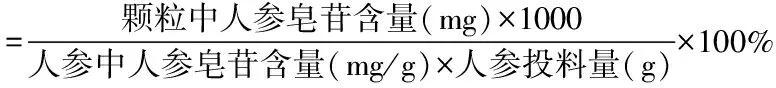
结果见表4、表5所示。
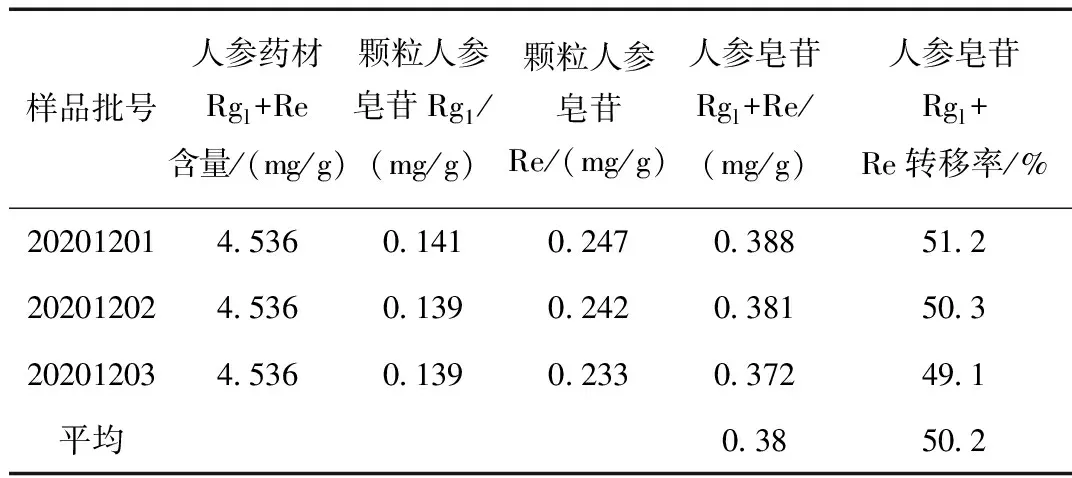
表4 气血舒颗粒中人参皂苷Rg1与Re总量转移率Table 4 Total transfer rate of ginsenoside Rg1 and Re in Qixueshufu Granules
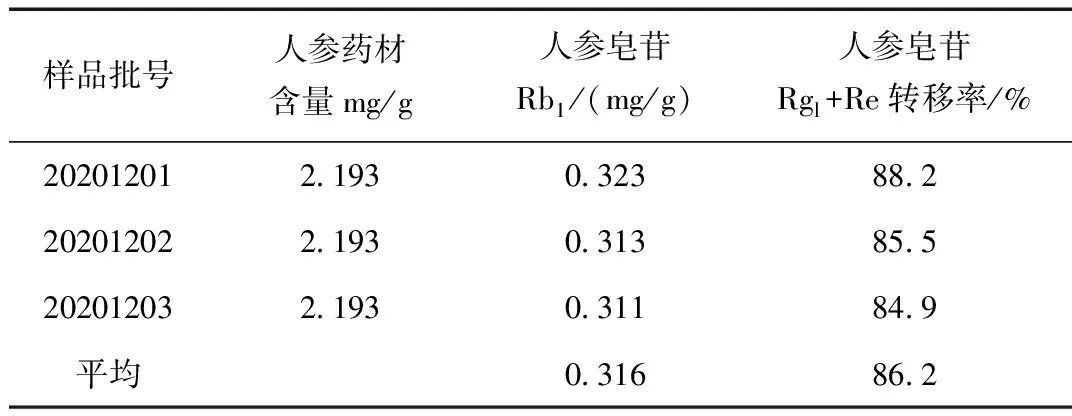
表5 气血舒颗粒中人参皂苷Rb1转移率Table 5 Transfusion rate of ginsenoside RB1 in Qixueshufu Granules
2.2.9 气血舒颗粒中人参皂苷限量规定
气血舒颗粒制剂处方11味(其中人参167 g),制备成1000 g颗粒,每袋装30 g。
气血舒颗粒三批验证人参皂苷Rg1+Re总含量转移率均值为50.2%,转移率按40%计;结合2020版《中国药典》人参中人参皂苷Rgl+Re总量不得少于0.30%,计算每袋气血舒颗粒人参皂苷Rg1+Re总含量不得少于6.0 mg。
气血舒颗粒三批验证人参皂苷Rb1含量转移率均值为86.2%,转移率按75%计;结合2020版《中国药典》人参中人参皂苷Rb1含量量不得少于0.20%,计算每袋气血舒颗粒人参皂苷Rb1含量不得少于7.5 mg。
3 讨 论
3.1 TLC法鉴别
在对气血舒颗粒专属性进行考察时,我们发现白术、当归、川穹分离度差,茯苓与茯神专属性差, 其余几味药材的专属性强,分离度好,可以作为气血舒颗粒的质量标准。
3.2 色谱条件的优化
本实验首先通过中国药典中分离人参皂苷Rg1、人参皂苷Re及人参皂苷Rb1条件上,取供试品溶液2进行条件考察,结果发现该条件不能很好分离三种物质。因此在此基础上,优化了洗脱条件,见表3所示,结果各峰型分离良好。
3.3 供试品溶液制备方法考察
本实验采取四种方法制备供试品溶液,按照优化后的色谱条件进样,结果发现按药典方法提取的S1溶液没有目标峰。S3是用水饱和正丁醇直接提取,其目标峰能够提出,但各目标峰峰面积小于供试品溶液1,且S3所用颗粒为50 g,水饱和正丁醇超声提取后,甲醇2 mL溶解后测定,而供试品溶液1所用颗粒为20 g,水溶后,再用水饱和正丁醇萃取,再用甲醇 2 mL溶解后测定,因而供试品溶1制备方法更适合于本颗粒剂人参皂苷Rg1、Re与Rb1的测定,故人参皂苷质量标准的制定应选择试品溶液1制备方法。
3.4 阴性样品溶液考察
取阴性样品溶液1、对照品溶液、供试品溶液2,按优化后的色谱条件分别进样,我们发现与对照品溶液相比较,按处方量制备的供试品溶液3中人参皂苷Rg1、Re与Rb1色谱峰明显,阴性样品溶液1在人参皂苷Rg1、Re与Rb1相应位置上无相应峰,因而按处方所制阴性清膏无干扰,制备方法可行。
4 结 论
气血舒颗粒是用于治疗肿瘤的经典方剂,选择合理的简便的质量评价方法能够有效控制和保证其质量,以保证制剂用药安全[16-17]。从全过程进行质量控制,即从药材基原、炮制、生产工艺、质量标准等方面来控制苦杏仁及其制剂质量,科学制定相应的质量标准、含量范围、安全剂量,为指导临床用药安全剂量提供科学依据,也将对含有人参皂苷的中药制剂质量标准的全面提高有重要意义。
本文通过薄层色谱(TLC)法对气血舒颗粒中除人参外其余物质进行定性鉴别,斑点与对照品相比一致。气血舒颗粒中以人参为君药,因此通过高效液相色谱法(HPLC)分离人参皂苷Rg1、Rb1、Re以及含量测定,以此为气血舒颗粒提供用药质量标准的参考。
