基于电化学纳米免疫传感器检测牛乳中过敏原α-酪蛋白
2022-08-16彭丹丹刘丹阳李丽娜刘泽阳鲁丁强庞广昌
彭丹丹,刘丹阳, ,李丽娜,刘泽阳,鲁丁强,2,,庞广昌,2,
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134)
近年来,随着功能性食品和涉及使用过敏原蛋白的食品制造技术的出现,食物引起的过敏性病症在逐步增加,食物过敏已经成为引发食品安全和公共卫生应急问题的主要原因[1-2]。目前尚无彻底根治食物过敏的措施,最为常见的避免食品过敏的方法是通过标签上的过敏原标识,来减少患者对易致敏食品的接触[3],因此对各种食品基质中的过敏原进行灵敏检测和适当的标签规则变得越来越重要。2019 年美国随机调查了40443 人,研究发现大约10.8%的人群受到食物过敏的威胁[4],其中儿童的发病率远高于成年人,并且发病率仍在递增[5]。牛乳蛋白是造成儿童过敏的最常见过敏原之一[6],一旦误食,会产生荨麻疹、血管性水肿、呕吐或急性特应性皮炎等早期反应或迟发性的胃肠道反应,例如腹痛、腹泻等[7]。过敏问题严重影响着大众健康和日常生活。早在2012 年国家就颁布相应法规要求对肉、蛋、奶、水产品等八类食品中常见过敏原进行检测和标识以减少消费者因误食而导致的过敏[8]。生物传感器检测作为一种新兴技术,由多种学科交叉融合,具有易操作、响应快速及样品用量少等特性[9],用来监控食品加工或临床诊断将具有较大的优势[10]。因此,开发快速、高通量、高灵敏度的过敏原检测方法对实施过敏原标识标准,避免食物过敏,保障大众安全具有重要现实意义。
当前用于牛乳过敏原检测技术主要包括拉曼光谱技术[11]、酶联免疫法[12-13]、电化学传感器技术[14-15]以及高效液相色谱法[16-17]等。酶联免疫法在免疫反应的技术中,用于过敏原的检测和定量,但存在不可避免的交叉反应,而且会出现假阳性;高效液相色谱法具有高灵敏度、高准确度的优点,但仪器昂贵,检测成本高,需要专业人员进行操作,不利于大量检测。其中,电化学传感技术响应快速、灵敏度高、成本低、操作简便,被广泛应用。采用电化学传感技术检测食物中的过敏原,多以过敏原的特异性单克隆抗体、多克隆抗体或适配体作为其生物识别元件,当待测物中有过敏原被生物识别元件捕获并发生结合时,分子间的相互作用产生的化学信号被换能器接收并转换为光电信号,而光电信号被信号处理系统进一步放大,从而实现对过敏原的定性和定量分析。Cao等[18]构建了一种基于金纳米粒子和精氨酸/多壁碳纳米管复合膜的电化学免疫传感器,用于测定牛乳中的酪蛋白,线性范围为102~104ng/mL。Eissa 等[19]在石墨烯修饰的丝网印刷碳电极表面镀一层4-氨基苯膜,然后在膜表面共价固定牛乳β-乳球蛋白抗体,建立的夹心型伏安电化学免疫方法检测β-乳球蛋白,其线性检测检测范围为1 pg/mL~100 ng/mL。
本研究基于电化学生物传感技术,以壳聚糖为桥联剂,结合纳米金及辣根过氧化物酶电化学信号放大系统,并以FcεRI 受体蛋白为通用分子探头吸附抗牛乳α-酪蛋白抗体IgE,构建了一种可用于食品中过敏原牛乳α-酪蛋白检测的电化学纳米免疫传感器,传感器在一定程度上模拟了体内带有FcεRI 受体的肥大细胞在接触到变应原后所产生的超敏反应过程,为变应原诊断、食物变应原检测、消除过敏原工艺和效果评价等提供了新的研究方法和思路。本研究所研制传感器可以获得Ka 等动力学参数,进行变应原所产生的变应动力学研究。
1 材料与方法
1.1 材料与仪器
FcεRI 受体蛋白、IgE 抗体 本实验室制备;硫堇醋酸盐 天津西典化学科技有限公司;无水乙酸山东辛格化工有限公司;壳聚糖 山东奥康生物科技有限公司;氯金酸 沈阳市金科试剂厂;柠檬酸钠 青岛锐洋生物科技有限公司;牛乳α-酪蛋白(Bos d 10,25 kD)美国Sigma 公司;所有试剂均为分析纯。
JA1003P 电子分析天平 上海圣科仪器设备有限公司;UV-5100 紫外-可见光分光光度计 上海元析仪器有限公司;Talos L120C 透射电子显微镜 北京欧波同光学技术有限公司;CHI660E 型电化学工作站 常州九朝新能源科技有限公司;工作电极-玻碳电极(Φ=3 mm)、对电极-铂丝电极、参比电极-Ag/AgCl 电极 天津艾达恒晟科技有限公司。
1.2 实验方法
1.2.1 金纳米粒子溶胶制备及表征 金纳米粒子溶胶的制备采用柠檬酸钠还原氯金酸法,具体操作如下[20]:以体积比1:25 将柠檬酸钠溶液和中性氯金酸溶液混合,用碳酸钾和碳酸钠调节溶液的pH 为7.0,随后将溶液放入微波炉中,用中火加热10~15 min,观察溶液的颜色变化,当溶液变成透亮的酒红色时停止加热,表明成功配制纳米金粒子溶胶。然后将三角烧瓶用锡箔纸包裹,储存于4 ℃黑暗环境中。
用紫外-可见分光光度计对450~700 nm[21]可见光范围内对新制备的纳米金粒子溶胶进行全波长扫描;纳米金溶胶颗粒的形状、尺寸和分散度通过透射电子显微镜(Transmission Electron Microscope,TEM)进一步表征。
1.2.2 电极预处理和电化学表征 玻碳电极预处理采用常规铝粉打磨方法,具体操作如下:将直径为4 mm的玻碳电极(glassy carbon electrode,GCE)按顺序在廘绒面Al2O3的1.0、0.3 和0.05 μm 的粒径进行抛光处理,每一次抛光后在超声水浴中清洗约30 s,复清洗三次。最后将样品冲洗干净,用1:1 的HNO3,无水乙醇和超纯水依次冲洗。清洗彻底后,采用扫描范围为-0.1~1.0 V,扫描速率为100 mV/s 的循环伏安法,在1 moL/L H2SO4溶液中,激活电极,直至产生稳定的循环伏安法曲线。然后采用循环伏安法(扫描范围-0.1~0.6 V,扫描速率50 mV/s)表征电极预处理情况,反应底液为1 mmol/L K3Fe(CN)6+0.20 mol/L KNO3[22]。
1.2.3 电极组装和电化学表征 纳米金修饰IgE-FcεRI电化学免疫传感器的制备参考文献[23-24]方法并略有改进,如图1 所示,具体过程如下:在预处理后的玻碳电极表面滴加硫堇-壳聚糖混合溶液,37 ℃光照培养箱干燥1 h;将上述电极置于0.5 mol/L NaOH溶液浸润约5 min,随后用超纯水反复洗涤电极;将上述电极浸入装有辣根过氧化物酶-纳米金混合溶液[22]的1.5 mL 离心管中4 ℃自组装过夜;取出上述电极,待37 ℃干燥30 min 后,滴加1 mg/mL FcεRI 受体蛋白溶液,37 ℃自组装2 h,超纯水润洗;取含IgE的大鼠血清(>100 ng/ml)滴加于上述干燥后电极,37 ℃孵育2 h 自组装,超纯水润洗;将上述电极置于0.5%牛血清白蛋白溶液中37 ℃条件下孵育1 h,对非特异性位点进行封闭;得到纳米金修饰的FcεRI-IgE 电化学纳米免疫传感器。
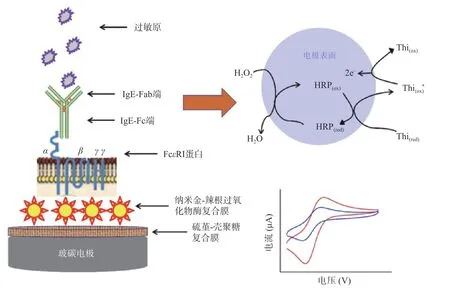
图1 纳米金修饰IgE-FcεRI 电化学纳米免疫传感器制备示意图Fig.1 Schematic diagram of preparation of IgE-FcεRI electrochemical nano immunosensor
1.2.4 测定电压优化 采用时间-电流法对制备的生物传感器在-0.5~-0.25 V 不同电位条件下进行测定,以超纯水作为空白对照,实验组以10-6mol/Lα-酪蛋白溶液的测试底液为例,不同电位对生物传感器响应效果的影响用加入10-6mol/Lα-酪蛋白溶液前后的电流变化率来衡量。
1.2.5 检测方法与原理 采用三电极检测系统,以制备的IgE-FcεRI 纳米传感器为工作电极,Pt 丝为对电极,Ag/AgCl 为参比电极,空白对照为超纯水。采用时间-电流曲线法,在优化电压下测定不同浓度的牛乳α-酪蛋白溶液的响应电流,以电流变化率对牛乳α-酪蛋白浓度作图,如公式(1)为响应电流变化率计算方程:

式中:I1、I2分别代表牛乳α-酪蛋白测量前后同一时间点的响应电流,单位为A。
1.3 数据处理
所有实验数据采用Excel 2016 软件进行处理,使用Origin 2018 进行分析作图。
2 结果与分析
2.1 纳米金粒子的表征
利用紫外-可见光分光光度计对所制备纳米金溶胶吸光度进行扫描(400~700 nm),根据文献[21]报道,光吸收性胶体金在可见光范围内有一单一光吸收峰,且光吸收峰的波长在510~550 nm 波长范围内随胶体金颗粒的大小而变化,最大吸收波长为518 nm时,胶体金粒径为15 nm;最大吸收波长为522 nm时,胶体金粒径为24.5 nm。图2A 所示,在波长520 nm左右有一个单一吸收峰,其粒径可粗略估算约为15~20 nm;图2B 透射电镜(TEM)对纳米金粒子表征结果显示,其结构分布均匀,无聚集现象,呈球形颗粒状,粒径约为15~25 nm。

图2 纳米金溶胶的紫外可见光谱(A)和TEM 图(B)Fig.2 UV-vis absorption spectrum (A) and TEM image (B) of nano gold sol
2.2 纳米金修饰IgE-FcεRI 电化学免疫传感器的电化学表征
根据循环伏安图中氧化还原峰大小可粗略判断电极表面生物分子修饰情况,如图3A 所示,玻碳电极预处理后,氧化还原峰明显升高,峰电位差△E=65 mV,峰电流之比Ip,a/Ip,c 约为1,表明电极表面已处理光滑干净。
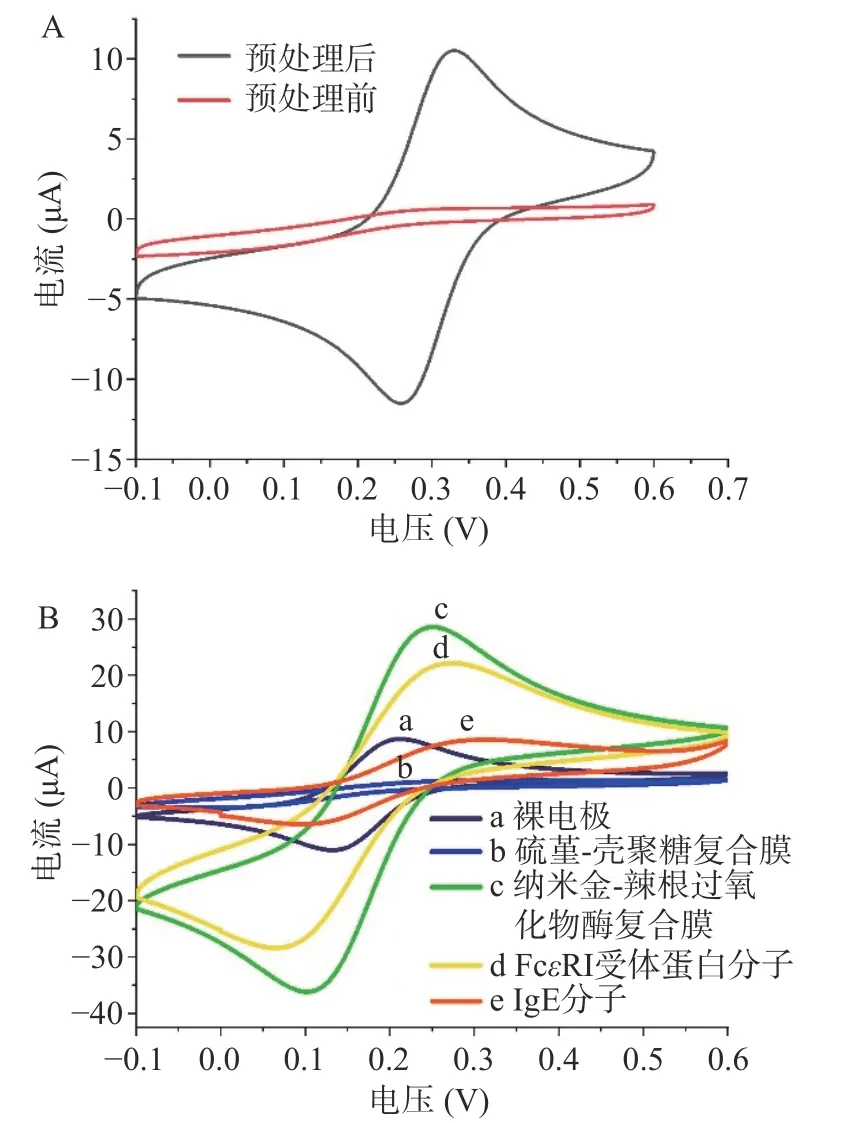
图3 纳米金修饰IgE-FcεRI 电化学免疫传感器循环伏安法表征Fig.3 Cyclic voltammetry curve of IgE-FcεRI nanobiosensor assembly process
如图3B 所示为电极组装修饰过程,因为壳聚糖膜阻碍了电子传递,预处理的电极表面(曲线a)滴加硫堇-壳聚糖(曲线b)后,峰电流迅速下降,这是由于壳聚糖膜阻碍了电子传递,说明硫堇-壳聚糖复合膜成功组装到电极表面。上述电极组装纳米金-辣根过氧化物酶复合膜后(曲线c),氧化还原峰电流迅速增大,这是因为纳米金高电子密度及介电特性提高了电子传递效率且其作用远远超过辣根过氧化物酶对电子传输的阻碍作用,同时也表明成功组装纳米金-辣根过氧化物酶复合膜。与曲线c 相比,自组装FcεRI受体蛋白后(曲线d)氧化还原峰电流略有降低,这是因为纳米金可通过Au-S 键共价结合FcεRI 受体蛋白中含巯基氨基酸(甲硫氨酸、半胱氨酸[25]),蛋白大分子的存在阻碍了电极表面的电子传递,表明FcεRI受体蛋白成功修饰到电极表面[26]。当进一步修饰血清抗体IgE 于电极表面后,氧化还原峰电流进一步降低,表明电极成功自组装吸附了抗体IgE 分子。在电极表面滴加牛血清白蛋白,进而封闭非特异性位点,传感器即构建成功[24],将组装成功的电极置于磷酸缓冲液上方4 ℃保存,备用。
2.3 测定电压优化
采用时间-电流法对制备的生物传感器在不同电位条件下进行测定,响应结果表明,电流值最大时电压为-0.38 V。如图4 所示,故选用恒定电位-0.38 V进行该生物传感器对目标物质响应特性的研究。
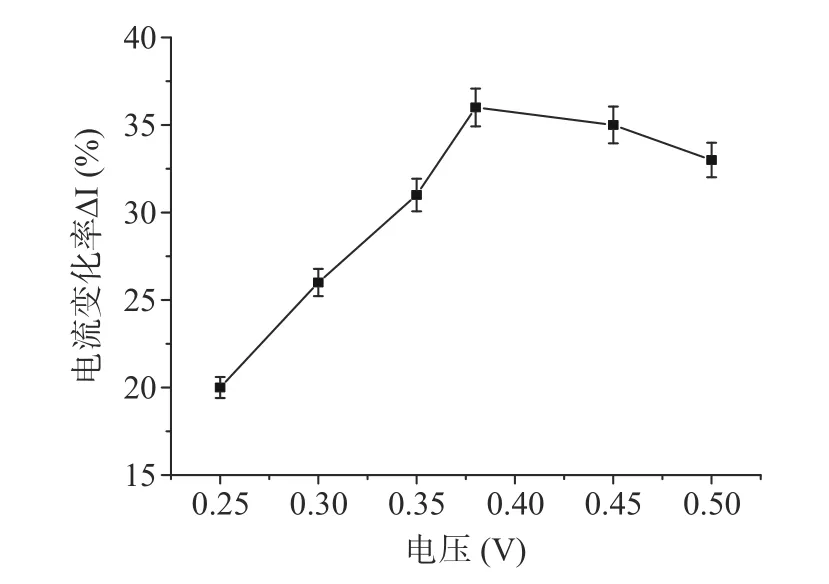
图4 传感器在不同电压下的电流变化率Fig.4 Current change rate of the sensor under different voltages
2.4 IgE-FcεRI 纳米免疫传感器与牛乳α-酪蛋白的作用规律
组装好的电极用时间-电流法进行测定,纵轴为响应电流变化率,横轴为牛乳α-酪蛋白浓度取对数lg(C)进行作图。如图5 所示,在10-12~10-10mol/L的浓度范围内,响应电流的变化率和α-酪蛋白的浓度线性相关。随牛乳α-酪蛋白浓度的增加,响应电流变化率逐渐升高并成抛物线趋势,当浓度达到10-5mol/L 时,响应电流变化率达到最大,表明IgE抗体分子被抗原蛋白大量结合。
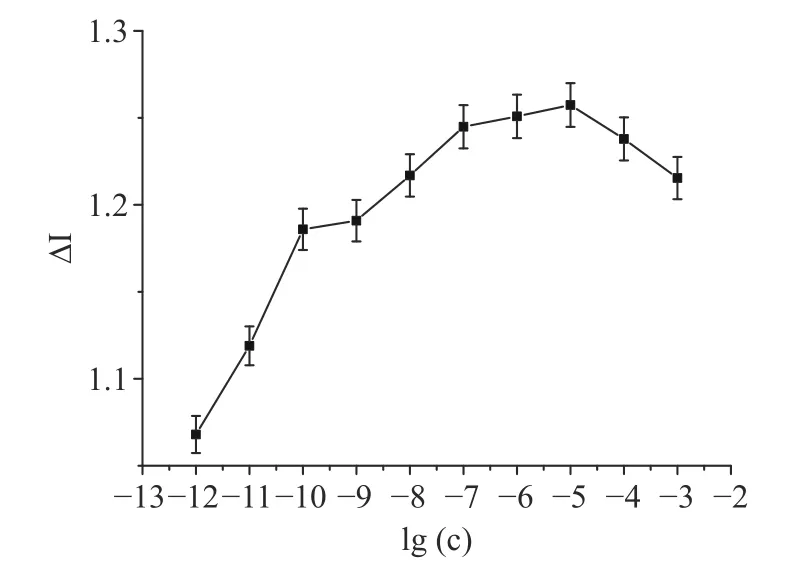
图5 牛乳α-酪蛋白在检测浓度范围内的电流变化率Fig.5 Current change rate of α-casein in the detection concentration range
2.5 IgE-FcεRI 纳米免疫传感器与牛乳α-酪蛋白作用的动力学曲线
如图6 所示,在10-12~10-10mol/L 牛乳α-酪蛋白浓度范围的基础上进一步细分,纵坐标为响应电流变化率,横坐标为牛乳α-酪蛋白浓度进行作图,受体配体反应方程如下:
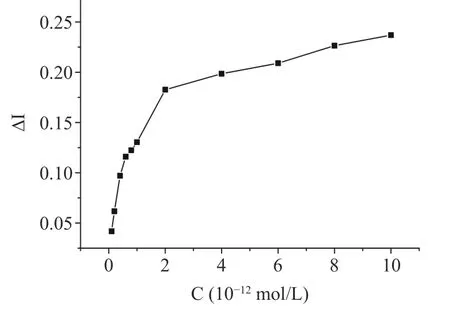
图6 α-酪蛋白在10-12~10-10 mol/L 浓度范围内的电流变化率Fig.6 Current change rate of α-casein in the concentration range of 10-12~10-10 mol/L

当受体饱和时:

[R]为受体浓度;[L]为配体浓度;[RL]为受体配体结合物的浓度;Kd为受体配体反应的常数;如果把[RT]设定为受体的初始浓度,则[R]=[RT]-[RL];如果[LT]是总配体浓度,则[L]=[LT]-[RL];将[L]=[LT]-[RL]与[R]=[RT]-[RL]代入方程(3)后,得到新式:
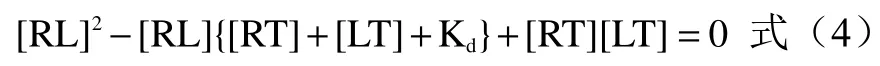
公式(4)是存在一个未知数的双曲二次方程,变量为[RL];当[RT]/Kd是固定值时,[RL]随着[LT]的改变而发生变化,在开始时会快速上升,然后逐渐达到水平,这是受体-配体相互作用的饱和曲线。该方程式表明受体-配体结合具有配体饱和作用,类似于酶-底物相互作用,底物饱和效应是酶催化的标志。因此,本研究可以用类似于米氏常数(Km)的常数(Kd)来评价IgE-FcεRI 与牛乳α-酪蛋白的作用动力学。本研究将此常数称为联动变构常数(Ka)。
图6 曲线用Origin 9.0 软件进行双曲线拟合可得如图7 所示曲线。
如图7 所示,当待测物变应原的浓度增加时,电流变化率也在随之变大,表明受体还没有达到饱和状态,在随着变应原浓度增加但电流变化率不再改变或变化很小时,表明此时受体已经达到饱和状态。上述过程和双曲线拟合的结果及得出的拟合公式(表1)共同表明了该传感器所反映的不仅是简单的IgE 与牛乳α-酪蛋白的结合,而且还模拟了体内受体与配体互作之后信号的传导。
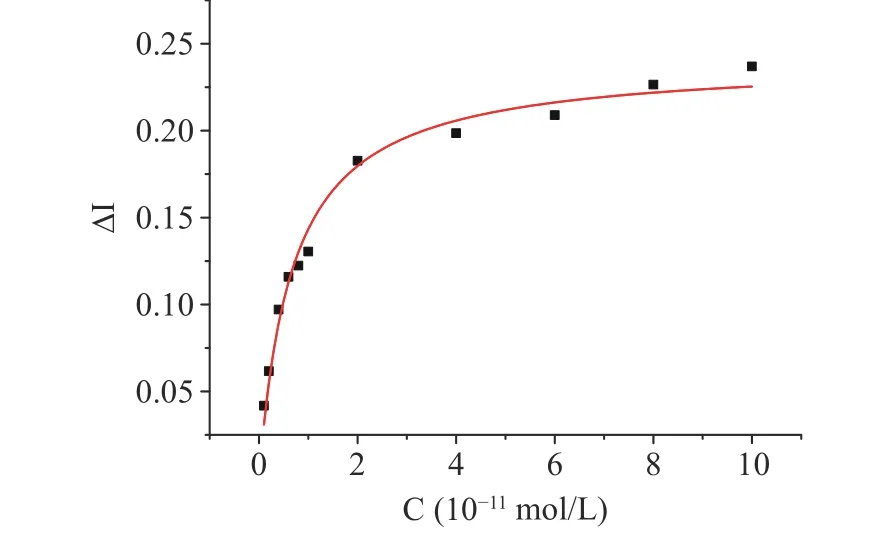
图7 α-酪蛋白在10-12~10-10 mol/L 浓度范围内的响应曲线拟合Fig.7 Fitting the response curve of α-casein in the concentration range of 10-12~10-10 mol/L

表1 α-酪蛋白在10-12~10-10 mol/L 浓度范围内的响应曲线拟合参数Table 1 Response curve fitting the response curve of α-casein in the concentration range of 10-12~10-10 mol/L
2.6 IgE-FcεRI 纳米免疫传感器与牛乳α-酪蛋白作用的联动变构常数
对公式(4)进行变形可以得到:
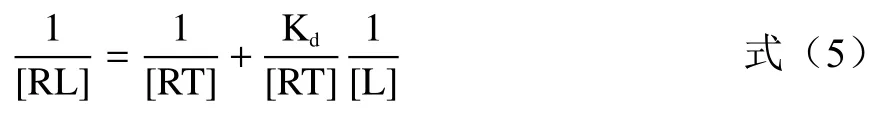
公式(5)是以纵轴为1/[RL],横轴为1/[L]的双倒数方程;Kd/[RT]为直线的斜率,-1/Kd为横轴截距,1/[RT]是纵轴截距。根据上述推导,横轴为不同浓度的变应原溶液的倒数,纵轴以电流变化率的倒数进行作图,得到图8、表2。

表2 双倒数法对α-酪蛋白(F)在10-12~10-10 mol/L浓度范围内作图Table 2 Double reciprocal method to plot α-casein(F) in the concentration range of 10-12~10-10 mol/L
根据上述推导可得拟合的线性回归方程为:
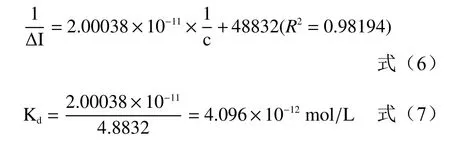
图8 和拟合方程表明,牛乳α-酪蛋白-受体相互作用的规律符合双倒数方程,由上述方程可知来源于牛乳(Bos domesticus)的α-酪蛋白的联动变构常数Ka(Kd)值为4.096×10-12mol/L。
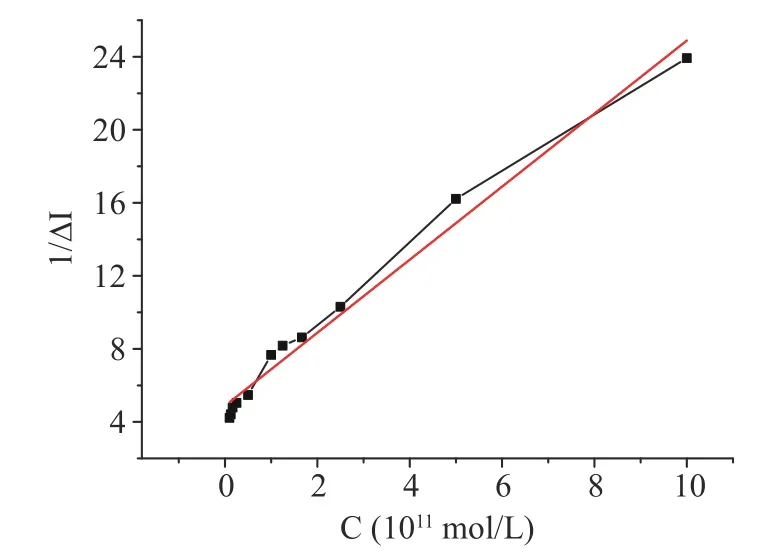
图8 双倒数法对α-酪蛋白(F)在10-12~10-10 mol/L浓度范围内作图Fig.8 Double reciprocal method to plot α-casein(F) in the concentration range of 10-12~10-10 mol/L
3 讨论
在本研究以自组装的IgE-FcεRI 纳米免疫传感器为工作电极,Ag/AgCl 为参比电极,Pt 为对电极的三电极系统测定牛乳α-酪蛋白,从而进一步研究牛乳α-酪蛋白与IgE-FcεRI 纳米免疫传感器之间的传感动力学,以实现对变应原的快速高效检测。
测定变应原有不同的方法和目的[27],主要分为以下两个方面。一方面是测定食品中是否含有过敏原、有哪些过敏原[28],目前的测定方法是酶联免疫吸附实验半定量测定方法,如表3 所列,赵凯等[29]通过使用双抗体夹心酶联免疫吸附法来测定小麦球蛋白,最低检测限为10 ng/mL。张宏立[30]使用蛋白芯片技术在IgE 的水平上测定变应原,该方法具有高通量测定的优点,但易出现假阳性,对食品加工中奶粉的过敏物质[31]和保健品[32]的测定也同理。另一方面是在临床诊断方面的应用,例如:在过敏原未知的情况下测定过敏症状由哪种过敏原引起的。当前较为常用的是皮肤点刺试验方法(The skin prick test,SPT)[33],但该方法灵敏度较低,为500 ng/mL,且SPT 结果呈阳性不一定代表患者对该食物过敏,如果没有明确的病史和确定的口服激发实验结果,SPT 阳性结果仅为无关的假阳性反应[34]。极低浓度的变应原也会引起过敏反应是当前食品行业和过敏临床诊断最为亟待解决的问题。现在迫切需要一种具有高灵敏检测特点的方法对过敏原进行测定,而纳米免疫传感器可以达到这种要求,可对低浓度的变应原进行检测。
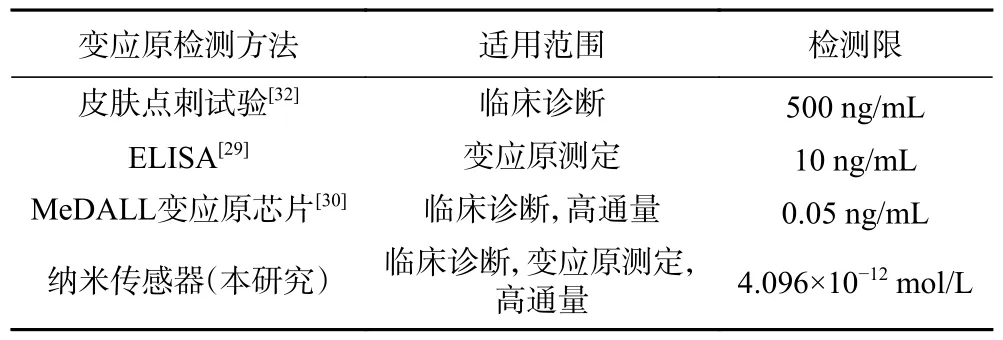
表3 变应原检测方法比较Table 3 Comparison of allergen detection methods
本研究制作的IgE-FcεRI 纳米免疫传感器制作的第一步是通过固定应用广泛的生物聚合物壳聚糖分子实现的,因为壳聚糖膜良好的生物相容性及富含-NH3+基团的三维化网状结构可以用来固定大量的纳米金粒子[34],而后具有较大比表面积和良好导电性的纳米金可以通过Au-S 键又可吸附大量FcεRI 受体蛋白;接下来在受体抗体特异性识别的背景下结合IgE,然后再组装具有良好导电性和氧化还原特性的硫堇壳聚糖,最后利用辣根过氧化物酶的高效催化性将信号放大,通过采用电化学工作站位换能器和时间-电流法测定过敏原及其动力学。通过分析电流变化率可得出不同的过敏原与IgE-FcεRI 受体的作用规律符合双曲线拟合标准(R2≧0.95),进而可计算出来源于牛乳(Bos domesticus)的α-酪蛋白的联动变构常数Ka 值为4.096×10-12mol/L。本实验方法在不依赖于组织或细胞系统的前提下使用一种新的信号转导系统模拟胞内信号传递过程,表现出良好的性能,并且具有测定灵敏度高,重复性和稳定性好的优点,证明本方法制备的纳米免疫传感器可以用于过敏原的检测。
4 结论
本研究采用自组装技术研制了一种基于壳聚糖-硫堇-纳米金-FcεRI 和过氧化物酶信号放大系统的新型高灵敏纳米传感器,并且通过时间-电流曲线以牛乳α-酪蛋白为例进行了验证,经过分析电流变化率得出牛乳α-酪蛋白和FcεRI 受体的作用规律,结果符合双曲线拟合标准R2≥0.95,利用双倒数法得到α-酪蛋白的亲和变构常数为4.096×10-12mol/L,本研究研发的生物传感器可结合变应原的特异性IgE 并实现对过敏原的超敏感检测,且其测定结果灵敏度相比目前最灵敏的方法还要高至少1 个数量级,该传感器的研发为过敏原的临床诊断、食品过敏原的安全检测、过敏原消除技术和效果评估提供了新的研究方法和思路。
本研究使用新的电极组装方法和高灵敏定量化测定过敏原的方法来模拟体内带有FcεRI 受体的肥大细胞在接触到变应原后所产生的超敏反应过程,与蛋白质芯片技术相比,更加接近人体内产生的过敏机制。
