红茶菌发酵荞麦浆醋饮的工艺优化及品质分析
2022-08-16侯晨梓卜贤盼唐德剑
韩 颖,王 茜,侯晨梓,卜贤盼,唐德剑,赵 育,
(1.陕西师范大学食品工程与营养科学学院,陕西西安 710000;2.安康市富硒产品研发中心,陕西安康 725000;3.农业农村部富硒产品开发与质量控制重点实验室,陕西安康 725000)
荞麦属蓼科(Polygonaceae)荞麦属(Fagopyrum)植物,又名三角麦、乌麦等,目前主要有甜荞(Buckwheat)和苦荞(Tartary buckwheat)两个栽培品种[1]。荞麦作为一种杂粮作物和药食同源食材,不仅含有丰富的膳食纤维、多种维生素及较为均衡的氨基酸蛋白质等,还富含生物类黄酮及高活性蛋白等生物活性成分,特别是其含有较多其他谷类粮食作物缺乏的黄酮类化合物,具有抗氧化、抗炎症、降三高等多种生理功效,是一种集营养、保健、治疗于一体的健康食品[2]。近年来,随着人们健康意识的提高,对荞麦及其制品的研究开发逐渐受到重视,如利用荞麦制酒、茶以及面包和药品等。
红茶菌饮料又名康普茶、海宝或胃宝,是以红茶/绿茶为原料,加入蔗糖,以糖茶水为发酵基质,由醋酸菌、酵母菌及乳酸菌等多种微生物共同发酵而形成的传统酸性饮料[3]。红茶菌饮料中含有丰富的醋酸、葡萄糖酸、D-葡萄糖二酸-1,4-内酯、乳酸、茶多酚及氨基酸等有益成分,具有抑菌、提高机体免疫、抗癌及预防高血脂、高血压等心血管疾病的保健功效[4-5]。
近年来,随着消费者健康保健意识的提升,国内外对红茶菌饮料的研究越来越广泛和深入,其原料的选择越来越丰富,例如以果汁、蔬菜汁、牛奶和葛根等多种原料为底物,发酵得到与传统红茶菌饮料风格各异,具有特殊风味和特定保健功能的新型红茶菌醋饮[6-7]。与其他发酵食品相同,红茶菌饮料的风味和品质控制受到菌种及发酵工艺等因素的影响。目前国内对红茶菌发酵饮料的工艺条件优化主要集中在发酵温度、初始pH、茶叶浓度、加糖量和接种量等方面,一般通过总酸含量、感官评分等评价指标确定最优发酵条件[8]。
目前,荞麦和红茶菌这两种具有很强功能性的食品正处于研究热点,而将两者结合起来,采用红茶菌发酵荞麦浆制备醋饮的工艺研究还未见报道。因此,本研究以荞麦浆为原料,采用红茶菌对其进行发酵,探究荞麦浆可溶性固形物含量(soluble solid content,SSC)、红茶菌接种量及发酵温度对荞麦浆发酵醋饮品质的影响,以总酸含量及感官评价为指标确定各因素最优参数,得出红茶菌发酵荞麦浆的理想工艺条件,同时,在此优化条件下,测定了发酵后荞麦浆醋饮有机酸、总酚、总黄酮等理化指标。本研究旨在将荞麦和红茶菌两种具有功能性的食品结合到一起,通过酒精发酵、乳酸发酵、醋酸发酵这一复合发酵,得到一款具有双重保健功效的功能性醋饮,研究结果将为荞麦以及红茶菌的精深开发及产业链的延伸提供新的思路和参考。
1 材料与方法
1.1 材料与仪器
荞麦粉 靖边县荞庆源农产品加工有限公司;红茶菌 陕西师范大学果蔬深加工工程技术研究中心提供;α-淀粉酶 生物试剂,酶活≥3700 U/g,北京奥博星生物技术有限责任公司;碱性蛋白酶 分析纯,酶活≥200000 U/g,英国BDH 公司;福林酚 分析纯,Sigma-Aldrich 上海贸易有限公司;没食子酸分析纯,天津大茂化学试剂厂;芦丁 分析纯,上海Dadmas-Beta 有限公司;丙二酸、苹果酸、乳酸、琥珀酸、冰乙酸、富马酸 分析纯,上海源叶生物科技有限公司。
GSP-9080MBE 型隔水式恒温培养箱 上海博迅实业有限公司医疗设备厂;WFJ2000 型可见分光光度计 上海龙尼科仪器有限公司;Ultimate3000 型高效液相色谱仪 Thermo 公司。
1.2 实验方法
1.2.1 红茶菌的活化 参考Cvetkovic 等[9]的方法制备红茶菌培养液,将茶叶与水以质量比1:400 取量,待水沸腾后放入茶叶包及10%白糖,搅拌溶解后取出茶包,冷却至35 ℃以下备用。将制备好的培养液装入无菌大容量烧杯中,加入10%原菌液,纱布封口,置于30 ℃温箱中培养7 d。
1.2.2 荞麦发酵醋饮制备工艺流程

1.2.3 红茶菌发酵荞麦浆操作要点 荞麦浆制备:将荞麦粉与水以1:10 混合,预煮至90 ℃保持1 h,制成荞麦原液。在荞麦原液中加入0.30%α-淀粉酶,0.20%碱性蛋白酶,于50 ℃下酶解6 h,升温至90 ℃保持15 min,并于100 ℃煮沸10 min 使淀粉充分液化,以碘液测试为浅黄色为液化终点,用无菌纱布过滤样液,得到荞麦浆。
红茶菌的接种:在制备好的荞麦浆中加入10%活化后的红茶菌液,纱布封口,得到荞麦浆待发酵液。
荞麦浆的发酵:将制备好的荞麦浆待发酵液置于30 ℃条件下发酵9 d(经预实验证明发酵9 d 后发酵液总酸含量无明显变化)。
过滤与灭菌:发酵9 d 后得到荞麦浆发酵液,纱布过滤,于121 ℃下高压灭菌15 min,冷却,即得到红茶菌荞麦醋饮成品。
1.2.4 红茶菌发酵荞麦浆单因素实验
1.2.4.1 荞麦浆SSC 确定 经测定荞麦浆原液SSC为8%,为确定红茶菌发酵荞麦浆的最适荞麦浆SSC,通过采用蒸馏水稀释荞麦浆或向荞麦浆中加白砂糖而使荞麦浆SSC 达到7%、10%、13%、16%,接入10%红茶菌液,纱布封口,于30 ℃条件下发酵9 d(经预实验证明发酵9 d 后发酵液总酸含量无明显变化),发酵过程中每天取样测定发酵液总酸含量。
1.2.4.2 红茶菌接种量确定 为确定红茶菌在荞麦浆中的最适接种量,调整荞麦浆SSC 为10%,分别接入5%、10%、15%、20%红茶菌,纱布封口,于30 ℃条件下发酵9 d(经预实验证明发酵9 d 后发酵液总酸含量无明显变化),发酵过程中每天取样测定发酵液总酸含量。
1.2.4.3 发酵温度确定 为确定红茶菌发酵荞麦浆最适温度,调整荞麦浆SSC 为10%,接入10%红茶菌液,纱布封口,分别于20、25、30、35 ℃下至发酵发酵9 d(经预实验证明发酵9 d 后发酵液总酸含量无明显变化),发酵过程中每天取样测定发酵液总酸含量。
1.2.5 红茶菌发酵荞麦浆工艺正交试验 参考Wang等[10]的方法,以总酸含量为指标筛选出最佳单因素条件,根据单因素实验结果设计L9(34)正交表进行正交试验,正交试验因素水平如表1 所示,以总酸及感官评价为指标确定红茶菌发酵荞麦浆的最佳工艺条件。

表1 红茶菌发酵荞麦浆工艺正交试验因素水平设计Table 1 Orthogonal test factor level table of kombucha fermented buckwheat milk syrup process
综合加权评分法参考李敏等[11]的方法,在红茶菌发酵荞麦浆正交试验中,对总酸含量和感官评分两项指标进行综合加权评分,确定各指标权重,以满分100 分计。总酸含量权重分值40 分,感官评价权重分值60 分,综合评分为各指标加权评分之和。
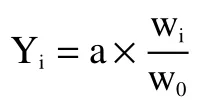
式中:Yi表示指标加权得分,分;a 表示指标权重分值,分;Wi表示指标实际试验结果,g/L 或分;W0表示最佳试验结果(总酸最佳值为36.15 g/L,感官评分最佳值为88 分),g/L 或分。
1.2.6 指标测定
1.2.6.1 总酸含量测定 参考GB/T 12456-2021[12]《食品中总酸的测定》,采用酸碱滴定法。
1.2.6.2 感官评价 荞麦醋饮的感官评分标准如表2所示,为保证不同发酵样品感官评价结果的准确性与标准化,对所选取的10 名感官评定人员(男女比例1:1)进行红茶菌感官属性的认知与鉴评培训,使各感官评定人员对红茶菌的香气、口感、形态与色泽特性和强度进行了解,并确定了描述红茶菌感官品质的特征术语。

表2 荞麦浆醋饮感官评定标准Table 2 Criteria for sensory evaluation of buckwheat fermented beverage
1.2.6.3 荞麦浆发酵过程中pH 测定 参考GB/T 5009.237-2016[13]《食品pH 值的测定》,使用pH 计直接测定。
1.2.6.4 荞麦浆发酵过程中还原糖含量测定 参考索化夷等[14]的方法绘制葡萄糖标准曲线。建立回归方程为:y=0.9864x-0.0024,决定系数R2=0.9981。取发酵样液1 mL,按葡萄糖标准曲线步骤进行,根据回归方程计算还原糖含量。
1.2.6.5 荞麦浆发酵过程中总酚含量测定 采用Folin-Ciocalteu 法测定总酚含量,参考Wu 等的方法[15]绘制没食子酸标准曲线。建立回归方程为y=15.618x+0.0652,决定系数R2=0.9919。
发酵样液中总酚含量测定:吸取样品0.5 mL,按没食子酸标准曲线步骤进行,采用回归方程计算荞麦浆发酵液总酚含量。
1.2.6.6 荞麦浆发酵过程中总黄酮含量测定 参考Li 等的方法[16]绘制芦丁标准曲线。建立回归方程为y=0.7724x-0.016,决定系数R2=0.9923。
发酵样液中总黄酮含量测定:取1 mL 样液,按芦丁标准曲线步骤进行,采用回归方程计算发酵液中总黄酮含量。
1.2.6.7 荞麦浆发酵过程中有机酸含量测定 采用HPLC 法测定[17],DiamonsilC18色谱柱,流动相为0.04 mol/L 磷酸二氢钾(pH2.7),流速0.4 mL/min,柱温30 ℃,进样量20 μL,检测波长210 nm。
样品测定:取发酵后荞麦浆上清液,经0.22 μm滤膜过滤,滤液用于上机分析。
1.3 数据处理
所有试验均做3 个重复测定,结果表示为平均值±标准差。数据统计及作图使用Excel 2010 软件进行,采用SPSS 24.0 软件对数据进行显著性分析(P<0.05)。
2 结果与分析
2.1 红茶菌发酵荞麦浆工艺的单因素实验
2.1.1 SSC 对荞麦浆发酵过程中总酸的影响 由图1可知,荞麦浆初始可溶性固形物含量影响荞麦浆发酵过程中总酸含量,不同SSC 的荞麦浆在发酵前7 d总酸含量均迅速上升,继续发酵总酸含量逐渐趋于稳定,至第9 d 时总酸含量无明显变化,其中SSC 为13%的荞麦浆发酵液总酸含量最高,达到33.08 g/L,其次为SSC 为10%、16%和7%的荞麦浆发酵液,对应总酸含量由高到低依次为31.57、30.76 和23.92 g/L。结果表明红茶菌发酵SSC 为13%的荞麦浆时具有较好的产酸能力,能获得总酸含量较高的荞麦浆发酵液。

图1 SSC 对荞麦浆发酵过程中总酸的影响Fig.1 Effects of SSC on the total acid in the fermentation process of buckwheat syrup
2.1.2 红茶菌接种量对荞麦浆发酵过程中总酸的影响 由图2 可知,红茶菌接种量影响荞麦浆发酵过程中总酸含量,不同红茶菌接种量的荞麦浆在发酵过程中总酸含量均呈上升趋势,第8 d 起趋于稳定,至发酵第9 d 时发酵液总酸含量由高到低依次为红茶菌接种量为15%、20%、10%和5%的荞麦浆发酵液,对应总酸含量由高到低依次为36.64、35.64、35.80 和34.76 g/L。结果表明当红茶菌接种量为15%时,能够获得总酸含量较高的荞麦浆发酵液。

图2 红茶菌接种量对荞麦浆发酵过程中总酸的影响Fig.2 Effects of kombucha inoculation amount on total acid in the fermentation process of buckwheat syrup
2.1.3 发酵温度对荞麦浆发酵过程中总酸的影响由图3 可知,发酵温度影响荞麦浆发酵过程中总酸含量,不同发酵温度下荞麦浆发酵液总酸含量在发酵前8 d 时迅速上升,发酵第9 d 时总酸含量无明显变化,至发酵第9 d 时发酵液总酸含量由高到低依次为于30、35、25 和20 ℃条件下发酵的荞麦浆,对应总酸含量依次为36.56、33.00、27.80 和19.16 g/L。结果表明发酵温度为30 ℃时更利于红茶菌发酵荞麦浆,此条件下能够获得总酸含量较高的荞麦浆发酵液。

图3 发酵温度对荞麦浆发酵过程中总酸的影响Fig.3 Effects of fermentation temperature on the total acid in the fermentation process of buckwheat syrup
2.2 红茶菌发酵荞麦浆工艺正交试验
红茶菌发酵荞麦浆工艺正交试验结果及直观分析如表3 所示,各因素对荞麦浆发酵液总酸含量影响大小为发酵温度>荞麦浆SSC>红茶菌接种量;由总酸含量方差分析表4 可知,荞麦浆SSC 和红茶菌接种量对荞麦浆发酵液总酸含量具有显著性影响(P<0.05),发酵温度对荞麦浆发酵液总酸含量影响极显著(P<0.01)。总酸含量正交试验优组合为A2B2C2,即荞麦浆SSC13%、红茶菌接种量15%、发酵温度30 ℃。
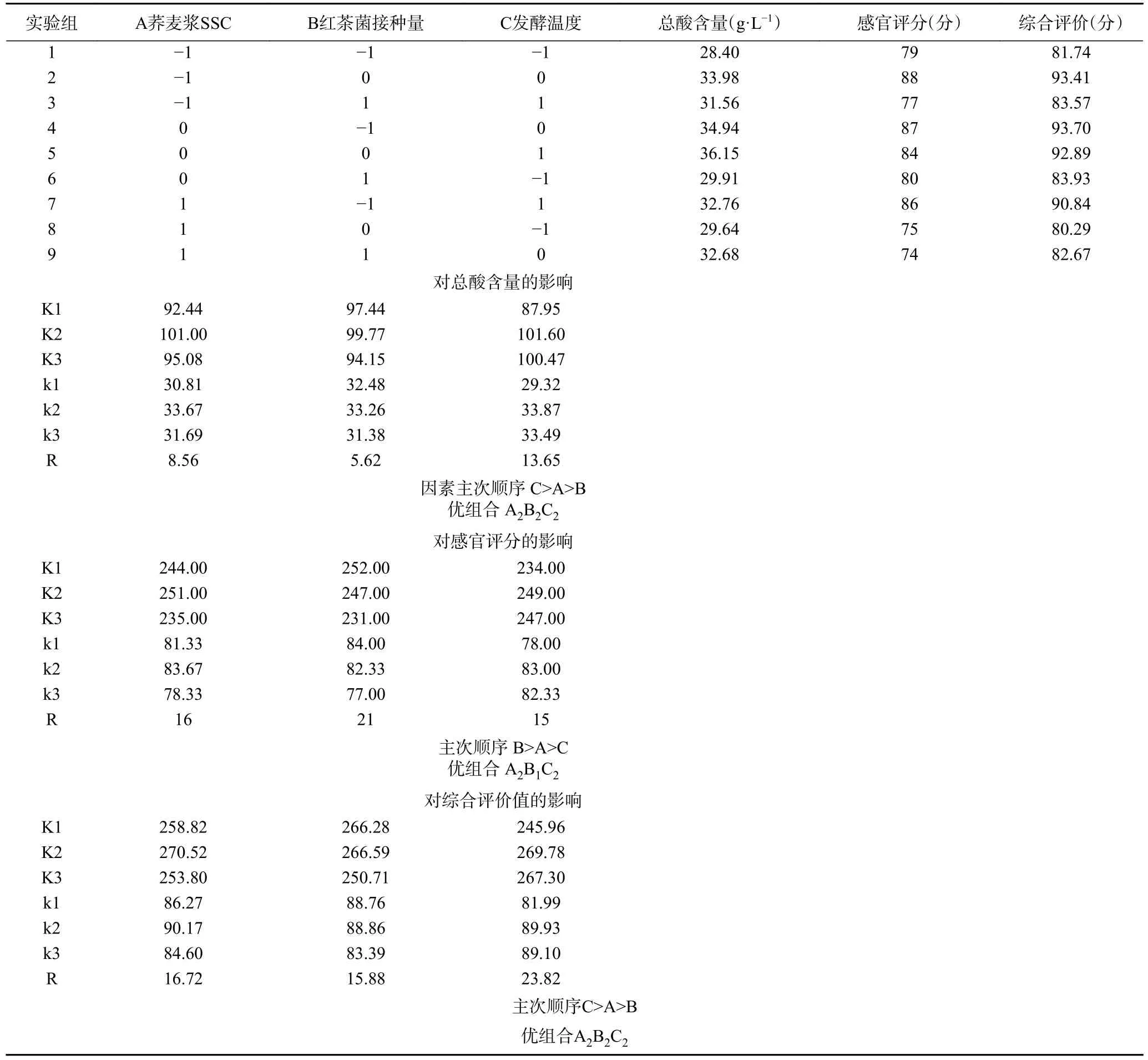
表3 红茶菌发酵荞麦浆工艺正交试验结果及直观分析Table 3 Orthogonal test results and visual analysis of kombucha fermented buckwheat syrup process
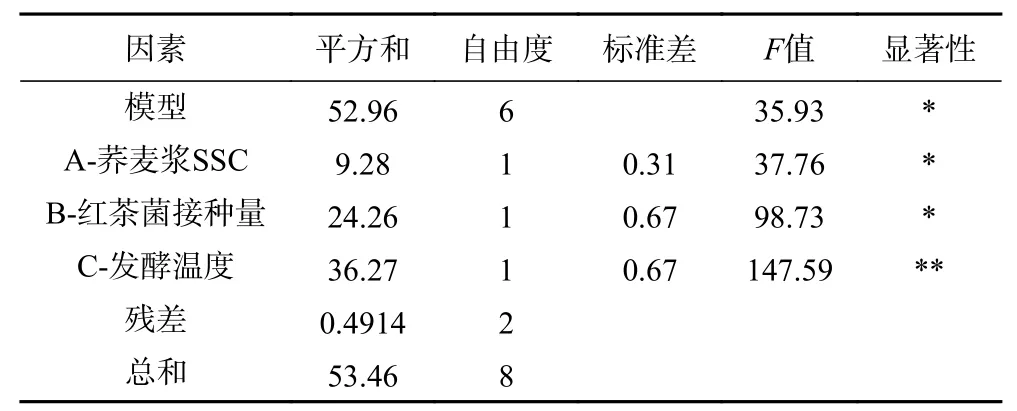
表4 总酸含量方差分析结果Table 4 Results of variance analysis of total acid content
由表3 可知,各因素对荞麦浆发酵液感官评分影响大小为红茶菌接种量>荞麦浆SSC>发酵温度;由感官评分方差分析表5 可知,荞麦浆SSC 及红茶菌接种量对荞麦浆发酵液感官评分具有显著性影响(P<0.05),发酵温度对荞麦浆发酵液感官评分影响极显著(P<0.01);感官评分正交试验优组合为A2B1C2,即荞麦浆SSC13%、红茶菌接种量10%、发酵温度30 ℃。
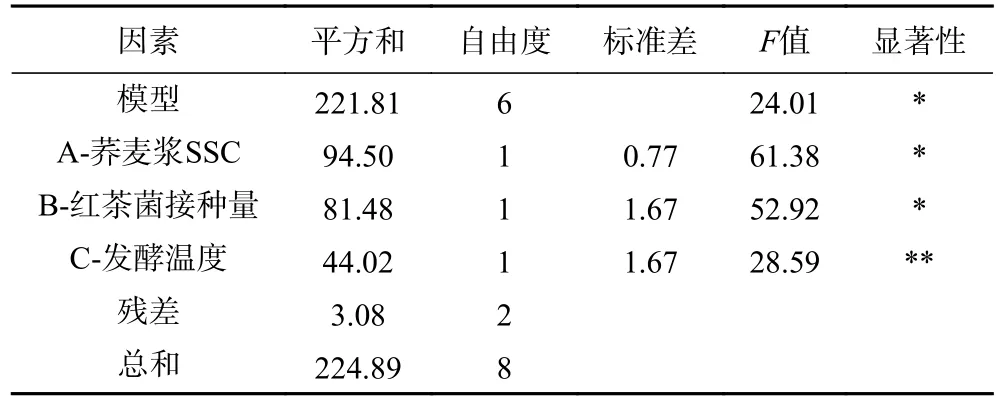
表5 感官评价方差分析结果Table 5 Results of variance analysis of sensory evaluation
正交试验结果不一致时,通过综合评价值选出最优配方。综合评价值由总酸含量(Y1)、感官评分(Y2)加权得出。考虑消费者对于感官评分重视程度,设定感官评价权重值最大,总酸含量次之。
综合评价值直观分析如表3 所示,正交试验中所得综合评价值最高组合为荞麦浆SSC10%、红茶菌接种量10%、发酵温度30 ℃,此条件下得到的荞麦浆发酵液总酸浓度为34.94 g/L,感官评分为87分;对正交试验结果进行直观分析,得出综合评价值优组合为A2B2C2,即荞麦浆SSC13%、红茶菌接种量15%、发酵温度30 ℃,各因素对荞麦浆发酵液综合评分影响为发酵温度>荞麦浆SSC>红茶菌接种量,因此,下文荞麦醋饮的制备条件选取综合评价值优组合A2B2C2,即在荞麦浆SSC13%、红茶菌接种量15%、发酵温度30 ℃制备荞麦醋饮。此外,由综合评价方差分析表6 可知,荞麦浆SSC、红茶菌接种量、发酵温度均对荞麦浆发酵液综合评分影响显著(P<0.05)。
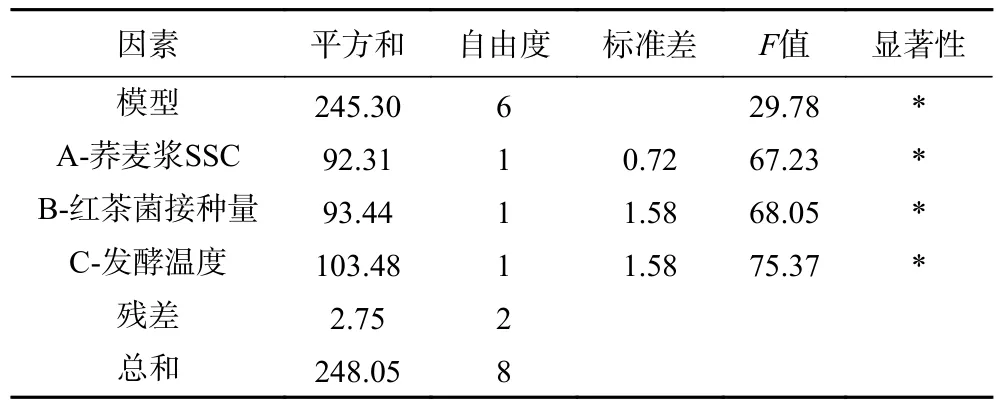
表6 综合评价方差分析结果Table 6 Results of variance analysis of comprehensive evaluation
2.3 荞麦浆发酵过程中pH 及总酸含量变化
选取正交试验最优因素水平,当荞麦浆SSC13%,红茶菌添加量15%,发酵温度30 ℃时对荞麦浆用红茶菌进行发酵,荞麦浆发酵过程中pH 和总酸含量变化由图4 所示,荞麦浆pH 在发酵前8 d 时显著下降(P<0.05),继续发酵pH 趋于稳定,第9 d 时pH 降为3.10;荞麦浆总酸含量在发酵过程中显著上升(P<0.05),由发酵第0 d 的6.72 g/L 上升至第9 d 的32.96 g/L。
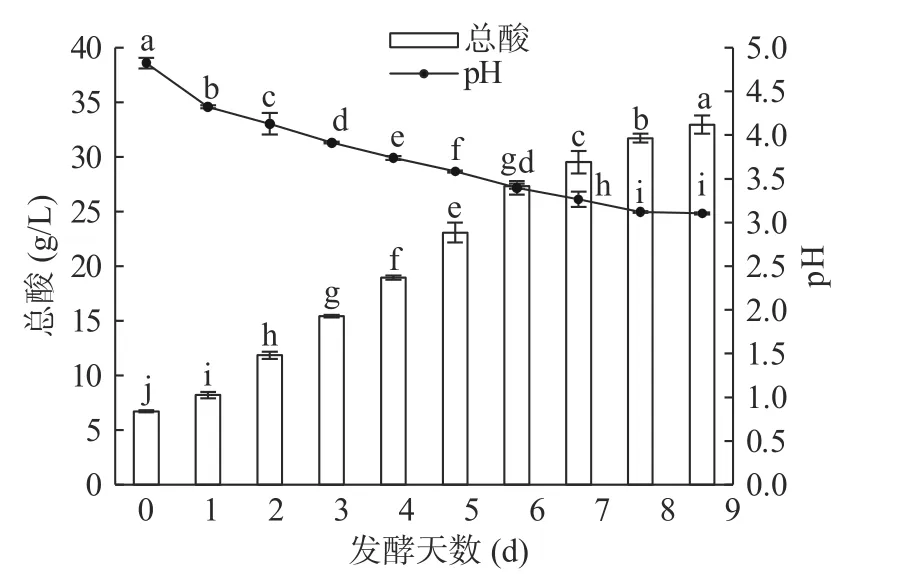
图4 荞麦浆发酵过程中pH 和总酸含量变化Fig.4 Changes in pH and total acid concentration of buckwheat syrup during the fermentation
2.4 荞麦浆发酵过程中还原糖含量变化
在最优因素水平下对荞麦浆进行红茶菌发酵,荞麦浆发酵过程中还原糖含量变化如图5 所示,还原糖含量在发酵前5 d 时呈显著上升趋势(P<0.05),由第0 d 的8.60 g/L 上升到第5 d 的29.09 g/L,继续发酵还原糖含量显著下降(P<0.05),至第9 d 还原糖含量降至最低3.71 g/L。
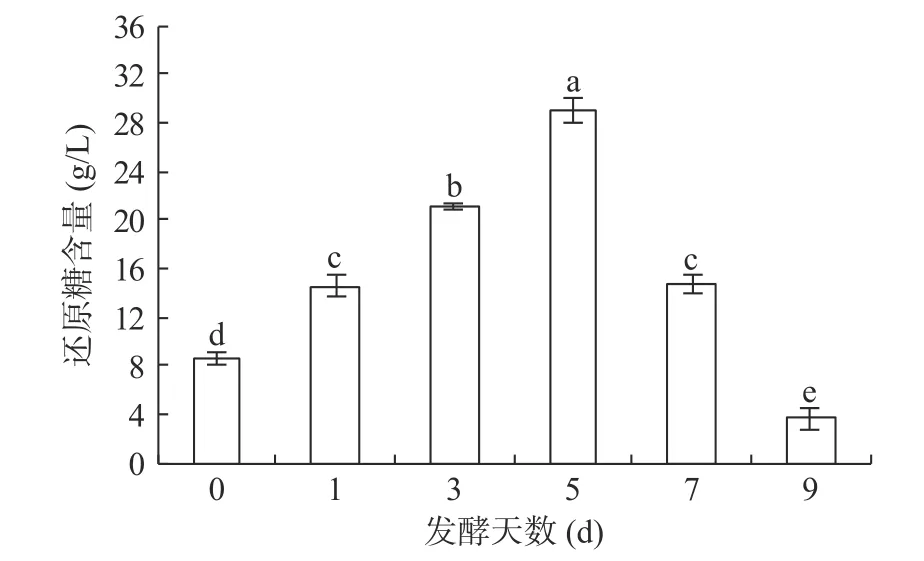
图5 荞麦浆发酵过程中还原糖含量变化Fig.5 Changes of reducing sugar content in buckwheat syrup during the fermentation
2.5 荞麦浆发酵过程中总酚及总黄酮含量变化
由图6a 可知,荞麦浆在发酵过程中总酚含量呈显著上升(P<0.05),由第0 d 的0.78 g/L 上升到第9 d的1.72 g/L;荞麦浆在发酵过程中总黄酮含量变化由图6b 所示,发酵前3 d 发酵液中总黄酮含量显著下降(P<0.05),由第0 d 的2.05 g/L 下降至第3 d 的1.52 g/L,继续发酵发酵液中黄酮含量显著上升(P<0.05),至第9 d 时上升为2.55 g/L,且发酵液最终总黄酮含量显著高于初始黄酮含量(P<0.05)。

图6 荞麦浆发酵过程中总酚及总黄酮含量变化Fig.6 Changes in contents of total phenols and flavonoids in buckwheat syrup during the fermentation
2.6 荞麦浆发酵过程中有机酸含量变化
2.6.1 有机酸混合标品线性关系 不同有机酸保留时间、峰面积及标准曲线方程由表7 所示,各有机酸标准品决定系数(R2)均大于0.9910,呈现出良好的线性关系和高拟合置信度。

表7 不同有机酸保留时间、峰面积及标准曲线方程Table 7 Retention time,peak area and standard curve equation of different organic acids
2.6.2 荞麦浆发酵过程中有机酸含量变化 红茶菌发酵荞麦浆过程中有机酸含量变化如表8 所示,在发酵过程中乙酸含量始终呈显著上升(P<0.05),为荞麦浆发酵过程中产生的主要有机酸种类,由第0 d的1.40 g/L 上升至第9 d 的18.53 g/L;乳酸含量在发酵过程中由第0 d 的0.48 g/L 显著上升到第9 d的6.46 g/L(P<0.05),至第9 d 时含量仅次于乙酸;苹果酸含量在发酵前7 d 显著上升(P<0.05),至第7 d时含量达到最高7.19 g/L,继续发酵苹果酸含量显著下降(P<0.05);丙二酸含量在发酵前5 d 显著上升(P<0.05),至第5 d 时含量达到最高12.28 g/L,继续发酵丙二酸含量显著下降(P<0.05);琥珀酸含量在发酵过程中先明显上升后趋于稳定,发酵第9 d 时含量为3.99 g/L;富马酸含量在发酵过程中无显著变化且含量较低(P>0.05),发酵至第9 d 时富马酸含量为0.04 g/L。

表8 荞麦浆发酵过程中各有机酸含量变化Table 8 Changes in the contents of organic acids during the fermentation of buckwheat syrup
3 讨论
在红茶菌发酵荞麦浆工艺单因素实验中,无论SSC 是多少,发酵过程中总酸含量均上升。这是由于在荞麦浆中添加适量蔗糖后,红茶菌中的酵母菌、醋酸菌和乳酸菌利用蔗糖和其他营养元素生成了乙酸等有机酸,导致总酸含量上升;若初始SSC 太高,可能对酵母菌发酵产生一定的抑制作用,因此当SSC 超过13%时,总酸含量又有所降低[18]。宋清鹏等[19]对红茶菌发酵饮料的研究也表明初始SSC 为14%时,产酸量最高,其次为10%、18%和6%,因此确保适宜的SSC 有利于控制菌种发酵程度。
在红茶菌接种量对总酸含量的影响试验中,发酵至第9 d 时接种15%红茶菌的发酵液总酸含量最高,其次分别为接种量20%、10%和5%的荞麦浆,这是由于当红茶菌接种量不断增加,菌体大量生长繁殖促进发酵,但接种量过高一方面会使菌体大量繁殖使发酵液中的营养成分被过度分解利用,导致发酵液总酸含量下降,另一方面菌体大量繁殖会产生大量代谢产物导致细胞出现老化、自溶等现象[18]。
在对适宜发酵温度的确定试验中,至发酵第9 d时在30 ℃条件下能获得总酸含量最高的荞麦浆发酵液,其次为25、20 和35 ℃条件下得到的发酵液,这是由于当发酵温度升高时,微生物细胞内酶活性提高,微生物生长加快,促进发酵从而产酸较高;但温度过高会加速菌体的生长,使得菌体提前老化,因此导致发酵液总酸含量降低[20]。
红茶菌在发酵荞麦浆的过程中产生酸而引起发酵液pH 下降,在发酵至第9 d 时发酵液pH 降为最低3.10。红茶菌发酵荞麦浆包括乙醇发酵和醋酸发酵两个阶段,发酵初期为乙醇发酵阶段,此时主要由酵母菌利用蔗糖产生乙醇和CO2,后期为醋酸发酵阶段,醋酸菌利用初期酵母产生的乙醇生成乙酸等多种有机酸,此外,乳酸菌利用酵母菌的代谢产物逐渐生长繁殖,并产生乳酸[21]。有机酸的生成引起发酵液pH 降低,荞麦浆在发酵8~9 d 时pH 无明显变化,此时总酸含量仍在增加,这可能是由于红茶菌液具有缓冲作用,当红茶菌发酵生成的CO2于水后会产生HCO3-,与有机酸所释放的H+发生反应,导致即使在醋酸发酵阶段能够产生大量的酸而pH 仍保持稳定[22]。
荞麦浆在发酵过程中还原糖含量呈现先上升后下降趋势,这是由于在红茶菌乙醇发酵阶段,由于醋酸菌不能直接利用蔗糖或利用蔗糖速度很慢,此时酵母菌成为主要生长代谢菌,将蔗糖分解为葡萄糖和果糖[23],从而使发酵液中还原糖含量显著上升(P<0.05)。继续发酵至发酵液中累积有足量葡萄糖、果糖和乙醇,此时醋酸菌开始大量生长繁殖,使葡萄糖、果糖氧化生成葡萄糖酸、乙酸等代谢产物,同时醋酸菌将酵母菌产生的乙醇氧化生成乙酸[24],因此还原糖含量开始下降。
荞麦浆在发酵过程中总酚含量呈上升趋势,总黄酮含量在发酵前3 d 时逐渐降低,继续发酵时呈上升趋势。荞麦浆发酵过程中总酚及总黄酮含量的上升可能是由于荞麦浆中存在残渣,在发酵过程中由于发酵液酸碱度的变化及微生物分泌出各种酶等,使得残渣中结合态酚类及黄酮类化合物分解溶出[25-26];另一方面,红茶菌可能将原料中本身的大分子的多酚和黄酮类物质变成了新的小的酚类及黄酮类化合物,使多酚和黄酮的种类及含量增加[27];而发酵初期发酵液中总黄酮含量下降可能是由于在发酵初期游离态的黄酮醇类物质易与醋液中糖苷结合形成配糖体,使黄酮类物质中的毛地黄黄酮、杨梅黄酮、山奈酚及槲皮素含量降低[28]。
乙酸为红茶菌发酵荞麦浆过程中产生的主要有机酸种类,在发酵初期乙醇发酵阶段,乳酸菌生长繁殖使乳酸含量显著上升(P<0.05),酵母菌可将丙酮酸转化为乙酸,使乙酸含量显著上升(P<0.05),同时酵母菌在乙醇发酵过程中可生成琥珀酸,琥珀酸含量呈显著上升趋势(P<0.05)[29],苹果酸及丙二酸随着发酵的进行含量逐渐上升;继续发酵进入醋酸发酵阶段,醋酸菌在有氧条件下大量生长繁殖,将葡萄糖和乙醇氧化为乙酸,致使乙酸含量大幅增加[18];此外,醋酸菌能够氧化糖类物质为葡萄糖酮酸或葡萄糖酸,再进一步氧化生成乳酸及琥珀酸,在发酵末期部分乳酸菌可通过苹果酸-乳酸发酵(Malo-lactic fermentation,MLF)较为专一地分解苹果酸,生成乳酸和CO2[30],这也对发酵末期发酵液中苹果酸含量有显著下降进行了解释;富马酸作为各个代谢途径的中间产物,随着醋酸发酵的进行变化趋势不显著且含量不高,表明富马酸在微生物代谢途径中不易大量积累[31]。
4 结论
本研究以荞麦粉为原料,采用红茶菌发酵制备荞麦浆醋饮。考察初始荞麦浆SSC、红茶菌接种量、发酵温度对荞麦浆发酵液总酸含量和感官评分的影响,确定荞麦浆最佳发酵工艺条件为荞麦浆SSC13%、红茶菌接种量15%、发酵温度30 ℃;将最佳发酵条件用于红茶菌发酵荞麦醋饮,发酵结束时发酵液总酸含量为32.96 g/L,总酚和总黄酮含量均较发酵前显著上升(P<0.05);经测定在发酵过程中发酵液乙酸含量增幅最显著(P<0.05),至发酵结束时乙酸含量为18.53 g/L,其次为乳酸及琥珀酸。总体而言,通过红茶菌发酵制得的荞麦醋饮酸度适宜、口感柔和,具有良好的荞麦酿造气味,并且较荞麦浆本身具有更高的营养价值,能够为开发一种具备保健功能的荞麦醋饮料提供参考。然而由于红茶菌菌种组成复杂,易被污染,难以确保红茶菌发酵饮料的稳定性及安全性,因此,在今后的研究中应深入探究和解决这两个问题,为实际生产提供理论依据。
