益生菌与肠道菌群、免疫调节的相互作用与机制研究进展
2022-08-16唐曼玉王晚晴强敬雯李亚丽李春庚程艳玲
唐曼玉,王晚晴,2, ,强敬雯,华 威,2,武 双,2,李亚丽,甄 新,李春庚,程艳玲,2,
(1.北京联合大学生物化学工程学院,北京 100023;2.生物质废弃物资源化利用北京市重点实验室,北京 100023)
益生菌是是人体健康不可缺少的活菌或有益微生物,其可合成各种维生素、参与食物的消化、促进肠道蠕动、抑制致病菌群的生长、分解有害有毒物质等,对消化系统、呼吸系统、生殖系统等的免疫细胞、代谢调控与免疫互作方面发挥作用而引起越来越广泛的关注[1]。益生菌通过直接或间接的调整宿主肠道微生物的组成来激活宿主内源性微生物或免疫系统活性。直接影响是指某些益生菌的摄入可以直接改变肠道内固有菌群的结构;间接影响指益生菌的摄入可能影响某些肠道菌群的代谢,进而改变肠道中短链脂肪酸和总胆汁酸的含量以及细菌酶活性和矿物质离子的吸收[2]。益生菌在肠道内大量繁殖,通过调节紊乱的菌群结构以提高机体免疫力,促进人体健康。
益生菌是医学上开始从“以菌抑菌”走向“以菌制菌”的标志菌,是人体肠道坚固的生物屏障[3],对机体健康有重要作用,其通过争夺肠道营养物质和粘附位置定植于肠道以抑制有害菌的生长繁殖,并刺激人体自身的免疫系统来发挥效力[4]。国内外已有较多益生菌对肠道健康影响的文章报道[5]。基于此,本文综述了益生菌与肠道菌群互作,调控肠道功能及免疫调节机制,为益生菌在分子水平的理论研究提供参考。
1 益生菌与肠道菌群的关系
肠道是体内最大的内分泌器官,肠道菌群可将食物发酵生成短链脂肪酸、次级胆汁酸和氨基酸代谢物等代谢产物[6]。这些代谢产物会直接或间接影响宿主生理病理过程,对维持宿主健康起着重要作用。肠道菌群失调会改变宿主体内的平衡,扰乱宿主的代谢,破坏肠道上皮细胞并引起炎症,进而引发疾病[7]。而补充益生菌是最直接增加肠内有益菌的方法,益生菌可以对肠道菌群发挥多种生物学作用,维持正常肠道菌群和抑制病原菌,改善和维持肠道功能,参与营养和代谢,调节免疫系统的功能,调节内分泌。
益生菌与肠道菌群的互作可用于开发治疗腹泻或肠易激综合征等的药物上,同时益生菌还具有降低胆固醇水平、提高宿主免疫力,延缓疾病[8],降低血清胆固醇[9],增强身体对矿物质吸收的功能以及抑制肿瘤细胞繁殖功效,其抗癌的可能机制包括竞争性地排除致病菌、与致癌物直接物理结合、改变肠道环境以调节生产酶、抗氧化活性和免疫调节等[10]。益生菌通过优化肠道菌群或刺激免疫细胞进而调节机体的免疫功能,其免疫调节是通过细胞和体液免疫调节、组织介导的致病定植抗性、改善粘膜屏障完整性以及与微生物的相互作用,以共生或共生关系增强正常肠道益生菌微生物[11]。
1.1 益生菌的分类及其在肠道菌群的分布
益生菌主要分为乳杆菌类、双歧杆菌类、乳球菌类和链球菌类等,主要分布在胃肠道,与防治疾病的关系如表1 所示。绝大多数肠道菌群为绝对厌氧菌,其数量是需氧菌和兼性厌氧菌的100~1000 倍,主要分布在胃、小肠和大肠中,不同部位的菌群分布也有所差异[8]。随年龄的增长,肠道菌群的组成也在不断的发生变化,越来越多的研究表明,肠道微生物群落是高度复杂的,与糖尿病、肥胖、高血压和心血管疾病的发生息息相关[12],可以影响人类的健康,因此肠道菌群具有相当大的可塑性。
1.2 益生菌在肠道的定植
益生菌通过定植来调节肠道微生物,并影响宿主肠道微生物的代谢,最终改善宿主健康。国外一些研究已证明益生菌可通过竞争营养或产生杀菌因子形成定植抗性来减少肠道病原微生物的感染[21],从而对胃肠道疾病起到减少或预防的效果。它们协助宿主进行免疫调节,处理影响不良反应的药物代谢产物,重要的是合成宿主必需的维生素,如生物素、叶酸和维生素K[22]。
由于益生菌的活性与宿主胃肠道的条件和肠道菌群的变化密切相关,益生菌的定植与持久性显得尤为重要。益生菌菌株分泌具有抗菌活性的短链脂肪酸等次级代谢物和多肽,其可能与宿主或病原体直接相互作用[23],这些相互作用将大大改善益生菌的功效。益生菌对黏液和肠道上皮细胞的粘附不仅使菌株具有竞争优势,而且可与宿主形成更强的相互作用,从而刺激宿主的免疫反应[24]。此外,益生菌菌株的定植阻止了肠道病原体与肠道细胞的粘附。
益生菌除了对致病性定植有抗性外,还通过细胞表面蛋白质、胞外多糖、肽聚糖、脂质体酸、菌毛与宿主组织相互作用,结合粘蛋白,调节粘蛋白、免疫和肠道细胞以提高转运时间改善肠道屏障的完整性[25]。
综上,益生菌的定植增强了肠道屏障的完整性,间接提高了机体的免疫力。可见益生菌可作为外源菌摄入,其定植于人体肠道,其可改善肠道菌群组成,同时与致病菌竞争营养物质,排除致病菌,最终提高机体的免疫力。
2 益生菌调控肠道菌群及肠道功能
2.1 益生菌与益生元共同调节肠道菌群
肠道菌群在人类健康中发挥着重要作用,肠道菌群失衡会导致肠易激综合征,直肠癌等很多疾病。益生菌的摄入是为了增强正常的肠道益生菌菌群的共生关系,益生菌可介导调节肠道细菌和真菌的生长[26],其粘附在胃肠道表面定植、繁殖,有助于维持宿主肠道微生物平衡[27]。益生元是不易消化的低聚糖,最常见的是菊糖、低聚果糖、乳果糖和抗性淀粉[28],可通过从天然来源提取或化学合成产生[29]。益生元能够提高肠道的自我保护能力,可作为益生菌的养料,选择性的促进益生菌的繁殖和生长,调节肠道微生物群的组成,被宿主微生物选择性降解以释放有益的代谢物,其直接或间接影响细菌的定植和生长过程,调节细胞增殖等[30]。
益生元到达肠道,会积极促进肠道内益生菌发酵产生短链脂肪酸,为肠道营造酸性环境,从而抑制有害菌的生长[31],其与益生菌均对肠道菌群平衡有促进作用,两者之间的协同效应使益生菌在肠道内获得优势,从而快速定植生长繁殖并成为优势菌。益生菌的益生作用主要是通过直接或间接地调整宿主肠道微生物组成,激活宿主内源性微生物群或免疫系统的活性来实现的[32]。益生菌对宿主发挥有益作用机制包括分泌抗菌物质、竞争性排斥粘附部位和营养来源、增强肠道屏障功能和免疫调节[33]。
2.2 益生菌调控肠道功能
由益生菌产生的细菌素、有机酸、过氧化氢和铁载体等代谢产物,有利于抑制肠道菌群中的不利菌群,预防细菌致病性定植,对竞争的肠道病原体发挥直接的抗菌作用[34]。
2.2.1 细菌素的分泌 细菌素是核糖体产生的抗菌肽。细菌素由于体积小,且在疏水性和亲水性方面存在差异,故可以粘附在微生物细胞上,并可穿透磷脂。细菌素主要是阳离子多肽,这一特性使其能够与细菌磷脂的负电荷基团进行静电相互作用,并被插入到平面脂双分子层或脂质体膜中,形成短暂的通道,敏感细菌细胞质膜的通透性被提高,最终导致细胞内容物泄漏和细胞死亡[35],此外,其还可抑制细菌DNA和RNA 合成或细胞壁蛋白质的合成。
益生菌产生的细菌素是胃肠道(GIT)中用于抑制病原体的关键作用物质[36]。细菌素通常只抑制特定的病原体,一些细菌素具有更广泛的抗菌活性。细菌素可能对病原体有抑菌或直接杀菌作用,从而限制了细胞在肠道定植的能力。细菌素的相关抗菌活性允许产生细菌素的益生菌菌株在复杂的胃肠道环境中获得竞争优势[37]。
2.2.2 有机酸的生成 益生菌和共生菌在GIT(胃肠道)中发酵碳水化合物,其产生的乙酸、甲酸、琥珀酸和乳酸等有机酸可提高肠道酸度,降低肠道环境pH,使其更适宜乳酸菌等益生菌生存,从而抑制细菌病原体的生长。特别是乳酸和乙酸,其可以抑制GIT 中许多致病菌的生长[38]。此外,有机酸能够修复和促进肠道功能,促进消化液的分泌,使机体的消化功能得到增强,进一步加强了机体对营养物质的消化吸收功能[39],其可有效抑制肠道有害菌的生长,阻止病原菌的定植,促进肠道蠕动及机体对矿物质的吸收,减少便秘[40]。但有机酸的含量不是越高越好,含量过高会导致肠道弱酸性环境被破坏,限制益生菌的生长繁殖,甚至影响机体排便功能。
2.2.3 过氧化氢的产生 共生或益生菌产生过氧化氢可能是对抗病原体的重要抗菌机制[41],过氧化氢酶作用导致产生许多氧自由基,氧自由基通过干扰过氧化氢酶的活性而产生抗菌作用。过氧化氢抑制外来菌的定植,使入侵的微生物无法获得足够营养,以此抑制外来菌的增殖;降低病原菌的病原性,减少病原菌对肠道上皮细胞的侵袭,或通过上皮细胞内扩散改变基因转录和信号转导致使肠道病原菌死亡[42]。
2.2.4 铁载体的释放 铁水平是导致肠道菌群改变的重要因素,在大多数肠道微生物的代谢和增殖中起着核心作用,铁载体是由微生物产生的低分子量、有机、高亲和力的一种Fe3+特异性的螯合剂,对Fe3+具有超强的络合力。细菌可通过分泌铁载体摄取Fe3+,铁载体能够与宿主体内的转铁蛋白、乳铁蛋白等铁结合蛋白竞争Fe3+形成可溶性的Fe3+-铁载体复合体进入细胞,Fe3+被铁还原酶还原满足细菌对铁的摄取;铁载体通过剥夺竞争病原微生物的铁来抑制它们的生长与增殖[43]。在此过程中,产生铁载体的细菌将其环境中可用的对其他微生物至关重要的游离铁隔离。
2.3 益生菌维持肠上皮屏障的稳定
肠道屏障功能可以维持肠道上皮细胞的完整性,从而发挥肠道上皮细胞对生命体的保护作用。胃肠道上皮由一层黏液层覆盖的细胞组成,黏液层不断暴露于管腔内容物和各种肠道细菌[44]。肠上皮屏障由黏液层、肠细胞和肠固有免疫系统组成,胃肠道屏障是维持上皮完整性、防止病原体感染和过度炎症的关键防御机制[45]。因此,这一屏障的稳定和维持对宿主是至关重要的。肠上皮的肠道屏障对抗有害抗原入侵的重要防御机制包括黏膜层、细胞间连接复合物以及抗菌肽和免疫球蛋白A 的分泌,一旦这些屏障功能受到干扰,细菌和食源性抗原就容易抵达黏膜下层,引发炎症反应,从而导致肠道功能紊乱[46]。食用定植或非定植益生菌可增强屏障的完整性,通过增加上皮杯状细胞的粘蛋白的分泌量来增强肠道屏障功能,有助于保护肠上皮免受肠道病原体和慢性炎症的侵袭[47]。
肠上皮细胞覆盖着一层内外保护性的黏液层,其限制细菌的运动,并作为一种动态的防御屏障,抵御肠道病原体和其他潜在的有害抗原在肠内定植。肠道病原体必须先穿透黏液层,然后才能到达肠上皮,而粘蛋白是上皮黏液层的主要大分子物质,由肠道中的特殊杯状细胞产生益生菌能够通过促进肠粘蛋白和防御素的分泌来抑制病原体对肠道的粘附[48]。益生菌介导的黏液分泌增加可能是其与肠道致病菌相互作用预防感染、改善肠道屏障功能的关键机制。
由此可见,增强肠道上皮的防御屏障是至关重要的,益生菌定植可增强肠道上皮屏障的完整性,进一步促进黏液层的粘液分泌增加,粘附病原菌和病原体从而降低疾病的感染。
3 益生菌与免疫
3.1 益生菌参与免疫调节
益生菌对宿主固有和适应性免疫反应具有调节作用,这些细菌能够调节树突状细胞(DCs)、单核细胞、巨噬细胞以及T 和B 淋巴细胞的功能,从而增强其对入侵肠道病原体的吞噬能力[49]。益生菌通过刺激宿主特异性和非特异性免疫反应,抑制GIT 中的病原体,进而预防肠道疾病。
益生菌能够通过向树突状细胞发出信号,分泌抗炎细胞因子,如白介素10(IL-10),通过抑制抗体的产生而抑制炎症因子的释放,从而触发先天性免疫系统的抗炎反应,在炎症期间引起促炎细胞因子的减少。益生菌干扰核因子激活的B 细胞的κ-轻链增强(NF-κB)和丝裂原活化蛋白激酶(MAPK)的信号通路,使免疫细胞的促炎细胞因子分泌下调。肠道病原体激活信号通路导致促炎细胞因子的分泌,近而严重破坏肠上皮屏障,益生菌通过抑制促炎细胞因子激活和趋化中性粒细胞调节炎症反应,促进中性粒细胞的吞噬作用[50]。在炎症过程中,益生菌作为媒介引起促炎细胞因子的减少缓解炎症。
益生菌通过刺激肠道并产生抗体,特别是免疫球蛋白A(IgA)发挥作用。在肠腔释放的抗体可以通过干扰病原体细胞膜上的粘附细胞受体来抑制病原体对肠道的粘附[51]。
一些益生菌菌株还可以通过影响宿主免疫吞噬细胞对肠道病原体的吞噬作用来调节宿主免疫机制。此外,益生菌不仅在临床情况下影响吞噬细胞的活性,而且还会影响吞噬细胞的能力。
3.2 益生菌的免疫调节机制
益生菌的免疫调节机制主要包括黏膜屏障作用、增强巨噬细胞的吞噬作用、促进IgA生成等。益生菌可通过产生增强肠道黏膜屏障功能,抑制致病菌生长和粘附,调控免疫细胞活性及促进免疫因子产生等方式,调节机体免疫功能[52]。
3.2.1 黏膜屏障作用 益生菌与肠黏膜紧密结合构成肠道的生物屏障,能通过占位效应、营养竞争及其分泌的细菌素等各种代谢产物抑制条件致病菌的过度生长及外来病原菌的入侵,维持肠道的微生态平衡[53]。细菌在肠道内按照一定的顺序定植(需氧菌-兼性厌氧菌-厌氧菌)逐渐成为常驻菌群,在黏膜的特定部位有特定的细菌黏附,黏附是定植的第一步,益生菌在肠道黏膜上皮细胞表面黏附定植后进入菌群增殖的过程,最终形成稳定的菌群。有益菌可发挥占位定植作用,竞争定植位点以阻止病原菌与肠道黏膜受体结合,益生菌的黏附还可以防止条件致病菌的易位,阻止条件致病菌向周围不断扩散而引发有关部位感染[54]。
益生菌进入消化道后被肠粘膜内特有的M 细胞摄取,进而递呈给巨噬细胞,益生菌表面的多种微生物相关分子模型与巨噬细胞的表面模式识别受体(PRR)相互作用,刺激它们产生下游效应器细胞因子,调节免疫相关反应[55]。
肠道黏膜与管腔内容物和各种肠道菌群连续接触。相对于近端肠段,小肠、盲肠和结肠区域的细菌定植量增加,因此,上皮和粘膜形成了调节细菌生长的机制以免受炎症反应的控制,抑制直接接触,并防止细菌脱位进入底层组织[40]。
3.2.2 增强巨噬细胞的吞噬功能 益生菌有激活巨噬细胞分泌活性蛋白的能力,增强免疫功能。一些益生菌能够刺激巨噬细胞产生生理性炎症反应和增强吞噬细胞的吞噬能力,易于与癌细胞结合,从而提高自身的免疫力。益生菌可激活不同部位巨噬细胞的吞噬活性,并增强其吞噬活性[56]。一些益生菌菌株也可以通过影响吞噬细胞对肠道病原体的吞噬作用来调节宿主免疫机制,益生菌及其抗原代谢物被微金细胞吞噬,在肠道相关淋巴组织中形成内体,这些抗原被DCs 释放和吸收,DCs 能摄取、加工及呈递抗原,可将抗原运输到局部淋巴结,从而激活原始T 细胞和B 细胞,使其分化为不同的效应亚群,进而分泌相关细胞因子启动免疫应答[57]。
3.2.3 强化分泌功能 益生菌提供微生物的作用,恢复肠上皮细胞功能,通过多种机制(如图1)影响上皮屏障的完整性。包括对肠上皮细胞的直接影响,益生菌可增加粘蛋白和糖蛋白的分泌,促使杯状细胞聚集形成黏液层;益生菌通过肠上皮细胞增加防御素等抗菌蛋白的分泌,帮助消除穿透黏液层的共生体或病原体;益生菌可增强细胞间连接复合体的稳定性从而降低肠上皮对病原体和其他抗原的细胞间渗透性。大多数益生菌可以通过产生细菌素、有机酸等抗菌物质来抑制肠道病原体;其与共生菌和肠道病原体竞争黏液层或肠上皮中的粘附位点,从而防止有害菌的定植,增强屏障功能;改变天然肠道菌群组成或基因表达,通过共生菌群增强肠道屏障的完整性[58]。
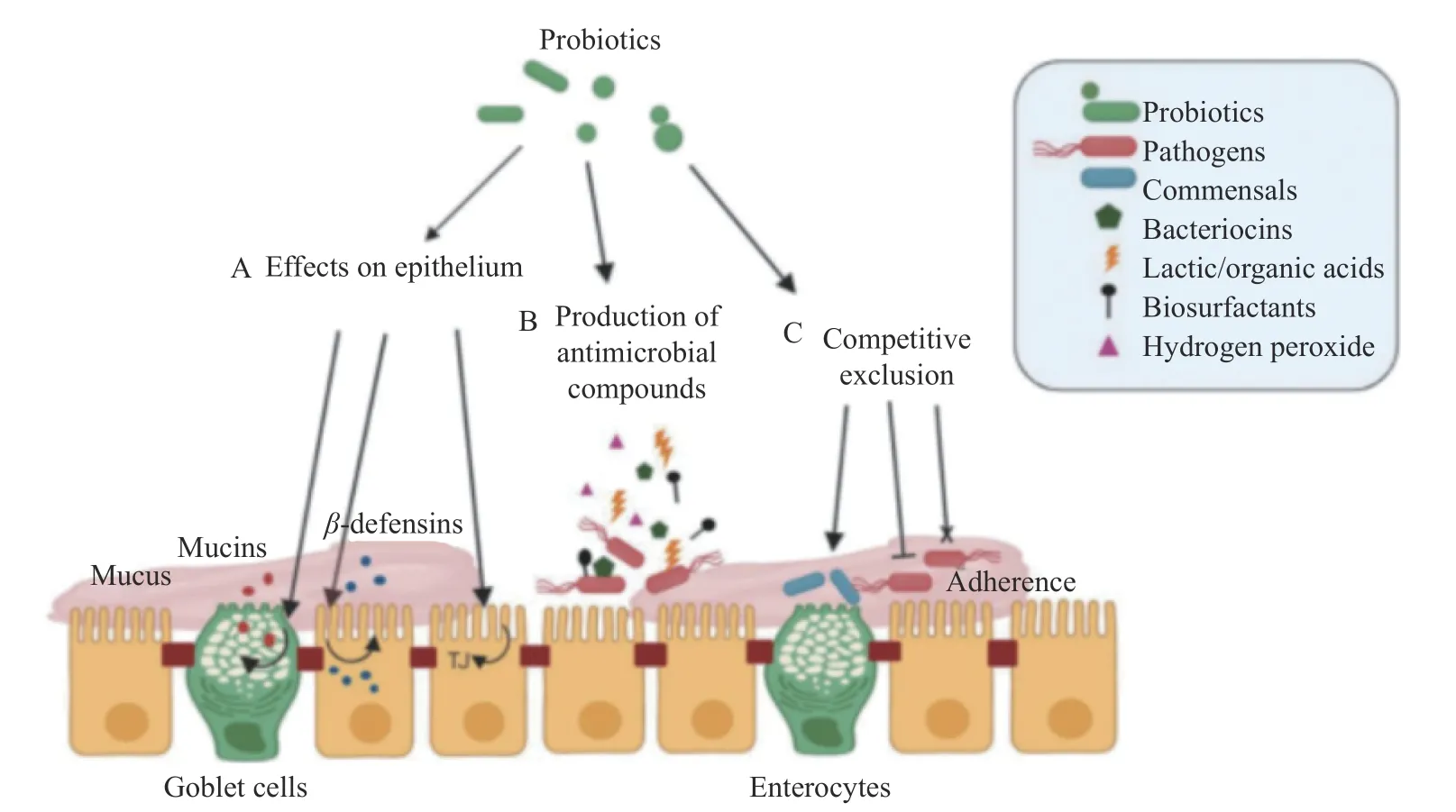
图1 益生菌的调节机制[58]Fig.1 Regulatory mechanism of probiotics[58]
通过占位效应抑制病原体的粘附和生长,增强竞争性拮抗作用,分泌抗菌物质,提高消化酶活性,合成有机酸等[59]。益生菌通过增强上皮细胞间紧密连接蛋白的合成,增加粘性糖蛋白的表达和释放,从而改善上皮完整性和机械屏障功能,防止肠道微生物和内毒素移位。益生菌还通过紧密连接和蛋白激酶C(PKC)的闭塞带蛋白(ZO-2)的表达和重新分布,启动紧密连接复合物重建介导的受损屏障功能的修复[60]。
益生菌还诱导上皮细胞释放防御素,这种小肽具有抗细菌、抗真菌和抗病毒的活性,而且稳定了肠道的屏障功能。益生菌通过肠细胞病原体受体的空间位阻抑制病原体的结合。益生菌的特定代谢产物调节不同细胞中的信号传导和代谢途径。益生菌代谢组分过氧化氢、胺、有机酸和细菌素等成分与宿主代谢途径中的多个靶点相互作用,这些靶点可调控炎症以及细胞增殖、分化和凋亡[61]。
3.2.4 调节细胞信号 一些益生菌能够通过调节细胞信号转导来改变细胞因子的产生。它们可以通过抑制抑制剂的泛素化、干扰蛋白酶功能或通过受体γ依赖性信号级联影响定位来阻止抑制剂的降解,而受体γ依赖性信号级联又通过过氧化物酶增殖激活[62]。鼠李糖乳杆菌中的两种可溶性蛋白质促进肠上皮细胞存活和生长。这些蛋白质通过激活抗凋亡因子和蛋白激酶B 抑制肿瘤坏死因子介导的凋亡。此外,它们还使上皮细胞中促凋亡的丝裂原激活蛋白激酶信号通路失活。
3.3 益生菌调节免疫的途径
目前,研究最广泛的益生菌包括乳酸杆菌、双歧杆菌、肠球菌等,尽管益生菌的作用机制主要集中在GIT 上,但益生菌的作用并不局限于初始感染部位,益生菌可以通过免疫调节作用于全身(如图2)。
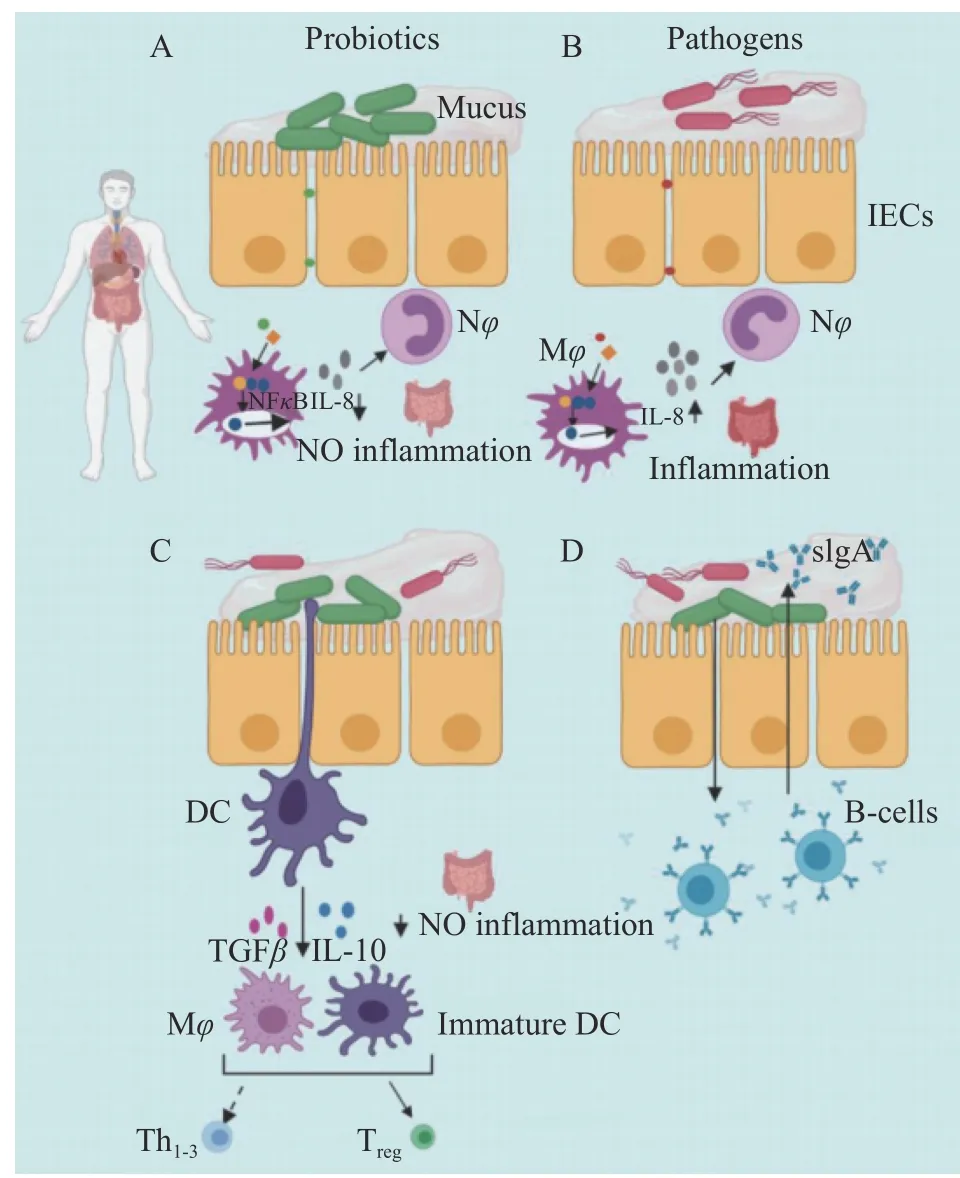
图2 益生菌的免疫调节作用[63]Fig.2 Immunomodulatory effects of probiotics[63]
益生菌的免疫机制涉及DCs、上皮细胞、T 调节细胞、效应淋巴细胞、自然杀伤T 细胞和B 细胞的改变[63]。肠道病原体存在时益生菌对粘膜免疫的调节作用。益生菌下调GIT 中促炎细胞因子(如IL-8)的分泌,益生菌或其产物可能通过抑制NF-κB 炎症信号通路和影响IL-8 的分泌以及炎症免疫细胞聚集在肠道损伤部位来抑制先天免疫反应(如途径A)。NF-κB 信号通路被肠道病原体激活,导致肠道上皮组织严重炎症(如途径B)。树突状细胞的益生菌信号,刺激抗炎细胞因子如IL-10 的分泌,以应对肠道感染(如途径C)。益生菌可增加固有层分泌IgA 浆细胞的水平,促进分泌型免疫球蛋白A(sIgA)穿过上皮细胞层胞饮并分泌到腔黏液层,限制和防止细菌对宿主组织的渗透(如途径D)。
益生菌调节先天性和适应性免疫反应,促进免疫系统的发育和成熟。益生菌通过启动由Toll 样受体、NF-κB、MAPK 和应激活化蛋白激酶(c-JNK)途径组成的先天性免疫反应来调节宿主与病原体的相互作用。乳酸杆菌和双歧杆菌等益生菌可以通过清除病原体和调节肠上皮细胞的免疫反应来恢复宿主健康[64]。益生菌的抗炎作用主要通过Toll 样受体、辅助性T 细胞17、调节性T 细胞或核因子κB 信号通路,减弱几种细胞因子和趋化因子的合成,诱导抗炎分子合成[64]。
4 结语与展望
尽管益生菌对胃肠道微生物菌群与人体免疫调节的研究越来越多,但鉴于人体的胃肠道生态系统与免疫系统的复杂性,阐明益生菌与胃肠道菌群和免疫系统的作用机制依旧是一项艰巨任务。为更好发挥益生菌在调理肠道菌群,预防或治疗疾病方面的潜力,需要进一步深入研究益生菌-宿主机体微环境之间的互作机制。包括:益生菌-胃肠道微生物相互作用,尤其是益生菌株作用的分子机制;宿主的饮食和环境等因素对益生菌及微生物代谢产物影响;益生菌与菌群微生物代谢产物对宿主免疫影响的临床转化。总体来说,益生菌在调节肠道菌群,增强肠道屏障功能、缓解肠道炎症、抑制肿瘤和刺激免疫等方面有重要作用,益生菌提供的临床效益可能是多种机制共同作用的结果,故益生菌应用于临床是大势所趋,但目前国内对益生菌分子水平机理研究较少,探讨临床治疗使用的菌株类别、剂量,保留有效成分、控制负面影响,在分子水平上研究益生菌效应机制是可行的,为人类健康提供新的策略。
