干酪乳杆菌HDS-01 发酵对酸菜品质和细菌群落结构的影响
2022-08-16曹春振杨志馨
王 旭,曹春振,杨志馨,潘 月,宋 刚,
(1.农业微生物技术教育部工程研究中心,黑龙江哈尔滨 150500;2.黑龙江大学生命科学学院,微生物省高校重点实验室,黑龙江哈尔滨 150080)
酸菜是我国东北地区传统发酵的蔬菜制品,采用大白菜在低盐浓度条件下,经过乳酸发酵制成[1]。酸菜以酸香味醇、清脆爽口、清淡解腻的品质赢得国内外广大消费者的喜爱[2]。大白菜无需灭菌处理,发酵过程中的微生物种类极其复杂,所以无论是家居式还是工厂式腌制,在口感和风味上都呈现出“一家一款、家家不同”的局面。传统酸菜发酵过程中,乳杆菌属(Lactobacillus)虽然占据优势地位,但变形杆菌属(Proteus)、大肠杆菌(Escherichia coli)和沙门氏菌属(Salmonella)等致病菌仍大量存在,食品安全存在风险[3]。
乳酸菌具有益生功能,用作发酵剂增强了碳水化合物降解和乳酸的生成[4]。王芮东等[5]通过高效液相色谱法,分析自然、老泡菜水和乳酸菌制剂三种方式发酵过程中有机酸含量的变化,结果表明,乳酸菌制剂发酵泡菜的有机酸总量始终高于其他两种发酵方式。Yang 等[6]研究发现,接种乳酸菌可以更快速地降低发酵系统的pH,缩短发酵时间。然而,发酵食品的风味以及化学成分含量源自于微生物群落之间的代谢活动[7]。Xiao 等[8]研究了四川泡菜中微生物区系与风味的相关性,结果表明,细菌对风味形成的贡献高于真菌,而乳酸菌、明串珠菌、无色杆菌和片球菌与风味密切相关。因此,有必要全面解析发酵过程中微生物群落结构和化学成分的动态变化,以便精确调控发酵工艺,从而形成风味独特且富含营养价值的高质量酸菜产品[9-10]。
目前,广泛应用在酸菜发酵生产的菌株主要包括肠膜明串珠菌(Leuconostoc mesenteroides)和植物乳杆菌(Lactobacillus plantarum)等[11-12]。不同乳酸菌具有不同的功能特性,广泛应用在不同的工业领域,开发新型发酵剂应用在酸菜发酵中将会促进酸菜产业的进一步发展。干酪乳杆菌(Lactobacillus casei)具有高效降血压、降胆固醇,增强人体免疫及预防癌症等益生保健作用[13],在功能性食品开发的领域受到了越来越多的关注,但有关L.casei作为蔬菜发酵剂的研究报道较少。本研究以分离自酸菜发酵液的一种高产乳酸的L.caseiHDS-01[14]作为发酵剂,构建酸菜发酵微生物生态体系,以自然发酵酸菜为对照,分析发酵过程中关键代谢产物的变化,分析乳酸代谢途径关键酶活力、群体感应基因LuxS表达以及细菌多样性的差异。研究结果对酸菜工业化的稳定性控制、发酵用菌种资源和功能菌的开发以及传统酸菜工业菌种的选育具有重要的实践意义。
1 材料与方法
1.1 材料与仪器
L.caseiHDS-01 分离自传统酸菜发酵液,用于酸菜发酵,保藏于黑龙江大学微生物省高校重点实验室;白菜、食盐 哈尔滨家得乐超市;50 L 发酵桶哈尔滨道外生活器具批发市场;磷酸果糖激酶(PFK)活性检测试剂盒、丙酮酸激酶(PK)活性检测试剂盒、乳酸脱氢酶(LDH)活性检测试剂盒、食品中亚硝酸盐测定试剂盒 苏州科铭生物技术有限公司。
FE20 pH 计 梅特勒-托利多(上海)有限公司;A560 紫外可见分光光度计 上海翱艺仪器有限公司;LC20A 高效液相色谱 日本岛津公司;ABI7500荧光定量PCR 仪 美国Life Technologies 公司。
1.2 实验方法
1.2.1 微生态体系构建 自然发酵:选取优质实心白菜,放置在阴凉处晾晒1~2 d 后去除坏叶,清洗干净后整齐紧密放置于50 L 发酵罐中压实,加入3%(w/v)的食盐水浸泡,以1 kg 白菜加1 L 食盐水的比例腌制,控制温度在20~25 ℃之间,密封发酵,从第1 d起隔天取样;人工发酵:挑取L.caseiHDS-01 单菌落,接入液体MRS 培养基[15]中,于37 ℃静态培养18~24 h,离心收集菌体,用无菌生理盐水洗涤菌体并调整细胞浓度为108个/mL,即为种子液,按白菜质量的10%(w/v)接种量接入与自然发酵相同的发酵体系,控制罐体温度在20~25 ℃之间,从第1 d 起隔天取样。
1.2.2 pH 及乳酸菌数测定 pH:取发酵罐中多处位置的发酵液混合均匀,用pH 计连续测定三次,取平均值作为最终结果;乳酸菌总数:平板菌落计数法,参考GB 4789.35-2016 测定[16]。
1.2.3 乳酸和总酸含量测定 乳酸:参考张慧娟等[17]的方法测定;总酸:参考GB/T 12456-2008 测定[18]。
1.2.4 乳酸代谢途径关键酶活力测定 取发酵液2 mL,10000 r/min,在4 ℃下离心10 min,弃上清,收集菌体。加入2 mL 提取液,超声波破碎细菌(功率200 W,超声3 s,间隔10 s,重复30 次),8000 ×g,于4 ℃离心10 min,取上清,置冰上待测。磷酸果糖激酶(Phosphofructo-kinase,PFK)、丙酮酸激酶(Pyruvate kinase,PK)和乳酸脱氢酶(Lactate dehydrogenase,LDH)活力测定方法参照试剂盒说明书进行。
1.2.5 亚硝酸盐和VC含量测定 亚硝酸盐含量:称取0.20 g 酸菜样品研磨成匀浆,采用食品中亚硝酸盐测试盒测定酸菜中亚硝酸盐的含量,具体实验方法按照试剂盒说明书进行。
VC含量:采用紫外分光光光度法测定[19],准确吸取VC标准溶液0.2、0.5、1.0、3.0、5.0 mL 定容至50 mL 的容量瓶中,以蒸馏水作空白试剂,在243.8 nm下测定吸光度值,以VC含量(μg)为横坐标,以吸光度值为纵坐标作标准曲线,得回归方程y=0.0708x-0.0024,R2=0.9998。准确称取5.00 g 酸菜于研钵中,加入10 mL 体积分数为0.01 的盐酸,快速捣成匀浆,10000 r/min,离心10 min,取2 mL 上清液于50 mL容量瓶中,加入1 mL 体积分数为0.1 盐酸,用蒸馏水定容。取定容后的样液2 mL,依次加入1 mL 体积分数为0.1 的盐酸,0.3 mL Cu(NO3)2溶液,置于70 ℃恒温水浴13 min 后,冷却至室温,以蒸馏水作空白,243.8 nm 下测定吸光度值。根据标准曲线,即可计算出样品中VC的含量。
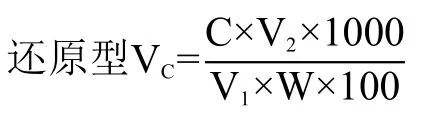
式中:C 表示标准曲线上查得还原型VC的含量(μg/g);V2表示样液定容后的体积(mL);V1表示测定用样液的体积(mL);W 表示样品重(g)。
1.2.6 酸菜感官评价 依据陈功[20]的方法并做相应调整,对发酵第21 d 酸菜样品进行感官评价。邀请10 名感官评价员,从发酵液状态、酸菜成品的颜色、气味、味道和脆度这5 方面评价酸菜质量,见表1。

表1 酸菜感官评价标准Table 1 Criteria for sensory evaluation of sauerkraut
1.2.7 16S rDNA 提取与检测 按照QIAamp DNA Mini kit(Qiagen)说明书提取酸菜发酵液细菌DNA,选择细菌16S rDNA V3~V4 区特异性引物338F(5'-barcode+ACTCCTACGGGAG GCAGCA-3'),806R(5'-GGACTACHVGGGTWTCTAAT-3')。通过Tru-Seq Nano DNA LT Library Prep Kit(Illumina)进行建库,利用MiSeq Reagent Kit V3(600cycles)进行2×300 bp 的双端测序,测序获得的下机数据通过fastqjoin 软件拼接,对拼接后的tag 进行质控和过滤,得到有效数据[21]。
1.2.8 群体感应基因转录水平检测 提取两种酸菜发酵样品不同时间点发酵液细菌的总RNA 进行纯度和浓度测定。分别以luxS-down 为特异性下游引物合成cDNA 第一条链,每组取2 μL cDNA 作为模板,与各个基因的qRT-PCR 特异引物(表2)和荧光染料混合后,进行实时荧光定量PCR 扩增反应体系。获得各样品的CT 值以相对定量2-△△CT法进行分析,以内参基因16S rDNA 校正[22]。

表2 引物序列Table 2 Primer sequences
1.3 数据处理
所有试验都重复3 次,运用SPSS Statistic 26 软件对数据进行统计学分析,所有试验数据均以平均值±标准偏差(standard deviation,SD)表示,P<0.05代表均值间存在显著差异。
2 结果与分析
2.1 pH 与乳酸菌数的变化
pH 对发酵食品的质量起着至关重要的作用,是决定发酵程度的关键变量。如图1 所示,随着发酵的进行,两个发酵体系的pH 均先迅速下降后趋于平缓。人工发酵体系的pH 在发酵第3 d 就迅速下降至(3.15±0.08),而自然发酵体系的pH 则是在第7 d才下降至(3.56±0.07),且在整个发酵过程中,人工发酵酸菜的pH 始终低于自然发酵酸菜。到了发酵末期两个体系的pH 分别为(3.46±0.07)和(3.79±0.10)。Yang 等[23]研究表明,添加乳酸菌发酵的酸菜的pH在第3 d 即可降至4 以下,而自然发酵酸菜则需要5 d,这与本研究结果类似。赵丹等[15]研究发现,添加乳酸菌发酵酸菜的pH 下降速率快于自然发酵,且当发酵液的pH 达到3.5~3.8 时食用酸菜,风味口感最佳,这与本研究结果一致。
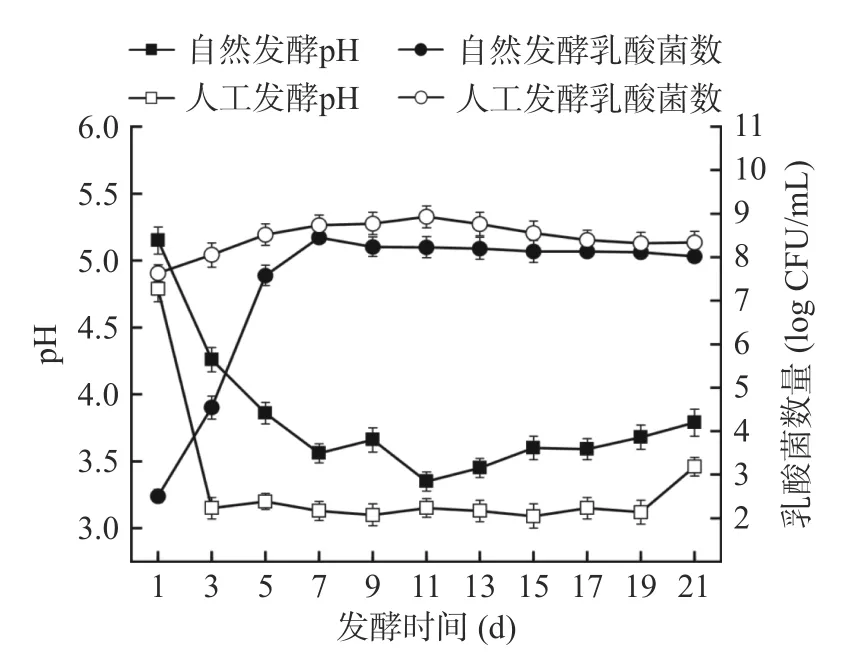
图1 酸菜发酵过程中pH 和乳酸菌数量的变化Fig.1 Changes in pH and lactic acid bacteria during fermentation of sauerkraut
乳酸菌数量的增加与pH 的降低直接相关,由于接种了发酵剂L.caseiHDS-01,人工发酵体系的初始乳酸菌数量(7.63±0.19)lg CFU/mL 高于自然发酵体系(2.50±0.15)lg CFU/mL。自然发酵体系中乳酸菌数量在发酵初始阶段(1~7 d)呈指数上升,第7 d达到最高为(8.45±0.01)lg CFU/mL,到了发酵中期略有下降。原因是乳酸菌的大量繁殖抑制了部分不耐酸乳酸菌的生长,另一方面,微生物生长繁殖所需的碳源氮源等营养物质不足,使发酵液中乳酸菌数量逐渐减少。但无论接种与否,在发酵17 d 后,两体系最终的乳酸菌数都达到了几乎相似的值,但人工发酵过程中的乳酸菌数始终高于自然发酵,说明人工发酵比自然发酵更早进入酸性环境。此外,在使用其他乳酸菌发酵酸菜样品中也得到类似结果[4,24]。酸性环境会抑制不耐酸致病菌繁殖,促进耐酸细菌生长,导致总酸含量增加,提高酸菜质量安全[25]。
2.2 乳酸含量和总酸含量变化
酸味是酸菜的主体风味,而总酸是表征酸菜酸味的理化指标。从如图2A 可以看出,两个发酵体系总酸含量均随发酵进行呈上升趋势,但整个发酵过程中人工发酵酸菜总酸含量始终高于自然发酵。到了发酵末期,两体系总酸含量均达到最高值,分别为(8.45±0.38)和(6.56±0.30)g/L。各发酵系统中的乳酸含量变化趋势与总酸一致,如图2B,人工发酵酸菜的乳酸含量始终高于自然发酵,在发酵末期含量达到最高,分别为(7.88±0.38)和(4.95±0.25)g/L。发酵中期,当酸性环境形成后,绝大部分细菌都不耐酸,因此生长受到抑制。耐酸性较强的乳酸菌成为优势菌群,开始生长繁殖,代谢产酸的同时,更稳固了其在发酵环境中的优势地位。马艺荧等[26]研究有机酸在东北酸菜发酵过程中的变化,结果表明,乳酸含量随发酵的进行不断增高,在发酵120 d 时达到(15.25±0.11)mg/g,与传统发酵相比,筛选的乳酸菌直投发酵20 d 就达到相当的乳酸含量,大大缩短了发酵时间。
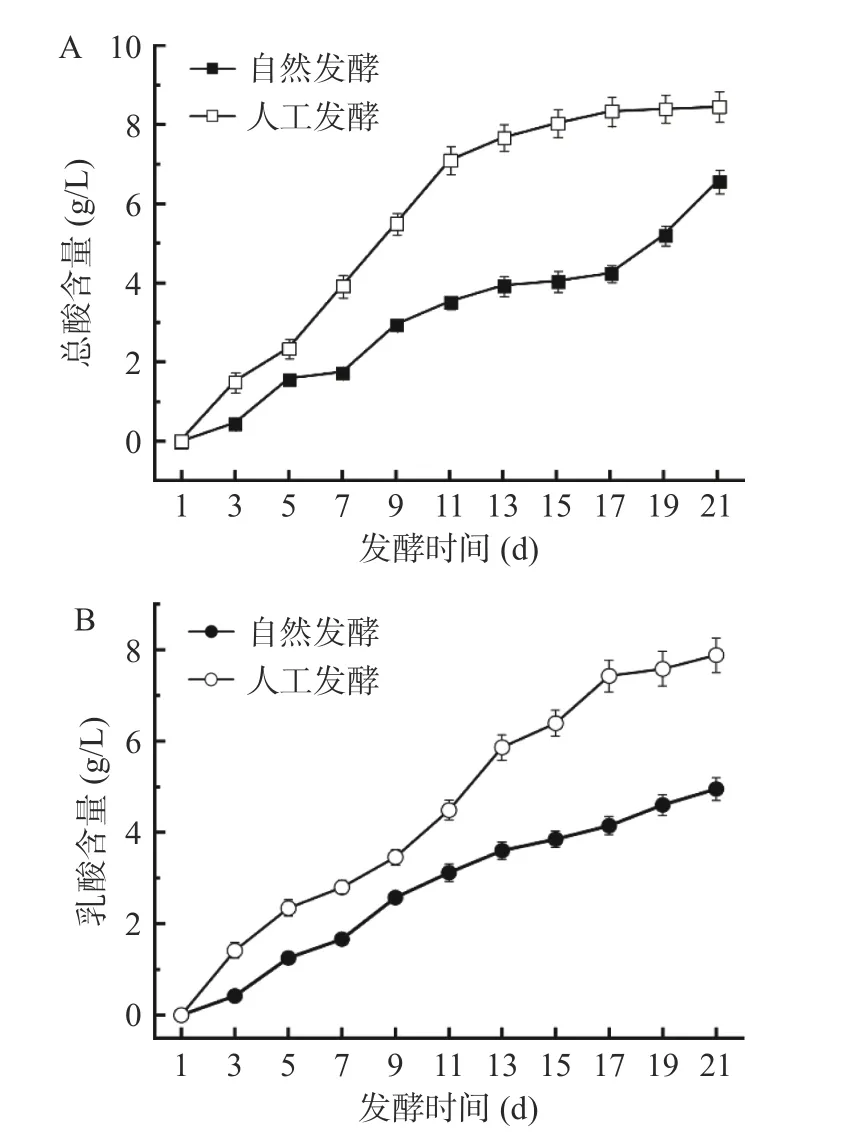
图2 酸菜发酵过程中总酸(A)和乳酸(B)含量的变化Fig.2 Changes in acidity (A) and lactic acid (B) content during fermentation of sauerkraut
2.3 乳酸代谢途径关键酶活力变化
酸菜腌制过程中的乳酸发酵主要借助于乳酸菌来实现,根据代谢产物的不同,可以将乳酸发酵分为同型乳酸发酵和异型乳酸发酵。异型乳酸发酵的产物有乳酸(约50%)、乙醇和CO2[27]。而同型乳酸发酵比异型乳酸发酵的乳酸菌耐酸性强,在糖酵途径经PFK 和PK 等酶的作用下,将底物葡萄糖降解为丙酮酸,丙酮酸在LDH 的催化下还原为乳酸(可达80%),没有乙醇和CO2生成,这一过程主要集中在酸菜发酵的中后期[28]。
本研究对同型乳酸发酵途径中的关键酶PFK、PK 和LDH 进行监测。如图3A 所示,两个发酵系统中PFK 活力变化趋势相同,均为先上升再下降最后趋于平缓,但变化速度却不同。在人工发酵体系中,PFK 活力在发酵初期迅速上升,在第5 d 达到峰值(678.89±54.76)U/mg,而自然发酵体系中PFK 活力缓慢升高,直至第7 d 才达到峰值(275.43±34.43)U/mg。原因是接种了L.caseiHDS-01,人工发酵系统中乳酸菌数量远高于自然发酵,乳酸菌繁殖代谢活跃,故而PFK 活力骤升。达到峰值后,活性均迅速降低,分别在第7 d(人工发酵)和第11 d(自然发酵)后保持稳定。原因是到了发酵中期,不耐酸的乳酸菌生长受到抑制导致PFK 活性下降;如图3B 和图3C 所示,两个发酵体系中PK 和LDH 活力与PFK 大概一致,均在1~3 d 显著(P<0.05)上升,第3 d 达到峰值后呈下降趋势,最终趋于平缓。结果表明,发酵初期(1~7 d)两体系中的三个关键酶活力均显著(P<0.05)高于发酵中期和末期,且活性峰值总是为人工发酵>自然发酵。因此,人工发酵酸菜的乳酸含量总是高于自然发酵酸菜,这一结果再次证明,人工发酵早期就有大量乳酸生成,进入实质性乳酸发酵阶段要早于自然发酵。
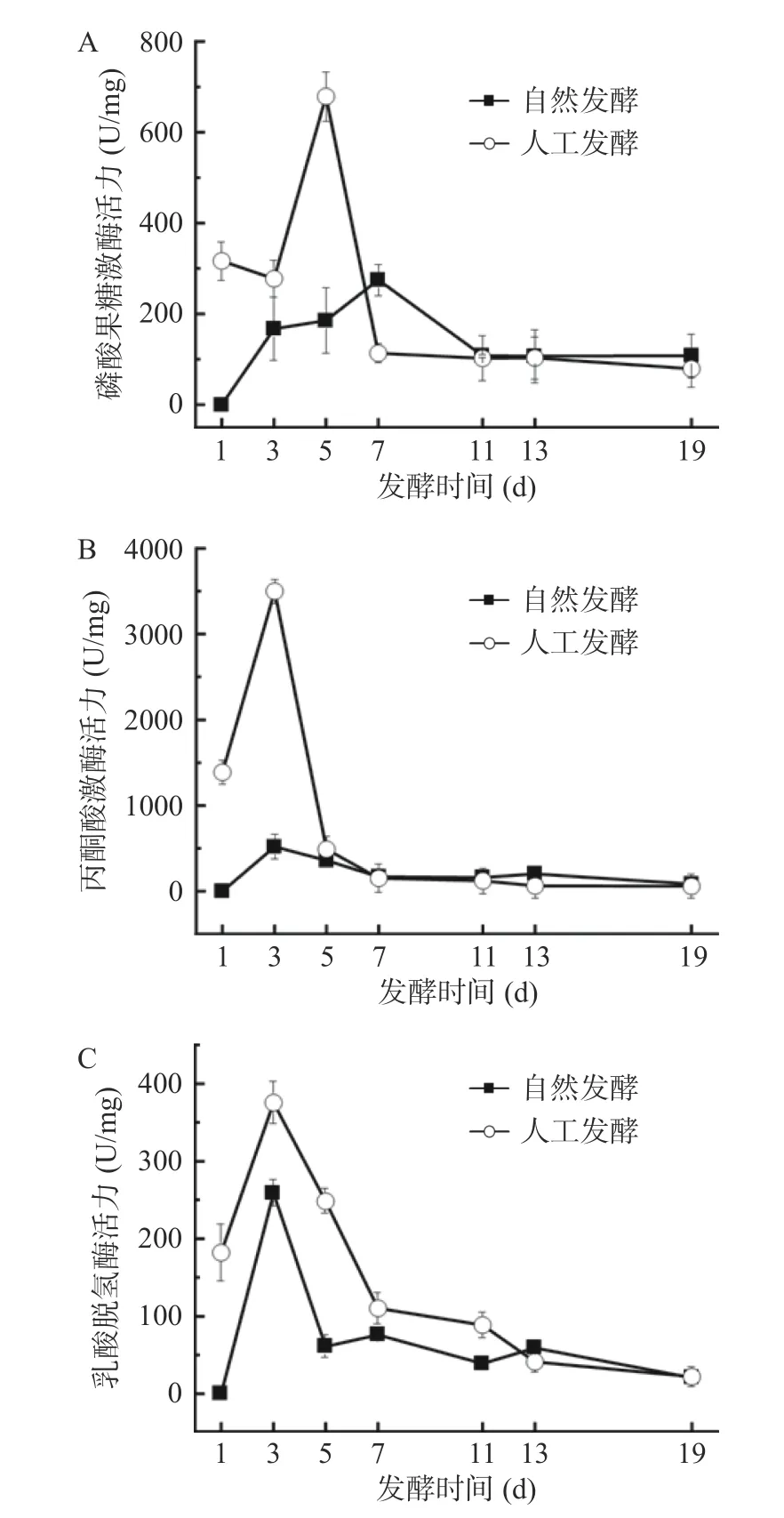
图3 酸菜发酵过程中果糖-6-磷酸激酶活力(A)、丙酮酸激酶活力(B)和乳酸脱氢酶活力(C)的变化Fig.3 Changes of PKF activity (A),PK activity (B) and LDH activity (C) during fermentation of sauerkraut
2.4 亚硝酸盐含量和VC 含量变化
亚硝酸盐被认为是食品安全评价的一个重要指标。如图4 所示,在发酵前期,自然发酵酸菜中亚硝酸盐含量迅速上升,在第7 d 达到峰值(31.88±1.60)mg/kg 后急剧下降,最终达到约(2.01±0.09)mg/kg 的稳定值。原因是酸菜发酵体系中存在大量含有硝酸盐还原酶的杂菌,它们把白菜组织中的硝酸盐还原为亚硝酸盐。随着乳酸菌的生长繁殖,产生的亚硝酸盐还原酶和形成的酸性环境(pH<4.0)均能抑制了硝酸盐还原菌的生长[21,29]。而人工发酵体系进入酸性环境要早于自然发酵体系,因此,整个发酵过程中亚硝酸盐的含量也始终低于自然发酵,发酵末期为(1.55±0.86)mg/kg。结果表明,L.caseiHDS-01 能抑制亚硝酸盐的产生,提高了酸菜在发酵期间的安全性。
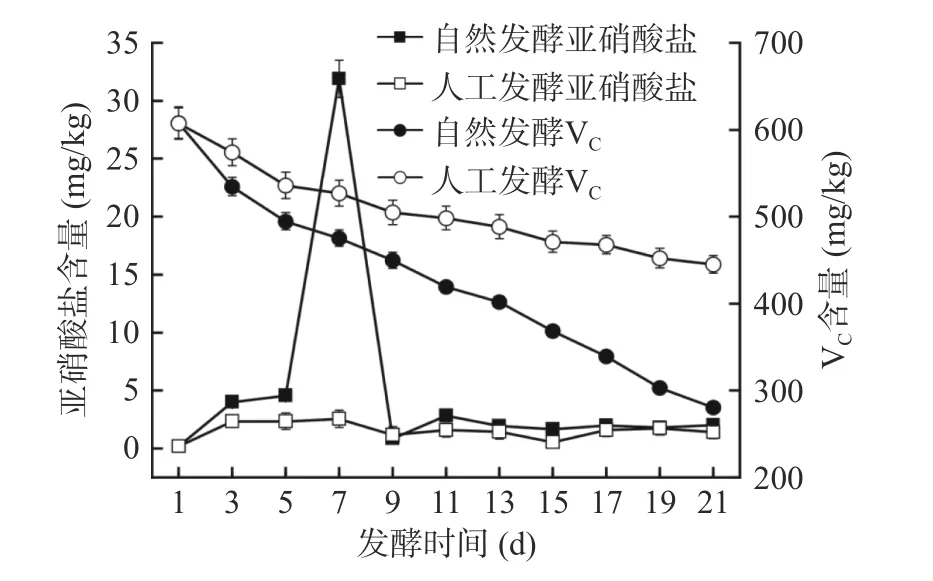
图4 酸菜发酵过程中亚硝酸盐含量和VC 含量的变化Fig.4 Changes in nitrite and VC content during fermentation of sauerkraut
VC含量随着发酵进行呈下降趋势,且人工发酵中VC含量一直高于自然发酵,这与Du 等[11]研究结果一致。因为VC是一种己糖醛基酸,能稳定地保存于酸性环境[6]。人工发酵酸菜中L.caseiHDS-01 大量生长繁殖,代谢产酸,快速形成了酸性环境,减少VC的降解,到了发酵末期含量为(445.02±10.53)mg/kg。自然发酵初期,微生物种类繁多且乳酸菌不是优势菌群,各类细菌大量生长繁殖,大量利用VC,使VC含量下降速率快,最终为(280.33±3.12)mg/kg。由此可见,L.caseiHDS-01 作为发酵剂能够减缓VC的降解,提高了酸菜的营养价值。
2.5 酸菜感官评价
由表3 可知,自然发酵酸菜汁液浑浊、脆度低、没有酸菜的香味,原因是发酵液酸度低,腐败细菌的生长繁殖破坏了白菜组织中的蛋白质及含氮物质,导致发酵液浑浊。同时,黄慧福等[30]研究发现,自然发酵酸菜在发酵初期含有少量霉菌,霉菌中用来分泌分解果胶的酶导致蔬菜组织变软、酸菜脆度降低。人工发酵酸菜汤汁清澈,具有酸菜的香气,原因是人工接种的L.casei在发酵初期就产生大量乳酸,能够抑制有害微生物的生长。此外,总酸含量的升高,果胶含量的增加,导致酸菜的脆性更好,因此赋予酸菜酸度适中、醇香爽脆的独特风味[31]。从发酵液清澈度、酸菜的色泽、香气、口味以及脆度等指标对比评价两种酸菜样品,人工发酵样品整体感官评分为(8.65±0.15)分,高于自然发酵酸菜(5.43±0.35)分。因此,接入L.caseiHDS-01 作为发酵剂可显著改善酸菜的感官品质,为酸菜带来良好的口感,这一结果与赵丹等[15]的研究结果一致。
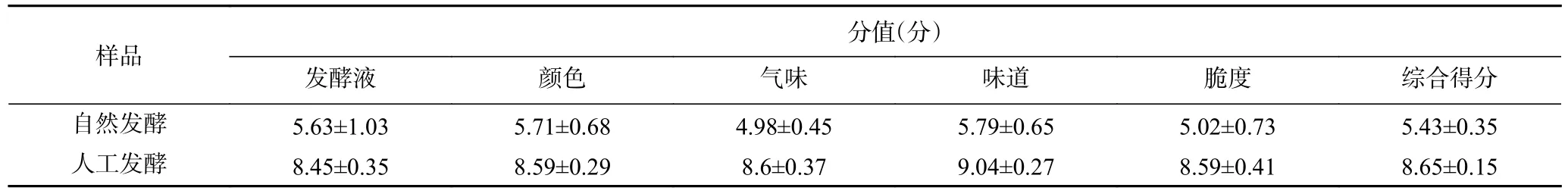
表3 酸菜样品感官评分Table 3 Sensory evaluation scores of sauerkraut samples
2.6 细菌群落组成
在两种酸菜发酵液样本中共检测到8 个菌门,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻细菌门(Cyanobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、髌骨细菌门(Patescibacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和疣微菌门(Verrucomicrobia)。如图5A所示,在自然发酵微生物系统中优势菌门为变形菌门(56.23%~99.05%),而人工发酵系统中优势菌门始终为厚壁菌门(63.37%~95.80%)。

图5 发酵过程中门水平(A)和属水平(B)细菌群落组成分析和属水平细菌群落PCA 分析(C)Fig.5 Analysis of flora structure at gate (A) and genus (B) level and principal component analysis of bacterial communities at the genus level (C) during fermentation of sauerkraut
两种发酵体系属水平细菌菌群结构如图5B 所示,共检测到99 种,主要为乳杆菌属(Lactobacillus)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、拉恩氏菌属(Rahnella)、鞘脂单胞菌属(Sphingomonas)和希瓦氏菌属(Shewanella)。而在自然发酵系统中,初始阶段乳杆菌属的相对丰度仅为0.31%,在发酵第7 d 才上升至43.72%,到发酵第13 d 后基本趋于稳定,直至发酵末期时降至20.03%。Enterobacter和Pseudomonas分别为(2.85%~26.93%)和(10.72%~30.75%)。据研究发现,一些Enterobacter和Pseudomonas可用作生可导致食物腐败,影响酸菜安全品质[32]。而在人工发酵系统中,发酵初始阶段,Lactobacillus的相对丰度为95.79%,随着发酵进行而轻微波动,到第19 d发酵末期时降至63.36%。整个发酵过程中,Enterobacter和Pseudomonas相对丰度分别为(0.04%~2.26%)和(0.28%~25.84%)和,含量远低于自然发酵酸菜。
进一步采用PCA 分析比较了两种发酵液样本在属水平上的相似性和差异程度。样本物种组成越相似,反映在PCA 图中的距离则越近。从图5C 可知,随着发酵进行,不同体系、不同时间点样本细菌群落特征存在显著差异(PC1 和PC2 的贡献率分别为66.84%和19.49%)。对比两个发酵体系,人工发酵系统中腐败菌的相对丰度不断减小且始终低于自然发酵。除了因为大量产生乳酸进入酸性,也可能是由于L.casei产生的抗菌物质抑制其他革兰氏阴性菌的生长[33]。由此可以看出,乳酸菌数量的增加不仅可以降低微生物生态系统的物种多样性,还能有效抑制腐败菌的生长。
2.7 发酵体系激活群体感应评测
群体感应(Quorum Sensing,QS)是细胞之间的通信过程,这是一种可以共同调节细菌之间细菌行为和调节基因表达的机制[34-35]。张琦等[36]认为乳酸菌存在LuxS介导的种间QS 系统,调控细菌素和有机酸的生成,维持自身的优势地位。本研究通过实时定量PCR 技术,监测群体感应基因LuxS表达水平的变化,以自然发酵每个时间点luxS的表达量为对照,检测人工发酵各阶段LuxS相对表达水平。如图6所示,随着发酵进行,人工发酵系统的luxS表达量与对照组相比始终显著上调。在发酵7 和11 d 时最为显著,分别上调了(5.71±0.33)和(6.72±0.41)倍,经t检验分析,差异极显著(P<0.01)。由此可以看出,人工发酵酸菜系统中存在群体感应调控机制,但群体感应现象如何通过LuxS表达量上升而促进整个酸菜发酵进程需要进一步研究。
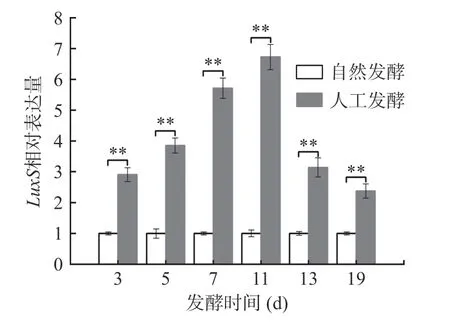
图6 L.casei HDS-01 酸菜发酵过程中luxS 相对表达水平Fig.6 Change in the relative expression level of luxS during L.casei HDS-01 fermentation of sauerkraut
3 结论
将高产乳酸的L.caseiHDS-01 接入酸菜发酵生态体系中,Lactobacillus迅速成为优势菌属,菌体密度增强,群体感应的信号因子达到阈值被激活,产生了大量乳酸,导致pH 迅速降低,优先进入酸性环境。酸性环境有利于VC的保留和亚硝酸盐的降解,维持了Lactobacillus的优势地位,抑制了肠杆菌属等致病菌的繁殖。综上所述,从感官品质上,接种L.caseiHDS-01 发酵的酸菜样品汤汁清亮,色泽黄嫩,口味浓郁,口感清脆。从发酵工艺上,L.caseiHDS-01 发酵酸菜产品中VC含量和乳酸含量均比自然发酵酸菜更高,亚硝酸盐含量和致病菌丰度更低,改善了酸菜的产品品质,提高了发酵产品质量和营养价值,提高了酸菜食用的安全性。
