槲皮素治疗大鼠肺纤维化的作用及相关机制研究
2022-08-16兰毛春迎王慧王守福张争辉郭新庆
薛 兰毛春迎王 慧王守福张争辉郭新庆∗
(1.菏泽医学专科学校基础医学部,山东 菏泽 274000;2.菏泽医学专科学校医学技术系,山东 菏泽 274000)
肺纤维化(pulmonary fibrosis,PF)是临床上棘手的疾病,无有效治疗方法,致死率高,患者一般最终因呼吸衰竭而死亡。 该病是多因素引起的严重的呼吸系统疾病,在西医上认为是细胞外基质在肺组织间质过度沉积,降解减少而引起的病理改变。在中医学上属于“肺痿”、“肺痹”范畴,认为可能与肺肾亏虚、气血凝滞、痰瘀痹阻肺络有关。 目前中药对于肺纤维化的治疗具有一定的作用,能够有效缓解病情,减轻肺纤维化的程度,减少患者痛苦[1]。槲皮素(quercetin, QUE)是一种广泛存在于自然界中的多羟基黄酮醇类化合物,不仅富含在柴胡、桑寄生、银杏叶等中药中,就连日常生活中的苹果、西兰花、卷心菜等也有。 药理研究证明槲皮素具有抗氧化、清除自由基、抗肿瘤、抗炎症、抗菌等作用[2],相关实验也说明了槲皮素抗肺纤维化的分子机制,有可能是通过调控Smad7 信号,缓解TGF-β 诱导的小鼠肺泡II 型上皮细胞NIH3T3 纤维化[3],但槲皮素抗肺纤维化的分子机制尚未得到透彻研究,为了进一步阐明槲皮素对肺纤维化的作用机制,本研究在前期研究的基础上,进一步探讨槲皮素抗肺纤维化的分子机制,现将研究结果报道如下。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
健康成年3~5 周龄雄性SPF 级SD 大鼠50 只,重量190~210 g,购自北京华阜康生物科技股份有限公司[SCXK(京)2020-0009],质量合格证号:11400700045968,饲养于本院屏障级动物室[SYXK(鲁)2020-0013]。 所有实验操作遵守实验室相关管理规定,经菏泽医学专科学校进行伦理审批HZYZ2019-0381),遵循3R 原则。
1.1.2 细胞
人肺腺癌细胞株A549 细胞由中南大学遗传实验室赠送。
1.2 主要试剂与仪器
Click-iT®Plus TUNEL assay 试剂盒(货号:C10618)购自Invitrogen 公司;苏木素-伊红(HE)染色试剂盒(货号:C0105)购自碧云天;Masson Stain Kit Masson 染色试剂盒(货号:60532ES58)购自上海翊圣生物科技有限公司;IL-1β(货号:ab13847)、TNF-α(货号:ab202068)、TGF-β1(货号:ab64715)、α-SMA(货号:ab5694)、GAPDH(货号:1056)一抗购自美国Abcam 公司;HRP 标记的山羊抗小鼠二抗购自美国 Santa Cruz 公司; NOX4 (货号: E-ELR0015c)、NF-κB(EEL-R0019)、P62(E-EL-R0016)和ELISA 试剂盒购自Elabscience;注射用盐酸博莱霉素(每瓶15 mg),日本化药株式会社生产(注册证号H20090885);槲皮素购自上海西格玛(Sigma)公司。 AniRes2005 动物肺功能分析系统购自北京贝兰博科技有限公司;PCR 仪、电泳仪及半干转膜仪均购自美国伯乐公司;Gel View 6000 化学发光凝胶成像系统购自广州云星仪器有限公司;Multiskan GO酶标仪购自Thermo。
1.3 实验方法
1.3.1 造模及槲皮素给药
实验动物采用随机数字表法分为3 组,分别是对照组10 只、博来霉素组(bleomycin,BLM)20 只、博来霉素+槲皮素组(BLM+QUE)20 只。 大鼠腹腔注射25%乌拉坦(4 mL/kg)麻醉后,BLM 组采取一次性给予大鼠气管内注射BLM(5 mg/kg)以造成大鼠急性肺损伤,对照组采取一次性气管内注射同体积无菌生理盐水,BLM+QUE 组采取向气管内一次性注入BLM(5 mg/kg)的当日给予腹腔注射槲皮素(3 mg/kg),其后每日一次腹腔注射槲皮素(3 mg/kg),直至大鼠被处死,期间所有大鼠均给予日常饮食。 分别在建模后第7、14、28 天,BLM 组和BLM+QUE 组随机处死6 只(剪断腹主动脉处死各组大鼠),并在第28 天处死对照组6 只,处死前所有动物均禁食10 h,称重后注射25%乌拉坦(4 mL/kg)麻醉,严格进行无菌消毒后留取同一位置适度大小的肺组织,放入冻存管中,置于-80℃冰箱中,用于制备肺组织匀浆和石蜡切片。
1.3.2 HE 染色
将取出的肺组织固定在4%多聚甲醛中24 h,除去多余多聚甲醛,加入PBS,每隔8 h 更换1 次,连续3 d,4℃冰箱保存,然后切成0.2 cm 厚的小块并标记好,然后用乙醇进行梯度洗脱,加入50%乙醇和50%二甲苯静置30 min,然后放入100%二甲苯,观察组织块至透明。 此时放入已经融好的50%石蜡和50%二甲苯溶液30 min,然后放入预融的100%石蜡两遍,每次2 h,再放入100%石蜡纸盒内凝固,置于4℃冰箱存放,取出,使用切片机切成约7 μm 厚的切片,将其置于水面上伸展,贴在已经处理好的载玻片上。 将制备好的石蜡切片使用二甲苯进行脱蜡,酒精梯度水化后用苏木精染液浸泡8 min后,再用自来水冲洗,加入1%盐酸乙醇10 s 后自来水冲洗,再加入0.5%伊红浸染3 min 后自来水冲洗,然后再用梯度乙醇脱水,依次使用二甲苯I 和II透明,中性树胶封片待分析。
1.3.3 ELISA 法检测分析各细胞因子
使用双抗体夹心法检测转化生长因子β1(transforming growth factor-β1,TGF-β1)、白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)。 以TNF-α 为例:标准品按照说明书进行梯度稀释,样本用样本稀释液进行稀释,分别于标准品孔、样本孔、空白孔加入标准品、样本、标准品稀释液各100 μL,各孔分别加生物素标记的细胞因子抗体50 μL,经37℃孵育后各孔加350 μL 洗涤液,静置1 min 后弃去,重复4 次,各孔加入标记的链霉亲和素工作液100 μL,经37℃孵育30 min 后弃去,重复4 次。 各孔加入100 μL 底物避光孵育,30 min 取出酶标板,各孔加入100 μL终止液,450 nm 波长处检测OD 值,绘制标准曲线,计算各细胞因子的浓度。
1.3.4 蛋白质免疫印迹法(Western blot)检测分析
利用Western blot 技术检测在第7、14、28 天时肺组织的NOX4、P62、NF-κB 水平。 Western blot 技术主要分以下步骤:提前制备好聚丙烯酰胺凝胶,上样后进行电泳,当目的蛋白电泳至分离胶2/3 处时停止电泳,采用半干式转膜至出现清晰条带并冲洗至染色液褪去,然后封闭、洗膜、一抗孵育、洗膜、二抗孵育、洗膜,进行显色反应后去除一抗和二抗,然后再洗膜,再次重复一抗孵育和二抗孵育的过程,最后进行图像分析。
1.3.5 人肺腺癌细胞株A549 细胞的培养与处理
采用含10%胎牛血清的RPMII640 培养基培养人肺腺癌细胞株A549 细胞。 将液氮中冻存的A549细胞迅速取出后,立即置于37℃的水浴锅中快速复苏,待冻存管内液体完全溶解后,转移至离心管中,加入10%胎牛血清的完全培养基,轻轻吹打混匀后置于离心机中离心后倒去上清液,再加入完全培养基将细胞重悬,转移至培养瓶中并置于37℃ CO2培养箱中培养。 倒置显微镜下观察细胞的生长情况,当细胞生长至80%汇合或即将汇合时进行细胞传代,全部操作步骤在超净工作台内完成。 将培养瓶中A549 细胞用胰酶消化以制备单细胞悬液,种于培养皿中,置于37℃细胞培养箱中,培养24 h 后,弃去上清液,用PBS 清洗2 次,加入2%胎牛血清继续培养24 h 后换液。 对照组加入PBS,TGF-β1 组加入终浓度为5 ng/mL 的TGF-β1,TGF-β1+QUE 组加入终浓度为5 ng/mL 的TGF-β1 和100 μmol/L 的QUE,继续培养48 h。
1.3.6 Real-time PCR 检测A549 细胞中E-cadherin mRNA、α-SMA mRNA 表达情况
采用TRIzol 提取试剂盒提取各组A549 细胞总RNA,经逆转录合成cDNA 模板,根据SYBR Green试剂盒中的有关说明对E-cadherin 和α-SMA mRNA表达水平进行检测,以GAPDH 作为内参物。 根据Primer Prenier 5.0 软件对引物进行设计,引物合成由上海生工生物科技有限公司合成,引物序列见表1。 PCR 反应体系总体积为20 μL(其中逆转录产物2 μL、SYBR Green Mix 10 μL、上下游引物各0.5 μL、7 μL 的ddH2O),PCR 扩增条件:94℃ 30 s,63℃ 30 s,72℃ 30 s,60℃ 30 s,共40 个循环。 采用2-△△Ct计算各基因表达情况。

表1 qRT-PCR 各引物序列Table 1 Primer sequences of qRT-PCR
1.4 统计学方法
实验数据采用SPSS 19.0 分析软件包以及Excel 2010 进行统计分析,计量资料用平均数±标准差(±s)表示,多组之间比较使用单因素方差分析(one-way ANOVA),组内数据之间的比较采用LSD-t检验,所有数据经统计分析后以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组肺组织纤维化的形态学观察
建模后第7、14、28 天观察,对照组肺表面光滑无结节无出血点,外观呈粉红色,轮廓清晰。 BLM组肺泡在第7 天时明显肿胀并有点状红斑;第14 天时呈灰白,有点状出血;第28 天时质地较硬,体积明显缩小。 BLM+QUE 组与BLM 组比较,整体情况偏好,没有明显结节,偶见少许点状出血及斑块,具体见图1。

图1 形态学观察不同组别大鼠第14、28 天肺组织纤维化情况Figure 1 Morphological observation of pulmonary fibrosis in different groups on the 14th and 28th days
2.2 HE 染色检测结果
HE 染色显示,建模后对照组各时间点内肺泡结构完整,肺泡壁较薄,肺泡内无明显炎症细胞浸润。 BLM 组肺泡在第7 天时有大量炎症细胞聚集,并有少量胶原纤维;第14 天肺泡间隔显著增厚,胶原纤维增多;第28 天时部分肺泡结构遭到破坏,大量肺泡塌陷,出现纤维化区域。 BLM+QUE 组在第7天时可见肺泡有炎性细胞浸润但较BLM 组症状轻;第14 天时炎症细胞浸润减轻,有少量胶原纤维沉积;第28 天时肺组织炎症病变明显减轻,轻度肺纤维化得到明显改变,具体见图2。
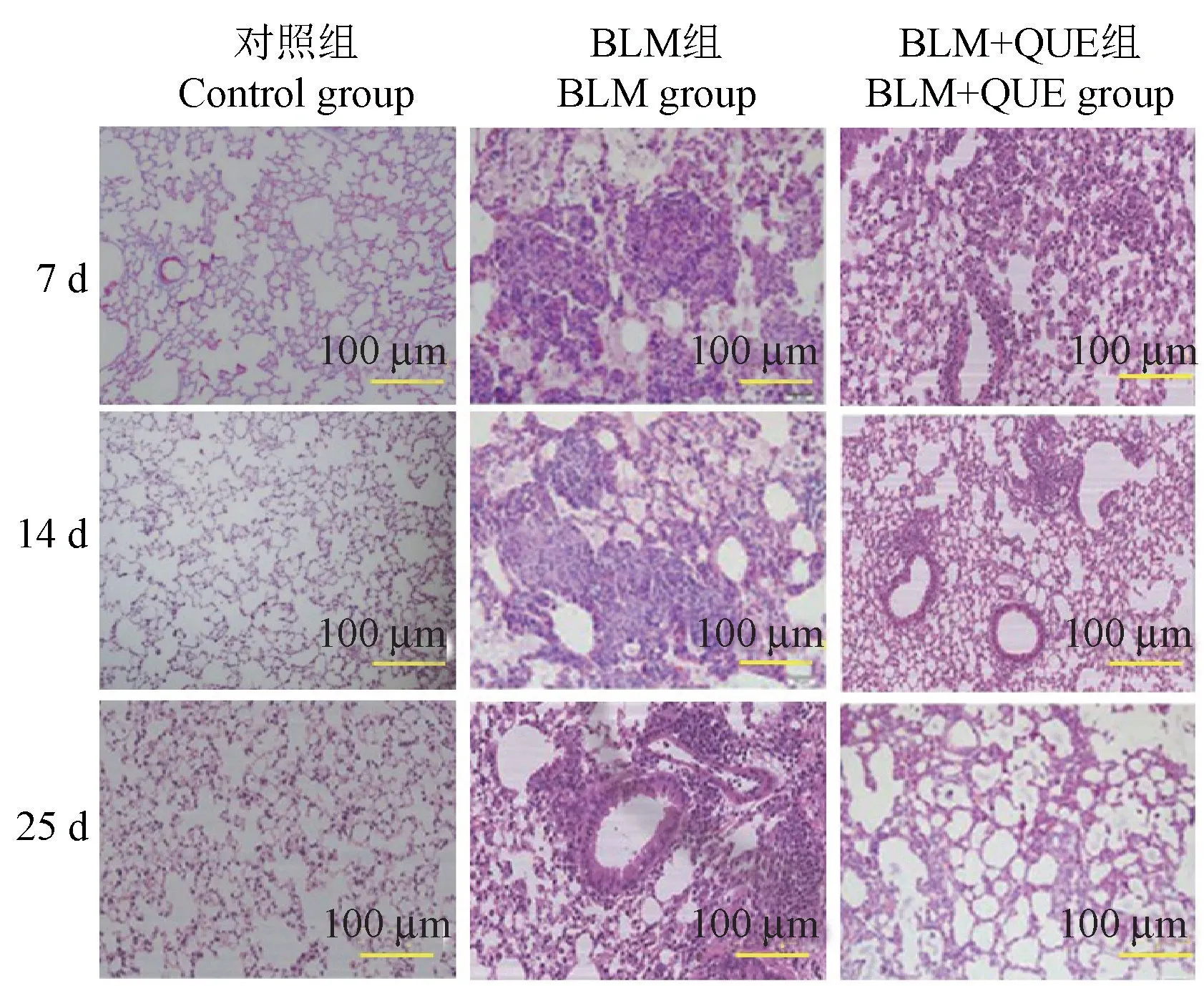
图2 各组大鼠肺组织第7、14、28 天的HE 染色情况Figure 2 HE staining of lung tissue of rats in each group on day 7, 14 and 28
2.3 各组实验动物细胞因子检测结果
在第7、14、28 天的样本检测中发现,BLM 组的TGF-β1、IL-1β、TNF-α、IL-6 和IL-8,与对照组比较明显上升,差异具有统计学意义(P<0.05),给药第14、28 天的样本中,BLM+QUE 组的TGFβ1、IL-1β、TNF-α、IL-6 和IL-8,与BLM 组比较显著下降,具有统计学差异(P<0.05),提示槲皮素在一定程度上具有减轻肺组织纤维化大鼠的炎症反应,见表2。

表2 各组细胞因子的检测结果Table 2 Test results of cytokines in each group
2.4 槲皮素对TGF-β1 诱导的A549 细胞间质转化的影响
对照组中A549 细胞的E-cadherin 呈高表达,α-SMA 呈低表达,加入TGF-β1 诱导的A549 细胞间质转化中,在第7、14、28 天时,A549 细胞E-cadherin的表达明显降低,在第28 天时达最低,差异具有统计学意义(P<0.05),同时对应各时间点,α-SMA 的表达水平明显增高(P<0.05)。 给予槲皮素后,各时间点与TGF-β1 组比较,A549 细胞的E-cadherin 的表达明显升高(P<0.05),但低于正常对照组,α-SMA 的表达明显降低(P<0.05)。 该结果说明槲皮素能够抑制TGF-β1 对A549 细胞诱导的EMT 的转变,具体见图3、表3。
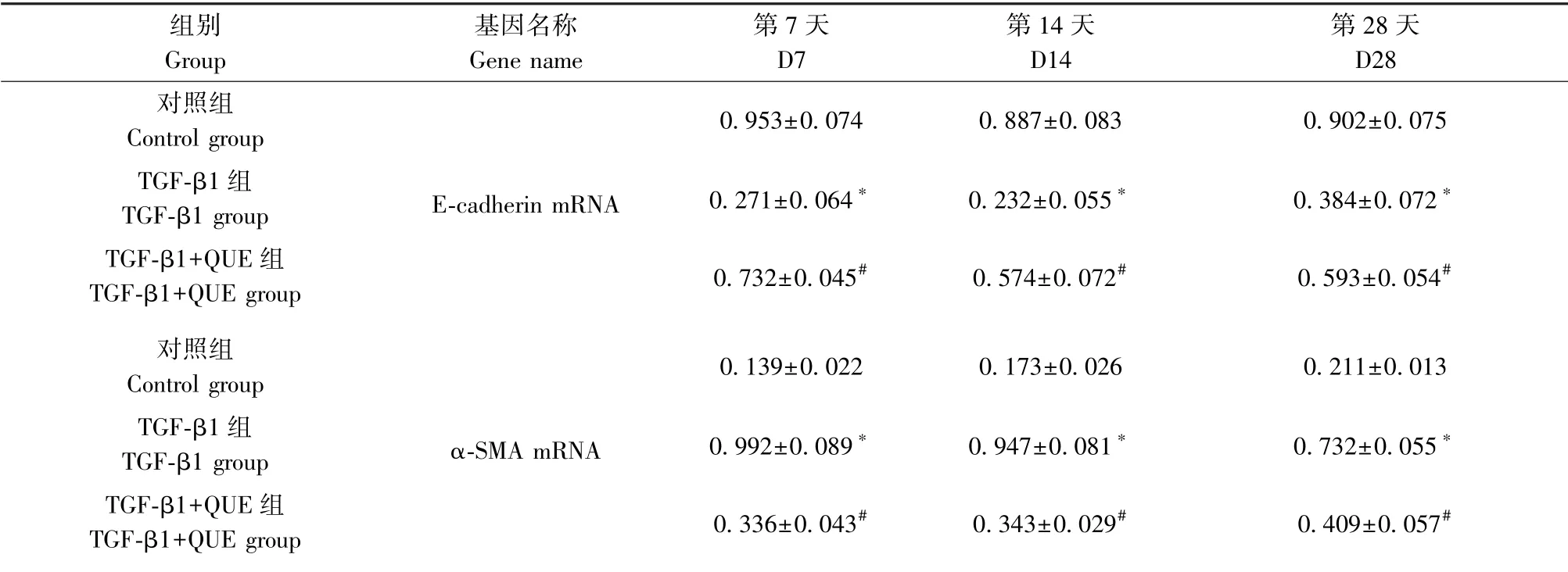
表3 不同组别不同时间点E-cadherin mRNA、α-SMA mRNA 的表达Table 3 Expression of E-cadherin mRNA and α-SMA mRNA in different groups at different time points

图3 qRT-PCR 检测各组不同时间点E-cadherin mRNA、α-SMA mRNA 的电泳图Figure 3 Electrophoresis of E-cadherin mRNA and α-SMA mRNA detected by qRT-PCR at different time points in each group
2.5 NOX4 和P62 蛋白的表达
在第7、14、28 天的样本检测中发现,BLM 组NOX4、P62、NF-κB 蛋白表达量显著高于正常对照组。 在第7 天检测的样本,BLM+QUE 组与BLM 组比较,NOX4、P62、NF-κB 蛋白表达量有所降低,但差异不显著(P>0.05),但在第14、28 天的检测结果中,BLM+QUE 组与BLM 组比较,NOX4、P62、NF-κB蛋白表达量显著降低(P<0.05),见图4、表4。

表4 不同组别不同时间点NOX4、P62 及NF-κB 的蛋白表达Table 4 Protein expression of NOX4, P62 and NF-κB at different time points in different groups

图4 Western blot 检测各组大鼠肺组织不同时间点NOX4、P62 及NF-κB 蛋白表达电泳图Figure 4 Western blot detection of NOX4, P62 and NF-κB in lung tissue of rats in each group at different time points
3 讨论
肺纤维化的致病因素至今没有明确阐释清楚,可能与不断恶化的空气质量、环境粉尘污染以及不明原因的物理化学污染等有关。 目前临床上没有根治的办法,患者常会出现渐进性加重,最终出现呼吸衰竭而死亡。 研究证明中药能够通过调节TGF-β 信号通路发挥抑制肺纤维化的作用[4-5]。 槲皮素在柴胡等中药中含量较高,具有多种生物学活性,既往的研究发现槲皮素对肺部疾病具有一定效果[6-7]。 明确槲皮素在抗肺纤维化过程中的机制有助于开发有针对性的治疗药物。 博莱霉素在Fe2+和O2-存在下诱导产生氧自由基,诱发细胞膜发生DNA 解链和脂质过氧化,导致细胞受损,启动纤维化前炎症反应[8]。 本次研究采用博莱霉素诱导大鼠发生肺纤维化,在造模后第7、14、28 天观察各组肺组织外观情况并经HE 染色结果分析,证明博莱霉素可以导致大鼠肺组织发生纤维化。 本次研究进一步探讨槲皮素对大鼠肺纤维化炎症反应的影响。
炎症反应在肺的纤维化过程中发挥重要作用,由于炎症细胞的聚集导致肺泡壁和气道的受损,继而出现的纤维化使肺发生不可逆重建[9-10]。 TGFβ1 是肺纤维化形成的关键因子,它能够促进肺泡上皮细胞发生上皮细胞间质转化,促进成纤维细胞的形成。 TNF-α 可促进炎症反应和间质细胞增殖分化。 IL-1β 是一种前炎性因子,能够诱导其它炎性因子的合成。 肺纤维化的发生与多种细胞因子如TGF-β1、IL-1β、TNF-α、IFN-γ、NF-κB 等的异常表达有一定关系,已有研究证明TGF-β1、IL-1β 和TNF-α对于促进成纤维细胞的增生和肺纤维化发挥重要作用[11]。 本次研究结果与既往的研究结果一致[12],发现在肺纤维化形成过程中,TGF-β1、IL-1β和TNF-α 的表达明显上升,给予槲皮素后,3 者水平又明显下降,说明槲皮素能够减轻肺纤维化的炎症反应。
成纤维细胞大量聚集是肺纤维化的重要病理特征,而成纤维细胞的产生主要有3 个途径,除了肺固有的成纤维细胞发生增殖和外周血游离的成纤维细胞迁移至肺以外,最主要的就是肺上皮细胞的间质转化[13]。 因此,以间质转化为研究靶点可能会抑制肺纤维化的进程。 E-cadherin 是上皮细胞的主要标志物之一,在维持细胞间的正常链接中起到重要作用,它的表达减少会释放β-cadherin 转移至细胞核进而诱导间质转化基因的表达。 α-SMA 是平滑肌肌动蛋白的一种异构形式,主要控制细胞的收缩,它的表达是纤维化的标志,当上皮细胞发生间质转化时,α-SMA 的表达明显增加,TGF-β1 能够促进α-SMA 的表达[14]。 本次研究结果提示:槲皮素能够逆转TGF-β1 诱导的人肺腺癌细胞株A549 细胞对E-cadherin 表达的抑制,同时能够下调发生间质转化后α-SMA 的表达,说明槲皮素能够抑制TGF-β1 诱导的人肺腺癌细胞株A549 细胞发生间质转化。
氧化抗氧化平衡失调可能是肺组织纤维化的机制之一。 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)在生理状态下呈低表达、低活性状态,当机体发生疾病时,NOX 被激活后通过产生活性氧簇介导的氧化应激反应参与疾病的发生发展。 在肝纤维化初始阶段,NOX 参与调控TGF-β 等促纤维化因子作用下细胞的活化[15]。NOX4 是NOX 的一个重要亚基,NOX4 诱导老年小鼠NrF2 应答的能力损伤,导致肺组织更容易发生纤维化[16]。 自噬是真核生物中长周期蛋白降解的重要途径,在细胞的整个生命周期中扮演重要角色。自噬蛋白P62(也称为SQSTM1 蛋白)是检测自噬水平的标志物,当细胞自噬活性受到抑制时,P62 蛋白在细胞内大量聚集,引发一系列生理病理结果。 本研究结果发现NOX4 的蛋白表达随着肺纤维化的严重程度增加而呈进行性升高,证明NOX4 的促纤维化效应,同时说明NOX4 不仅参与早期肺细胞损伤,而且在肺纤维化的形成阶段可能发挥非常重要的作用。 研究结果中,BLM 组P62 蛋白表达明显高于正常对照组,BLM+QUE 组P62 蛋白表达较BLM 组明显降低,说明自噬不足参与了肺纤维化的过程,同时也证明槲皮素能够下调自噬抑制肺纤维化大鼠的P62 蛋白表达,通过抑制NOX4-P62 信号途径,激活自噬,干预肺纤维化,减轻肺纤维化的症状。
综上所述,博莱霉素能够诱导大鼠发生肺纤维化,槲皮素能够减轻肺纤维化的炎症反应,能够抑制TGF-β1 诱导的人肺腺癌细胞株A549 细胞发生间质转化,同时也能通过抑制NOX4-P62 信号途径,激活自噬,干预肺纤维化,减轻肺纤维化的症状。但是我们的研究对象是实验大鼠,对于人体肺纤维化的实际疗效到底如何,槲皮素的适宜剂量等方面的情况还需要做进一步的研究才能确定。
