黄草乌异戊烯基焦磷酸异构酶基因的克隆与功能研究
2022-08-16马晓惠曹小青管丽娜李国栋王一博
马晓惠,曹小青,管丽娜,李国栋,王一博
·药材与资源•
黄草乌异戊烯基焦磷酸异构酶基因的克隆与功能研究
马晓惠*,曹小青,管丽娜,李国栋,王一博*
云南中医药大学中药学院 云南省南药可持续利用研究重点实验室,云南 昆明 650500
对黄草乌的异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)基因进行克隆及功能研究,为黄草乌中二萜生物碱的生物合成途径解析奠定基础。基于黄草乌的转录组数据筛选注释为的基因,设计特异性引物克隆其编码区,利用相关软件对其进行生物信息学分析,利用实时荧光定量PCR分析其在黄草乌不同器官中的表达情况,在大肠杆菌中表达其重组蛋白,利用功能显色验证其功能。从黄草乌中克隆得到1个基因(Genbank登录号MZ814967)。生物信息学分析表明,的开放阅读框(open reading frame,ORF)为897 bp,编码298个氨基酸,分子式为C1516H2362N414O452S11,相对分子质量为33 970,理论等电点为5.94,具有异戊烯基焦磷酸异构酶TNTCCSHPL和WGEHELDY 2个保守序列。系统进化分析显示,AvIDI与黄龙胆IDI的亲缘关系最近。表达分析表明,基因在黄草乌根、茎、叶和花中均有表达,在茎中表达量最高。在大肠杆菌中成功表达了AvIDI重组蛋白,功能显色实验表明,编码有功能的IDI蛋白,能促进大肠杆菌中番茄红素的积累。克隆得到基因,并通过功能显色实验证明其编码有功能的IDI蛋白,该研究为利用基因调控黄草乌中二萜生物碱生物合成奠定了基础。
黄草乌;异戊烯基焦磷酸酶;基因克隆;生物信息学分析;功能显色
黄草乌Kom.又被称为藤草乌、昆明堵喇、昆明乌头等,为毛茛科乌头属多年生草本植物[1],其块根作为药材黄草乌入药[2-3],是云南白药、云南红药等伤科药的重要原料。黄草乌具有祛风散寒、解毒消肿、活血止痛等功效[4],其主要毒性成分和有效成分是二萜生物碱类成分[5-6],二萜生物碱的生源合成途径受到广泛关注。二萜生物碱的氨基化过程发生在二萜环状碳骨架形成后,其因氨基化过程较晚而被称为假生物碱(pseudoalkaloids)[7]。根据二萜生物碱的化学结构,科研工作者提出了其生源途径:通过细胞质中的甲羟戊酸(mevalonate,MVA)途径和质体中的2--甲基--赤藻糖醇-4-磷酸(2--methyl--erythritol- 4-phosphate,MEP)途径合成异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP),其在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI/IPI)的催化作用下和其异构体二甲基丙烯基焦磷酸(dimethylallyl pyrophosphate,DMAPP)进行互相转化,IPP和DMAPP在牻牛儿基焦磷酸合酶(geranyl diphosphate synthase,GPS)、法呢基焦磷酸合酶(farnesyl diphosphate synthase,FPS)和牻牛儿基牻牛儿基焦磷酸合酶(geranylgeranyl pyrophosphate synthase,GGPPS)的作用下合成二萜前体牻牛儿牻牛儿焦磷酸(geranylgeranyl diphosphate,GGPP),GGPP在二萜合酶的作用下环化、重排形成二萜生物碱的基本环状碳骨架结构考烷(kaurane)和阿替烷(atisane),二者在氨基转移酶及细胞色素P450等酶的作用下发生氨基化、氧化等反应形成阿替生(atisines)型和维特钦型(veatchines)C20二萜生物碱,atisines和veatchines进一步通过重排、脱氨基等反应生成其他C20、C19和C18类二萜生物碱[7-9]。IDI通过调节IPP和DMAPP的稳态比例影响二萜生物碱的生物合成,黄草乌中基因的克隆及功能研究对黄草乌中二萜生物碱的生物合成途径研究具有重要意义。
本研究基于黄草乌转录组数据,从黄草乌中克隆获得1条基因,对其编码蛋白的理化性质、保守结构域、系统进化关系等进行分析,用实时荧光定量PCR分析其在黄草乌不同器官的表达情况,并在大肠杆菌中异源表达研究其功能,为今后利用基因调控黄草乌中二萜生物碱的生物合成奠定基础。
1 材料与试剂
1.1 材料
植物样品于2019年10月采自云南省玉溪市澄江县梁王山,经云南中医药大学李国栋副教授鉴定为黄草乌.Kom.。黄草乌冲洗干净后经液氮速冻后留样保存于云南省道地濒危中药材繁育与栽培工程技术研究中心实验室−80 ℃冰箱。DH5α Chemically Competent Cell购自翌圣生物科技(上海)有限公司;BL21(DE3)Chemically Competent Cell和1-Blue Chemically Competent Cell均购自北京全式金生物技术有限公司。
1.2 试剂
pCold GST DNA购自宝生物工程有限公司;pTrc-和pAC-LYC由Francis X Cunningham Jr.Gantt(美国马里兰州学院马里兰大学)教授惠赠。
2 方法
2.1 总RNA提取及cDNA合成
采用Trizol法提取黄草乌根、茎、叶、花的总RNA,用超微量紫外可见分光光度计(DS-11,美国DENOVIXING)和1%琼脂糖凝胶电泳检测RNA质量,用PrimeScriptTMRT reagent Kit with gDNA Eraser(perfect real time)(TaKaRa公司)将RNA反转录为cDNA,cDNA保存于−20 ℃冰箱。
2.2 基因克隆
从黄草乌转录组中共获得1条注释为基因的序列,利用Primer Premier 5.0软件设计全长无缝克隆特异性引物pCold--F(5’-GGT- ACCCTCGAGGGATCCATGTCGACGATCGGATT-GAAC-3’)和pCold--R(5’-TCTAGACTG- CAGGTCGACTCAAGTCAATTTGTGGATTG-3’)。以黄草乌根cDNA为模板扩增其全长,PCR反应体系(50 μL):PrimeSTAR HS(Premix)25 μL、正向和反向引物(10 μmol/L)各1 μL、cDNA 1 μL、双蒸水(ddH2O)22 μL。反应程序:94 ℃、5 min; 98 ℃、10 s,55 ℃、15 s,72 ℃、60 s,34个循环;72 ℃、10 min。PCR产物经1%琼脂糖凝胶电泳检测后纯化,连入原核表达载体pCold GST DNA,转化DH5感受态细胞,于含氨苄青霉素(ampicillin,AMP)(100 mg/L)的LB平板上,37 ℃培养12~16 h。从平板上挑取单克隆进行菌落PCR验证,阳性结果送生工生物工程(上海)股份有限公司测序,将测序正确的重组质粒命名为pCold GST DNA-。
2.3 生物信息学分析
利用NCBI(National Center for Biotechnology Information)在线分析基因的开放阅读框(open reading frame,ORF)和同源性;利用ExPASy-ProtParam tool (https://web.expasy.org/ protparam/)在线分析AvIDI蛋白的理化性质;利用TMHMM 2.0(http://www. cbs.dtu.dk/services/ TMHMM/)在线分析AvIDI蛋白的跨膜区;利用SignalP 5.0(https://services.healthtech.dtu.dk/ service.php?SignalP-5.0)分析信号肽;用WoLF PSORT (https://wolfpsort.hgc.jp/)预测AvIDI的亚细胞定位;使用InterPro(http://www.ebi.ac. uk/interpro /search/sequence-search)分析AvIDI的结构域;使用SOMPA (https://npsa prabi. ibcp.fr/cgi- bin/npsa_automat.pl? page=/NPSA/npsa_sopma. html)在线预测蛋白的二级结构;使用SWISS- MODEL(http://swissmodel. expasy.org/)预测蛋白的三级结构;利用BioEdit软件进行氨基酸序列多重比对;利用NCBI的蛋白质序列数据库搜索同源序列,用MEGA6.0构建系统进化树,bootstrap为1000。
2.4 表达分析
根据序列设计实时荧光定量PCR引物-qRT-F(5’-GCTTCTGGATGAACTGGGTA- TT-3’)和-qRT-R(5’-ATTTGACGTCGCGGA- CTATG-3’),以作为内参基因[10],实时荧光定量PCR反应在Roche LightCycler®96实时荧光PCR仪上进行。qRT-PCR反应体系(20 μL):TB Green Premix Ex Taq II(Tli RNaseH Plus)(2×)10 μL、cDNA 2 μL、正向反向引物(10 μmol/L)各1 μL,双蒸水(ddH2O)6 μL。反应程序:95 ℃、30 s;95 ℃、5 s,55 ℃、30 s,72 ℃、10 s,40个循环;95 ℃、15 s,60 ℃、30 s,95 ℃、1 s。黄草乌根、茎、叶和花各设3个生物学重复,每个样品设3个技术重复。用LightCycler®96 SW以及SPSS软件分析结果。的相对表达量用2−ΔΔCt法计算。
2.5 AvIDI重组蛋白表达
将重组质粒pCold GST DNA-转化至大肠杆菌BL21(DE3)Chemically Competent Cell,挑取单克隆于含AMP(100 mg/L)的LB液体培养基中,37 ℃ 250 r/min培养至吸光度(600)为0.6~1.0,加入异丙基-β--硫代半乳糖苷(IPTG)至终浓度1 mmol/L,于15 ℃诱导培养菌液15 h。离心收集菌体,加入PBS缓冲液复溶,用超声波细胞破碎仪以5 s/8 s程序超声破碎菌体至液体澄清,4 ℃离心收集上清和沉淀,十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分析蛋白表达情况。以转化pCold GST DNA的BL21(DE3)进行随行实验作为对照。
2.6 功能显色
限制性核酸内切酶I和H I酶切表达载体pTrc-,切胶回收获得链状pTrc载体;以重组质粒pCold GST DNA-1为模板,用pTrc-AvIDI-F (5’-GGGGTACCATGTCGACGATC- GGATTGAA-3’)和pTrc-AvIDI-R (5’-CGGGAT- CCTCAAGTCAATTTGTGGATTGTT-3’)为引物进行PCR扩增,PCR产物纯化后用I和H I酶切,酶切产物纯化后用T4连接酶与链状pTrc载体进行连接,连接产物转化Trans1-Blue Chemically Competent Cell,于含AMP(100 mg/L)的LB平板37 ℃培养12~16 h,菌落PCR验证并送测序,将测序结果正确的重组质粒命名为pTrc-。将质粒pTrc、pTrc-和pTrc-分别与pAC-LYC共转化1-Blue感受态细胞,于含AMP(100 mg/L)和氯霉素(chloramphenicol,Cm,20 mg/L)的LB平板37 ℃培养12~16 h。同时将pAC-LYC转化1-Blue感受态细胞,于含Cm(20 mg/L)的LB平板上培养。将菌落PCR验证正确的单克隆点于含AMP(100 mg/L)和Cm(20 mg/L)的LB平板上,28 ℃培养3~4 d,观察菌斑的颜色变化。
3 结果与分析
3.1 AvIDI的基因克隆
以黄草乌根的cDNA为模板扩增基因,PCR产物经1%琼脂糖凝胶电泳检测,结果显示,在1000 bp附近有明亮的条带(图1),与黄草乌转录组中长度一致,将PCR产物连入表达载体pCold GST DNA,获得重组质粒pCold GST DNA-,测序结果表明,的ORF为897 bp,编码298个氨基酸。
3.2 生物信息学分析
3.2.1 理化性质分析 AvIDI蛋白的相对分子质量为33 970,理论等电点(pI)为5.94。跨膜结构域分析结果表明,AvIDI蛋白无跨膜结构,为非膜蛋白。信号肽分析表明,AvIDI蛋白无信号肽,为非分泌蛋白。亚细胞定位预测结果表明,AvIDI蛋白定位于叶绿体上。结构域分析表明(图2),AvIDI含有NUDIX水解酶域(NUDIX hydrolase_dom,116~255 aa)和IPP异构酶的结构域(IsopentenylPP_isomerase_typ1,86~268 aa)。蛋白二级结构预测结果显示,AvIDI蛋白二级结构中α-螺旋占54.03%,延伸链占12.08%,β-转角占5.37%,无规则卷曲占28.52%,AvIDI蛋白的主要结构元件是α-螺旋和无规则卷曲。以人类IDI蛋白(2i6k.1.A)为模板(序列相似度为53.30%),用SWISS-MODEL模拟构建AvIDI蛋白质的三级结构,结果见图3。3.2.2 多重序列比对及系统发育树分析 NCBI在线blast分析表明,AvIDI蛋白与黄龙胆IDI蛋白相似度最高,相似度为91.06%。用BioEdit将AvIDI的氨基酸序列与其他物种已报道有功能的IDI氨基酸序列进行多重序列比对,AvIDI具有IDI蛋白高度保守的TNTCCSHPL和WGEHELDY序列(图4)。在NCBI中下载已报道的IDI蛋白序列,用MEGA6.0构建系统发育树,结果表明,AvIDI与植物IDI聚为一支,与黄龙胆的亲缘关系最近(图5)。
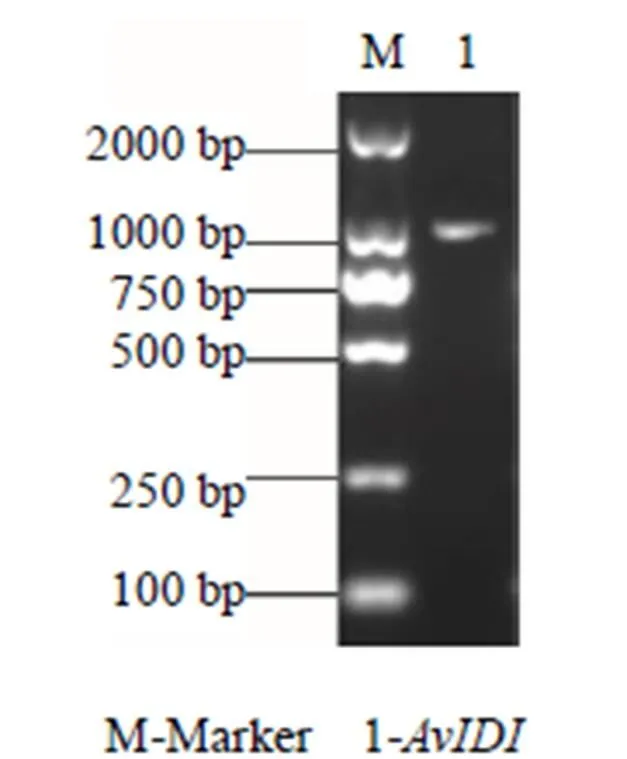
图1 AvIDI的PCR扩增产物
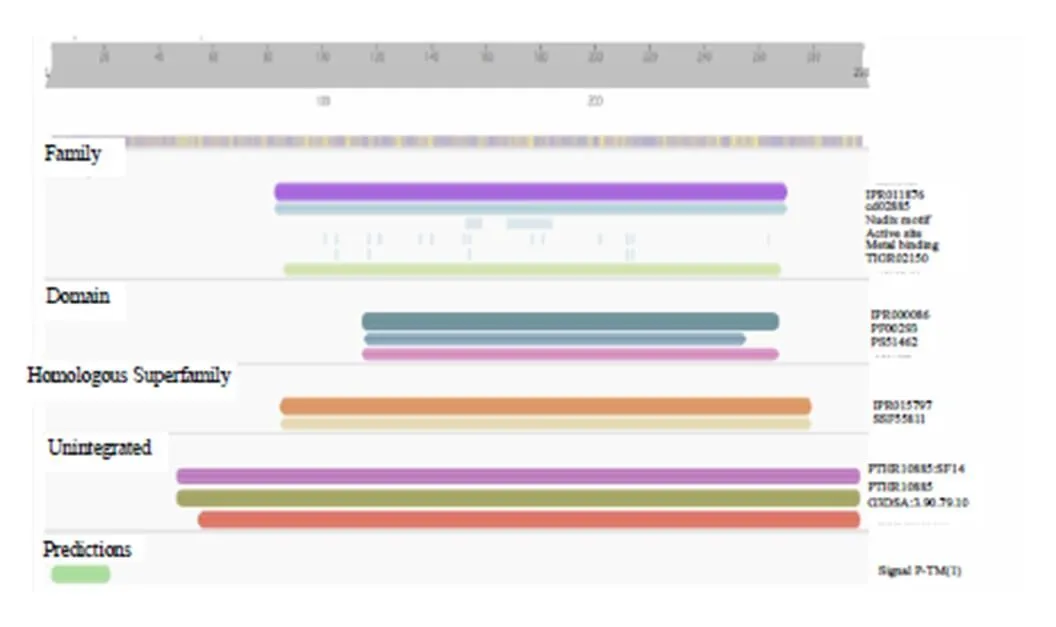
图2 AvIDI功能结构域预测
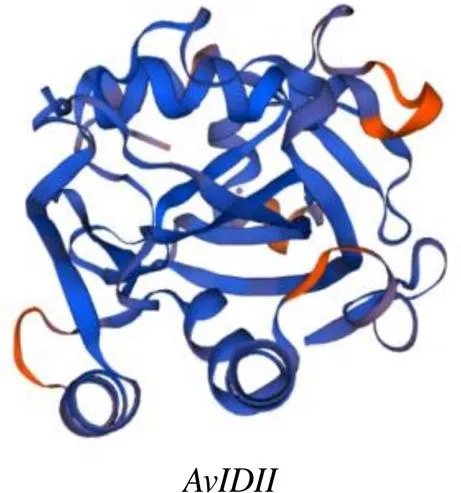
图3 AvIDI蛋白三级结构预测
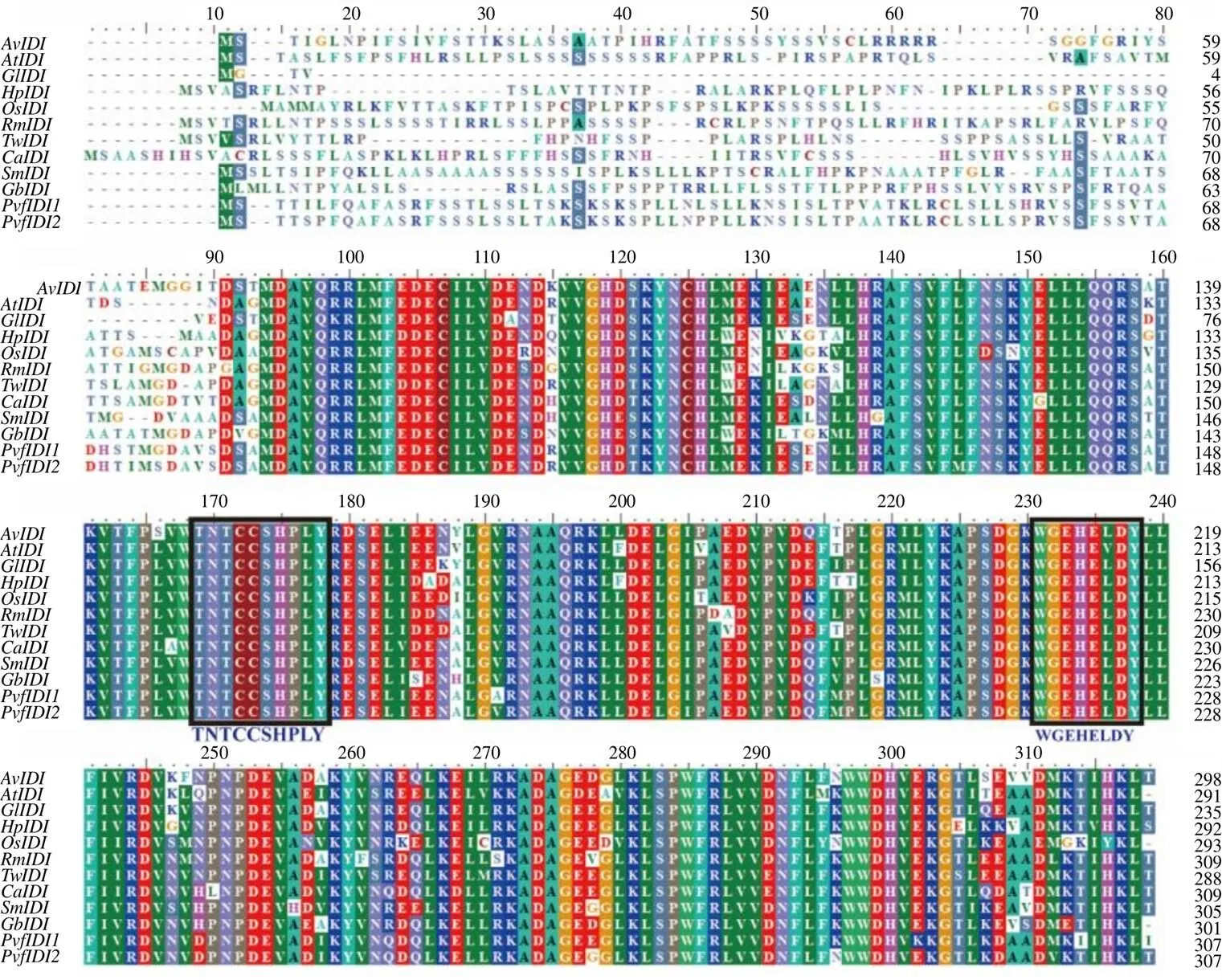
AtIDI-Arabidopsis thaliana IDI (NP197148.3) GlIDI-Gentiana lutea IDI (BAE92732.1) HpIDI-Hypericum perforatum IDI (JAW07394.1) OsIDI-Opuntia streptacantha IDI (MBM5471501.1) RmIDI-Rhizophora mucronate IDI (MBW95860.1) TwIDI-Tripterygium wilfordii IDI (ALB26774.1) CaIDI-Camptotheca acuminata IDI (ABI13583.1) SmIDI-Salvia miltiorrhiza IDI (ABV08818.1) GbIDI-Gossypium barbadense IDI (ABI94388.1) PvfIDI1-Panax vietnamensis var. fuscidiscus (MZ736417.1) PvfIDI2-Panax vietnamensis var. fuscidiscus (MZ736418.1)
3.3 AvIDI在黄草乌不同器官的表达分析
以为内参基因分析在黄草乌根、茎、叶和花中的表达,结果如图6所示,在黄草乌各个器官中均有表达,在茎中表达量最高,在根中表达量其次,在叶和花中表达量较低。
3.4 AvIDI重组蛋白表达
SDS-PAGE电泳结果(图7)显示,含重组质粒pCold GST DNA-的菌株在约60 000处有明显蛋白条带(融合蛋白理论相对分子质量为AvIDI理论相对分子质量33 970与26 000的GST标签之和),与预期AvIDI融合蛋白大小一致,且上清和沉淀中均出现了明显的条带,说明在大肠杆菌BL21(DE3)中成功表达了。
3.5 功能显色验证AvIDI功能
番茄红素是一种天然红色开链烃类胡萝卜素,主要存在一些红色果蔬中,大肠杆菌本身不能自身产生番茄红素,由于pAC-LYC中含有3个参与番茄红素合成的基因,即香叶基香叶基焦磷酸合成酶()、八氢番茄红素合成酶()和八氢番茄红素脱饱和酶(),转化pAC-LYC的大肠杆菌可产生番茄红素,菌斑颜色可以反映大肠杆菌中番茄红素的产量,菌斑的颜色越深,番茄红素的量越多[11-12]。将pTrc、pTrc-和pTrc-分别与质粒pAC-LYC共转化大肠杆菌1-blue。从图8可知,仅转化pAC-LYC的菌株(P2)在同时含有AMP和Cm的LB培养基上无法生长,含有pTrc和pAC-LYC的菌株(P1)在同时含有AMP和Cm的LB培养基上能正常生长并呈现浅粉色,说明其能产生少量番茄红素,含有pAC-LYC及pTrc-和pTrc-的菌株(分别为At和Av)均能正常生长,且其颜色较P1深,说明At和Av中产生的番茄红素较P1多,由此表明,和编码有功能的IDI蛋白,均可以促进番茄红素的生物合成。

图5 IDI蛋白系统发育树
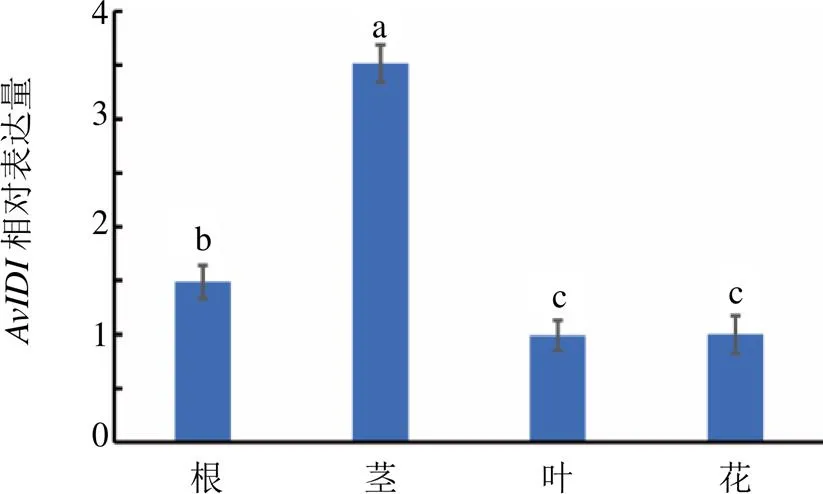
不同小写字母代表差异显著(P<0.05)
Fig 6 Expression of AvIDI in different organs of

M-Marker TP-总蛋白 S-上清液 P-沉淀
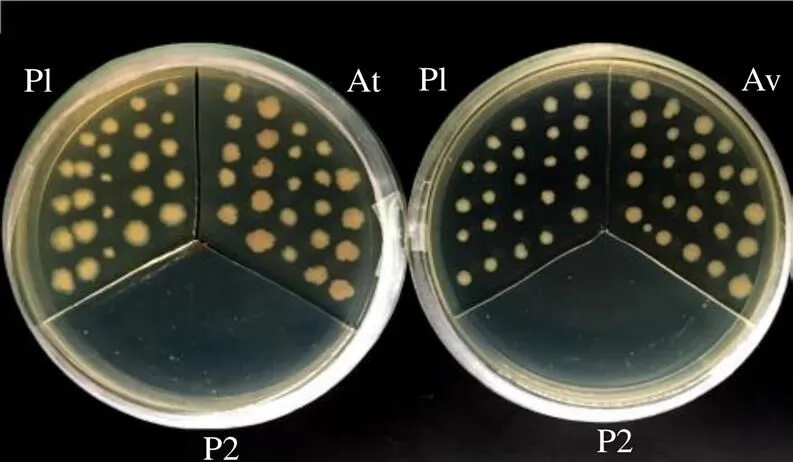
图8 AvIDI在大肠杆菌中的功能显色
4 讨论
乌头属含有多种药用植物,二萜生物碱是黄草乌等多种乌头属植物的镇痛活性成分,科研工作者构建了乌头属异叶乌头Pritz.[13-14]、乌头Debeaux[15-18]和黄草乌[19]等多种植物的转录组,乌头属植物的转录组为二萜生物碱生物合成途径研究提供了大量基础数据,为二萜生物碱生物合成途径中基因的功能鉴定奠定了基础。然而,关于二萜生物碱生物合成途径中相关基因的克隆及功能研究较少,Mao等[16]从乌头中克隆并鉴定了12个二萜合酶,包括7个AcCPS和5个AcKSL,7个AcCPSs均催化GGPP生成ent-copalyl diphosphate(-CPP),而AcKSL催化ent-CPP分别生成-kaurene、-atiserene和-13-epi- sandaraco- pimaradie 3种产物,该研究推动了二萜生物碱生物合成途径的解析进程。IPP和DMAPP是萜类化合物的重要前体,二者在IDI作用下进行相互转化,IDI通过调控IPP和DMAPP的比例及含量影响萜类及其衍生物的生物合成,因此基因的克隆及功能研究对萜类化合物的生物合成途径研究及其应用具有重要意义。目前,茶树、烟草、拟南芥、雷公藤、丹参、海岛棉和越南参等多种植物的基因已克隆获得,并通过原核表达或RNAi等方法对其进行功能研究[20-26]。其中,茶树、拟南芥和越南参等植物中报道了2个基因[24-26],而雷公藤和丹参等植物中仅报道了1个基因[20-21]。不同植物中的基因数量不完全一致,可能由于不同植物中本身存在的基因数量不一致,也可能与转录组测序深度有关,目前很多基因的挖掘都依赖于转录组,而转录组测序的深度与基因的完整性密切相关,为了全面深入挖掘相关基因,可充分结合基因组和转录组进行相关工作。
黄草乌是云南特色药用植物资源,二萜生物碱是其活性成分,为了研究黄草乌中二萜生物碱的生物合成途径,本研究从黄草乌中克隆得到1条基因,对其进行了相关生物信息学分析,在大肠杆菌中成功表达AvIDI重组蛋白,并通过显色反应证明其编码有功能的IDI蛋白,能促进大肠杆菌中番茄红素的积累。黄草乌中IDI基因的克隆及功能研究为利用IDI基因调控二萜生物碱的生物合成奠定了基础。
志谢:美国马里兰州学院马里兰大学Francis X Cunningham Jr. (Gantt) 教授惠赠实验所用载体,首都医科大学童宇茹博士对实验的指导。
利益冲突 所有作者均声明不存在利益冲突
[1] 李雪佩, 何俊,贺水莲, 等. 黄草乌植物的研究进展 [J]. 西部林业科学, 2017, 46(6): 1-7.
[2] 重庆市中药饮片炮制规范及标准(2006年版)[S]. 2006: 152.
[3] 云南省中药材标准-第一册: 2005年版 [S]. 2005: 26.
[4] 王丽苹, 陈强威, 沈志滨, 等. 黄草乌及其炮制品的毒性和镇痛作用研究 [J]. 中药材, 2018, 41(8): 1864-1868.
[5] 温玉莹, 王丽苹, 沈志滨, 等. 黄草乌及其炮制品对心脏毒性的作用和机制研究 [J]. 中药材, 2019, 42(6): 1277-1282.
[6] 黎虽宇, 刘小赟, 唐春萍, 等. 黄草乌炮制前后生物碱含量及心脏毒性差异研究[J]. 中草药, 2018, 49(23): 5588-5593.
[7] Devkota K P, Sewald N. Terpenoid alkaloids derived by amination reaction [J]., 2013: 923-951.
[8] Cherney E C, Baran P S. Terpenoid-alkaloids: Their biosynthetic twist of fate and total synthesis [J]., 2011, 51(3/4): 391-405.
[9] 肖培根, 王锋鹏, 高峰, 等. 中国乌头属植物药用亲缘学研究 [J]. 植物分类学报, 2006, 44(1): 1-46.
[10] 曾礼芳, 李国栋, 王宝婕, 等. 黄草乌实时荧光定量PCR内参基因的筛选 [J]. 中国中药杂志, 2021, 46(12): 3116-3122.
[11] Alonso-Gutierrez J, Chan R, Batth T S,. Metabolic engineering offor limonene and perillyl alcohol production [J]., 2013, 19: 33-41.
[12] Cunningham F X Jr, Sun Z, Chamovitz D,. Molecular structure and enzymatic function of lycopene cyclase from the cyanobacteriumsp strain PCC7942 [J]., 1994, 6(8): 1107-1121.
[13] Malhotra N, Kumar V, Sood H,. Multiple genes of mevalonate and non-mevalonate pathways contribute to high aconites content in an endangered medicinal herb,Wall [J]., 2014, 108: 26-34.
[14] Pal T, Malhotra N, Chanumolu S K,. Next-generation sequencing (NGS) transcriptomes reveal association of multiple genes and pathways contributing to secondary metabolites accumulation in tuberous roots ofWall [J]., 2015, 242(1): 239-258.
[15] Rai M, Rai A, Kawano N,. De novo RNA sequencing and expression analysis ofto analyze key genes involved in the biosynthesis of diterpene alkaloids [J]., 2017, 22(12): 2155.
[16] Mao L Y, Jin B L, Chen L L,. Functional identification of the terpene synthase family involved in diterpenoid alkaloids biosynthesis in[J]., 2021, 11(10): 3310-3321.
[17] Zhao D K, Shen Y, Shi Y N,. Probing the transcriptome ofreveals the candidate genes associated with the biosynthesis of the toxic aconitine-type C19-diterpenoid alkaloids [J]., 2018, 152: 113-124.
[18] 张大燕, 文欢, 王伟, 等. 乌头萜类生物合成代谢的转录组学分析 [J]. 中国实验方剂学杂志, 2017, 23(16): 45-50.
[19] Li Y G, Mou F J, Li K Z. De novo RNA sequencing and analysis reveal the putative genes involved in diterpenoid biosynthesis inroots [J]., 2021, 11(2): 96.
[20] Tong Y R, Zhang M, Su P,. Cloning and functional characterization of an isopentenyl diphosphate isomerase gene from[J]., 2016, 63(6): 863-869.
[21] Zhang X N, Guan H Y, Dai Z B,. Functional analysis of the isopentenyl diphosphate isomerase ofvia color complementation and RNA interference [J]., 2015, 20(11): 20206-20218.
[22] Wang Y C, Qiu C X, Zhang F,. Molecular cloning, expression profiling and functional analyses of a cDNA encoding isopentenyl diphosphate isomerase from[J]., 2009, 29(2): 111-119.
[23] Yan N, Zhang H B, Zhang Z F,. Organ- and growing stage-specific expression of solanesol biosynthesis genes inreveals their association with solanesol content [J]., 2016, 21(11): 1536.
[24] Phillips M A, D'Auria J C, Gershenzon J,. Thetype I isopentenyl diphosphate isomerases are targeted to multiple subcellular compartments and have overlapping functions in isoprenoid biosynthesis [J]., 2008, 20(3): 677-696.
[25] 陈丹, 王鹏杰, 陈笛, 等. 茶树CsIDI1和CsIDI2基因的克隆及其表达分析 [J]. 西北植物学报, 2018, 38(5): 800-807.
[26] 王一博, 管丽娜, 曹小青, 等. 越南参变种异戊烯基焦磷酸异构酶基因的克隆与功能研究 [J]. 药学学报, 2021, 56(12): 3362-3369.
Cloning and functional characterization of isopentenyl diphosphate isomerase gene from
MA Xiao-hui, CAO Xiao-qing, GUAN Li-na, LI Guo-dong, WANG Yi-bo
Yunnan Key Laboratory of Sustainable Utilization of Southern Medicine, College of Chinese Materia Medica, Yunnan University of Chinese Medicine, Kunming 650500, China
To clone and functionally study the isopentenyl diphosphate isomerase (IDI) gene of, so as to lay a foundation for the analysis of the biosynthetic pathway of diterpene alkaloids in.The genes annotated aswere selected from the transcriptome data of. Specific primers were designed to clone the coding regions. Bioinformatics analysis was performed with relevant software. Real-time quantitative PCR was used to analyze their expression level in different organs of. The recombinant protein was expressed in, and its function was verified by functional coloration experiment.Angene (, Genbank accession No. MZ814967) was cloned from. Bioinformatics analysis showed that the open reading frame ofwere 897 bp encoding 298 amino acids. The molecular formula of AvIDI was C1516H2362N414O452S11. The molecular weight of AvIDI was 33 970 with a theoretical pI of 5.94. AvIDI contained two conserved sequences of TNTCCSHPL and WGEHELDY. Phylogenetic analysis showed that AvIDI was closely related toIDI. Expression analysis showed thatexpressed in root, stem, leaf and flower of, with highly expression in the stem. The recombinant protein of AvIDI was successfully expressed in. The functional coloration experiment inshowed thatencoded a functional IDI protein and promoted the accumulation of lycopene.Thewas cloned and proven to encode a functional IDI protein. This study laid a foundation for the regulation of diterpenoid alkaloids biosynthesis inwithgene.
Kom.; isopentenyl diphosphate isomerase; gene cloning; bioinformatics analysis; functional coloration
R282.12
A
0253 - 2670(2022)16 - 5142 - 07
10.7501/j.issn.0253-2670.2022.16.023
2022-02-09
中央本级重大增减支项目(2060302);云南省科技人才和平台计划(202105AG070012)
马晓惠,讲师,从事分子生药学研究。E-mail: maxiaohui1988@126.com
王一博,硕士,从事分子生药学研究。E-mail: 2498927287@qq.com
[责任编辑 时圣明]
