柠条花中总生物碱提取工艺研究
2020-09-10王菲张艳珍毛海峰
王菲 张艳珍 毛海峰

摘 要:以柠条花为原料,采用溶剂法提取柠条花中的总生物碱。在单因素试验的基础上,通过L9(34)正交试验确定出最佳提取工艺条件。结果表明:最佳工艺为提取时间1h、料液比1∶15、乙醇浓度90%、提取温度70℃。在此条件下,柠条花中总生物碱的得率为4.039%。
关键词:柠条花;提取工艺;生物碱;得率
柠条(锦鸡儿)主要分布于内蒙古、甘肃、宁夏、青海等地。柠条花富含粗脂肪、粗纤维、碳水化合物、总黄酮、生物碱、多酚等。其中,生物碱具有抗菌、降血糖、抗肿瘤、抗心律失常、抗血小板聚集等活性,是许多药用植物的有效成分[1-4]。目前从断肠草、苦豆子等植物中提取出总生物碱[5-19],汤俊等[20-21]从蛽壳花椒中提取和分离出9种化合物,有5种为已知生物碱。大部分游离的生物碱及其盐类都能溶于甲醇和乙醇,虽然甲醇在沸点、溶解性等方面较乙醇有优势,但其对视神经的毒性很大,所以实验室多用乙醇作为生物碱的提取溶剂[22]。目前生物碱的含量测定方法较多,如高效液相色谱法、紫外分光光度法、紫外薄层层析法、滴定法、重量法和酸性染料比色法等,但是重量法和滴定法均需多次萃取易造成误差而导致重现性差[23],高效液相色谱法则有操作繁琐、耗费大等不足,而本试验建立的酸性染料比色法测定檸条花中生物碱含量的方法,灵敏度高,操作简单,重现性好,更适用于总生物碱的含量测定[24-25]。
1 材料与方法
1.1 材料与试剂
柠条花,购于青海省西宁市;盐酸小檗碱对照品,中国药品生物制品检定所;溴甲酚绿,天津市白世化工有限公司;枸橼酸,分析纯,天津市光复科技发展有限公司;磷酸氢二钠,分析纯,天津市红岩化学试剂厂;甲醇,色谱纯,天津市白世化工有限公司;盐酸,分析纯;氢氧化钠,分析纯;水为蒸馏水;氯仿,分析纯;乙醇为90%。
1.2 设备
DK-8D型电数显水浴锅,金坛市盛威实验仪器厂;TU-1800spc型紫外可见分光光度计,北京普析通用仪器有限责任公司;BS224S型电子分析天平,赛多利斯科学仪器有限公司;PH211型pH计,北京哈纳科仪科技公司。
1.3 方法
1.3.1 生物碱的提取和测定方法
(1)生物碱的提取:①样品前处理:柠条花在60℃条件下烘干,粉碎过40目筛,备用。②供试品溶液的配制:准确称取柠条花样品2.0g于250mL圆底烧瓶中,采用1∶15料液比加入90%乙醇(含0.1%HCL)回流提取1h,同法提取2次,合并滤液,用NaOH溶液调节pH至7.0,过滤收集滤液定容至50mL容量瓶中,备用。
(2)生物碱的测定:①对照品溶液的配制:精密称取盐酸小檗碱标准品,甲醇溶解定容,得到浓度为0.1mg/mL的标准溶液。② 测定波长的选择[22]:精密吸取盐酸小檗碱对照品1mL及样品溶液0.5mL,各加入pH 4.0枸橼酸-磷酸氢二钠缓冲溶液2mL,加入溴甲酚绿溶液1.5mL、氯仿10mL,振摇3min,静置0.5h后分取氯仿液,另取枸橼酸-磷酸氢二钠缓冲液2mL同法操作所得氯仿液作为空白。分别在300~700nm进行扫描。结果表明,对照品溶液和供试品溶液均在416nm处有稳定的最大吸收,空白液则无吸收,故选择416nm为测定波长。
(3)比色条件的选择[22]:①缓冲液pH的选择:精密吸取供试品溶液0.5mL和对照品1mL各5份,分别加入pH 3.6、4.0、4.4、4.8、5.2的枸橼酸-磷酸氢二钠缓冲溶液2mL,再加入pH 3.6、4.0、4.4、4.8、5.2的枸橼酸-磷酸氢二钠缓冲溶液配制的溴甲酚绿溶液1.5mL,其余按照2.3.2项下同法操作,在416nm处测定吸光度,结果表明,供试品和对照品在pH 4.0的缓冲液中吸光值最大,故选用pH 4.0缓冲液。②酸性染料用量的选择:精密吸取对照品溶液2mL,挥干甲醇,分别加入pH 4.0枸橼酸-磷酸氢二钠缓冲液配制的溴甲酚绿溶液1、1.5、2、2.5、3mL,其余按照2.3.2项下同法操作,结果表明,当溴甲酚绿溶液加入量为1.5mL时吸收度最大,故选用溴甲酚绿溶液的加入量为1.5mL。
(4)标准曲线绘制[22-24]:精密吸取盐酸小檗碱标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4mL于具塞试管中,挥干甲醇,各加入pH 4.0的枸橼酸-磷酸氢二钠缓冲溶液2mL,溴甲酚绿溶液1.5mL,10mL氯仿溶液萃取,取氯仿层。氯仿溶液作为空白,在波长416nm处测定吸光度,将所得吸光度(A)和盐酸小檗碱含量(m)作图,绘制标准曲线,得回归方程:Y=4.909 1X-0.001 6(r=0.999 2)。
(5)生物碱得率的测定:将待测样品按情况准确稀释一定的倍数,使溶液浓度在标准曲线线性范围内,同标准曲线操作,测定吸光度,根据回归方程算出柠条花中生物碱的浓度及得率。
1.3.2 单因素试验 分别以乙醇浓度、提取时间、料液比、提取温度及提取次数为考察因素,以生物碱得率为指标,选择单一因素下生物碱的最佳提取条件。
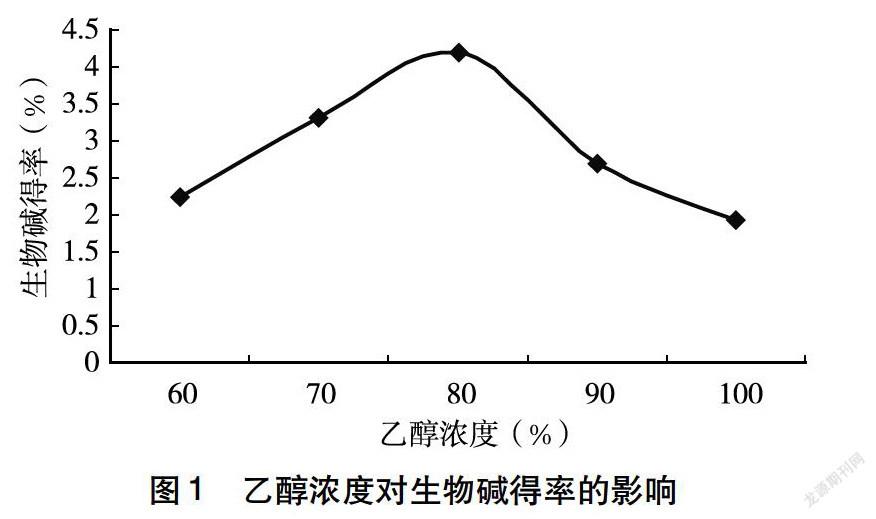
(1)乙醇浓度对生物碱得率的影响:称取2.0g柠条花样品,在提取时间1h、提取温度50℃、料液比1∶15、提取次数2次,乙醇浓度分别为60%、70%、80%、90%、100%的条件下进行水浴提取,过滤合并提取液,用NaOH溶液调节pH至7.0,收集滤液定容于100mL容量瓶中。按照生物碱得率的测定方法测定吸光度A,计算生物碱得率。
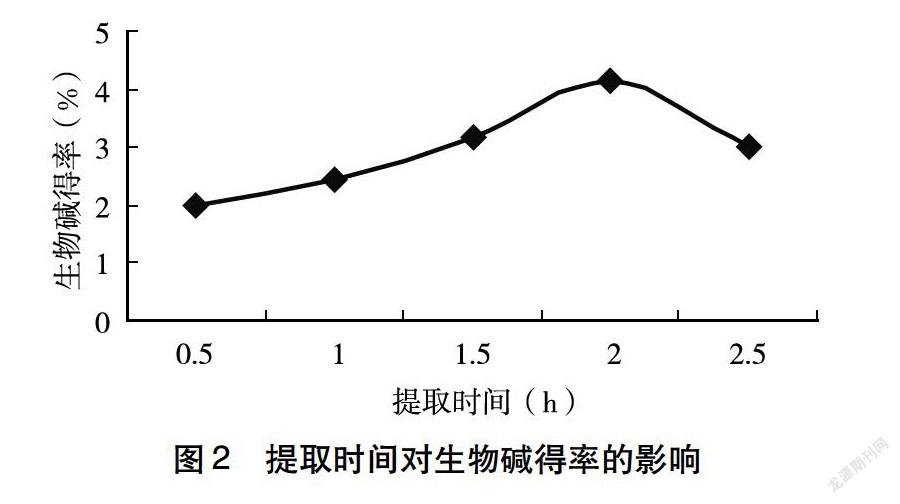
(2)提取时间对生物碱得率的影响:称取2.0g柠条花样品,在乙醇浓度60%、提取温度50℃、料液比1∶15、提取次数2次,提取时间分别为0.5、1、1.5、2、2.5h的条件下进行水浴提取,过滤合并提取液,用NaOH溶液调节pH至7.0,收集滤液定容于100mL容量瓶中。按照生物碱得率的测定方法测定吸光度A,计算生物碱得率。
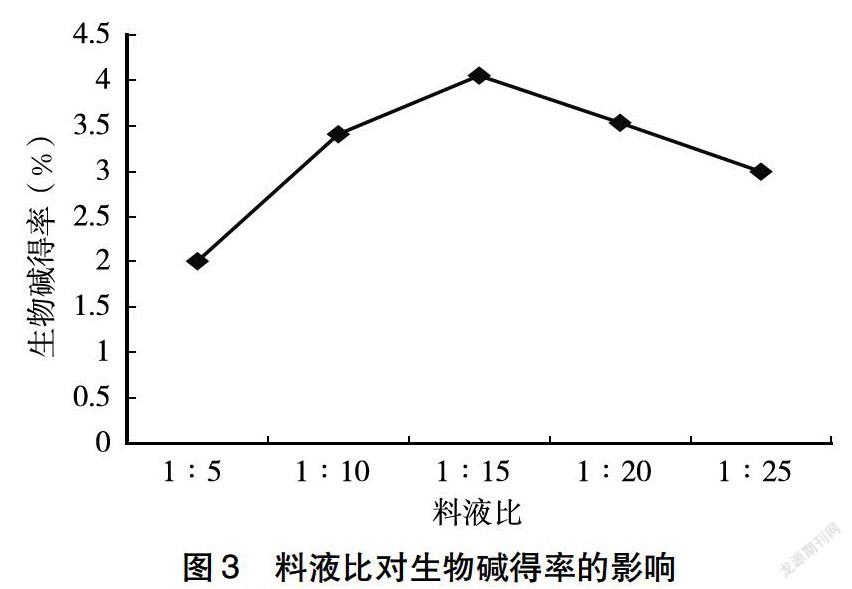
(3)料液比对生物碱得率的影响:称取2.0g柠条花样品,在乙醇浓度60%、提取温度50℃、提取时间1h、提取次数2次,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25的条件下进行水浴提取,过滤合并提取液,用NaOH溶液调节pH至7.0,收集滤液定容于100mL容量瓶中。按照生物碱得率的测定方法测定吸光度A,计算生物碱得率。
(4)提取温度对生物碱得率的影响:称取2.0g柠条花样品,在乙醇浓度60%、料液比1∶15、提取时间1h、提取次数2次,提取温度分别为30、40、50、60、70℃的条件下进行水浴提取,过滤合并提取液,用NaOH溶液调节pH至7.0,收集滤液定容于100mL容量瓶中。按照生物碱得率的测定方法测定吸光度A,计算生物碱得率。
(5)提取次数对生物碱得率的影响:称取2.0g柠条花样品,在乙醇浓度60%、料液比1∶15、提取时间1h、提取温度50℃,提取次数分别为1、2、3、4次的条件下进行水浴提取,过滤合并提取液,用NaOH溶液调节pH至7.0,收集滤液定容于100mL容量瓶中。按照生物碱得率的测定方法测定吸光度A,计算生物碱得率。
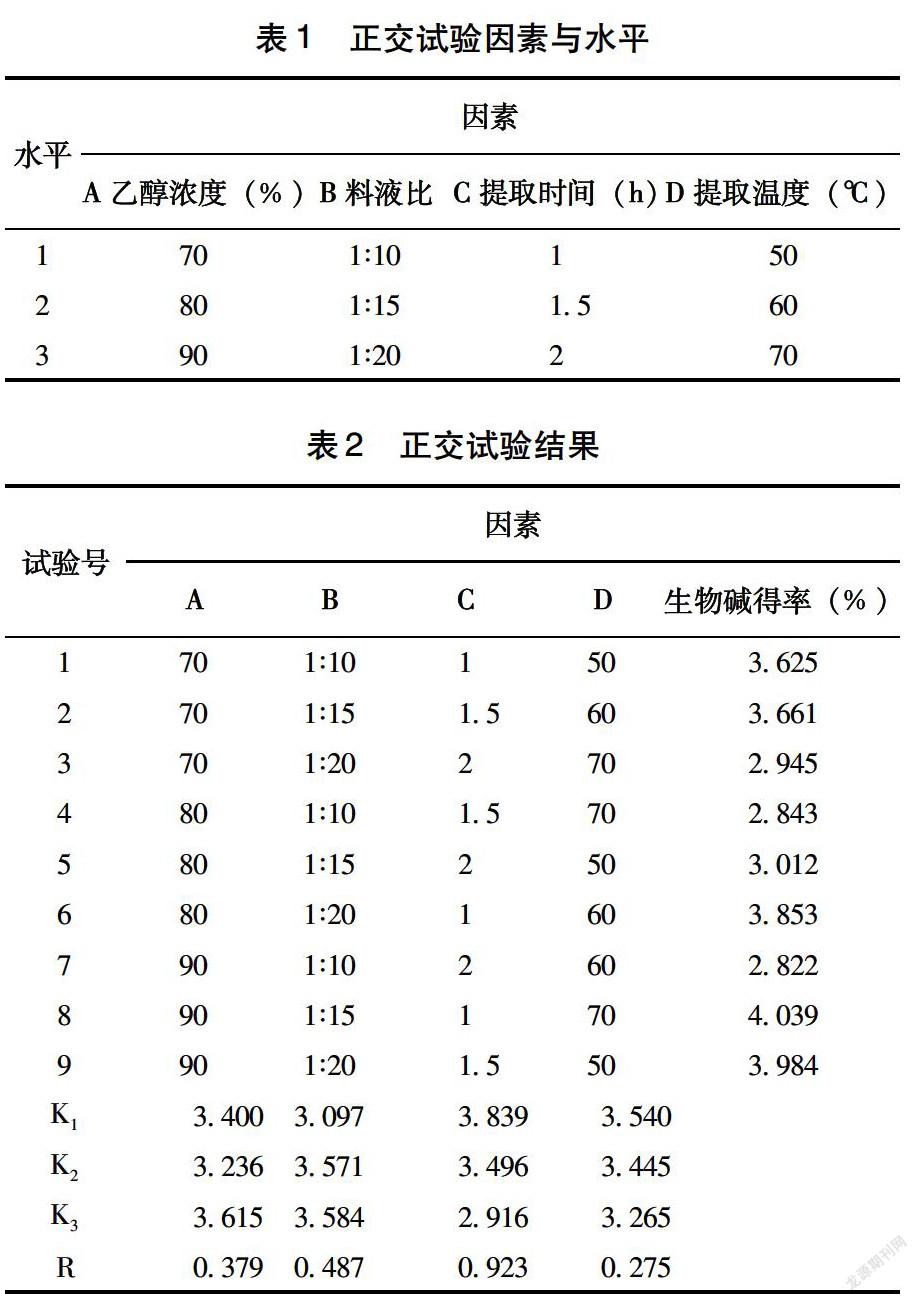
1.3.3 正交试验 在单因素试验的基础上,分别以乙醇浓度(A)、料液比(B)、提取時间(C)、提取温度(D)为考察因素,根据正交设计原理,以生物碱得率为指标,进行L9(34)正交试验。
2 结果与分析
2.1 单因素试验
2.1.1 乙醇浓度对生物碱得率的影响 由图1可知,柠条花中生物碱的得率随乙醇浓度的增大,呈现先上升后逐渐下降的趋势。当乙醇浓度为80%时,柠条花中生物碱得率最高。当乙醇浓度高于80%时,柠条花中生物碱的得率逐渐下降,故选择提取生物碱的最佳提取溶剂浓度为80%。
2.1.2 提取时间对生物碱得率的影响 由图2可知,柠条花中生物碱的得率随提取时间的增大,呈现先上升后逐渐下降的趋势。当提取时间为2h时,柠条花中生物碱得率最高。当提取时间大于2h时,柠条花中生物碱的得率逐渐下降,故选择提取生物碱的最佳提取时间为2h。
2.1.3 料液比对生物碱得率的影响 由图3可知,柠条花中生物碱的得率随料液比的增大,呈现先上升后逐渐下降的趋势。当料液比为1∶15时,柠条花中生物碱得率最高。当料液比大于1∶15时,柠条花中生物碱的得率逐渐下降,故选择提取生物碱的最佳料液比为1∶15。
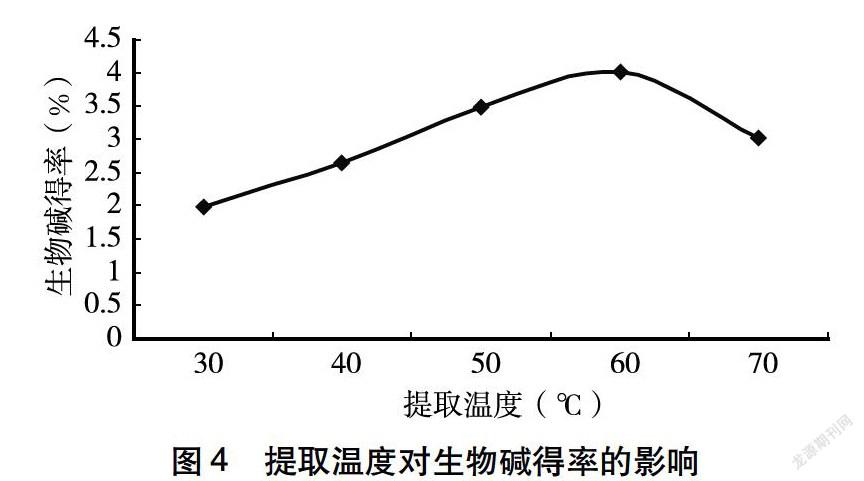
2.1.4 提取温度对生物碱得率的影响 由图4可知,柠条花中生物碱的得率随提取温度的升高,呈现先上升后逐渐下降的趋势。当提取温度为60℃时,柠条花中生物碱得率最高。当提取温度高于60℃时,柠条花中生物碱的得率逐渐下降,原因可能是由于温度过高,破坏了生物碱的结构,导致生物碱得率下降,故选择提取生物碱的最佳提取温度为60℃。
2.1.5 提取次数对生物碱得率的影响 由图5可知,柠条花中生物碱的得率随提取次数的增加,呈现先上升后逐渐下降的趋势。当提取次数为2次时,柠条花中生物碱得率最高。当提取次数大于2次时,柠条花中生物碱的得率逐渐下降,故选择提取生物碱的最佳提取次数为2次。
2.2 正交试验
由表1~2可知,极差大小变化为C>B>A>D,说明提取时间的改变对生物碱的提取影响最大,其次是料液比,各因素最佳水平组合为C1B2A3D3,确定最佳提取工艺为提取时间1h、料液比1∶15、乙醇浓度90%、提取温度70℃。
3 结论
根据单因素试验和正交试验结果得知,提取时间对生物碱的提取影响最大,提取温度对生物碱的提取影响最小。柠条花中总生物碱的提取工艺最佳条件为提取时间1h、料液比1∶15、乙醇浓度90%、提取温度70℃,生物碱的得率可以达到4.039%。
参考文献
[1]Kitajima M,Nakamura T,Kongure N,et al.Isolation of gelsedinetype indole alkaloids from gelsemium elegans and evaluation of the cytotoxic activity of gelscmium alkaloids for A431 epidermoid earcinoma cells[J].J Nat Prod,2006,69(4):715-718.
[2]李杨,左国营.生物碱类化合物抗菌活性研究进展[J].中草药,2010,41(6):1006-1014.
[3]潘琳琳,孙墨珑.兴安杜鹃叶总生物碱提取及其生物活性[J].福建农业学报,2016,31(3):255-259.
[4]Bezerra D P,Castro F O,Alves A,et a1.In vivo growth—inhibition of sarcomal 180 by piplartine and pipefine,two alkaloid amides from Piper[J].Brazilian Journal of Medical and Biological Research,2006,39(6):801-807.
[5]陈建生.木醇法对中药生物碱成分提取效果的比较[J].中成药,1989,11(9):56.
[6]迟玉明,赵唏璞,言緙丰言.角离总生物碱提取工艺的研究[J].天然产物研究与开发,2005,17(4):475-177.
[7]张忠良,王照利,樊万兴.魔芋中总生物碱提取试验[J].食品工业科技,2004,25(9):101-103.
[8]许瑞波,王芳,刘玮,等.总生物碱的酸碱提取工艺[J].食品与发醇工业,2006,8(32):135-138.
[9]米海藕,张曦燕,李越餛,等.牛心朴子生物碱提取及精致方法研究初报[J].中国农学通报,2006,6(22):464-467.
[10]董亮,赵长心,窦少华,等.苦豆子生物碱生产工艺优化[J].大连轻工业学院学报,2005,4(24):266.
[11]龙清,刘传银,谢茂军.酸性酢提取芋中的总生物碱[J].食品科技,2003(8):21-23.
[12]郭安.氧化苦参碱提取醇化工艺研究[J].云南中医学院学报,2006,29(3):9-11.
[13]甄繼,杨风珍.吴茱萸总生物碱提取条件研究[J].分析仪器,2000(2):27-29.
[14]郭金玲,高俊,高智,等.牛心朴子草中总生物碱的提取研究[J].内蒙古工业大学学报,2004,23(3)172-174.
[15]喻朝阳,王晓琳.生物碱提取与应用进展[J].化工进展,2006,25(3):259-263.
[16]王栋,刘岩,孪红披.正交實验法忧选北豆根总生物碱的提取工艺[J].哈尔滨商业大学学报,2005,21(1):19-21.
[17]曾建红,彭正松.不同采收期半夏生物碱含量的变化规律[J].中南林学院学报,2004,24(4):109-110.
[18]张丽,刘萌,寿钥,等.比色法测定顛茄合剂中茛菪类生物碱的含量[J].海峡药学,2005,17(2):76-77.
[19]Kitajima M,Nakamura T,Kongure N,et al.Isolstion of gelsedinetype indole alkaloids from gelsemium elegans and evaluation of the cytotoxic activity of gelsemium alkaloids for A431 epidermoid carcinoma cells[J].J Nat Prod,2006,69(4):715-718.
[20]汤俊,朱卫,屠治本.蚬壳花银化学成分的研究[J].中草药,1995,11(23):563-565.
[21]Tang Jun,Supinya Tewtrnkul,Wang Zheng-tao,et al. Aurantiamide acetate from stems of Zanthorylum dissitum[J].Journal of Chinese Pharmaceurical Sciences,2003,12(4):231.
[22]李永芳.生物碱的提取和分离方法综述[J].中山大学研究生学刊(自然科学、医学版),2015,36(2):7-13.
[23]杨丹,李军,解世全,等.酸性染料比色法测定天仙子及其炮制品总生物碱含量[J].中国医药导刊,2009,11(3):479-482.
[24]徐国良,熊友文,孙立波,等.酸性染料比色法测定黄连中生物碱的含量[J].江西中医学院学报,2010,22(4):32-34.
[25]Yan Dan,Xiao he,Jin Cheng,et al.Microcalorimetric investigation of the effect of berberine alkaloids from,Coptischinensis Franch on Staohylococcus aureus growth[J].Science in China,2008,51(7):640-645.
Abstract:The total alkaloids in caragana were extracted by solvent method.On the basis of single factor,the best extraction technology conditions were determined through L9(34)orthogonal test.The study suggested that the best process was after being extracted time 1 h,and solid-liquid ratio 1∶15,90% ethanol concentration,extraction temperature 70 ℃.Under these conditions,the percentage of total alkaloids in caragana was 4.039%.
Keywords:Caragana korshinskii flower;extracting process;alkaloid;yield
(责任编辑 唐建敏)