一株根际解磷菌的筛选鉴定及溶磷促生作用
2022-08-15范延辉李学平张玉苗许骥坤
王 君,范延辉,尚 帅,李学平,张玉苗,吴 涛,许骥坤
(滨州学院生物与环境工程学院,山东省黄河三角洲脆弱生态带工程技术研究中心,山东省黄河三角洲生态环境重点实验室,山东 滨州 256600)
磷是植物体内有机化合物的重要组成成分,是限制植物生长且不可代替的第二大营养元素。土壤中的总磷含量为0.04%~0.10%(w/w),其中只有极少量的可溶性磷()能被植物利用[1-2]。磷的缺乏是影响作物产量和分布的一个重要因素[3]。施加磷肥是提高土壤磷素供给最为有效的途径。然而,由于土壤中金属离子的固定作用,施入土壤的磷有70%以上与Ca2+、Al3+、Fe3+、Fe2+等离子结合转化为难溶磷,难以被植物吸收利用[4]。我国是人口大国,为了保障粮食安全,通常会过量施加磷肥以提高作物产量,导致磷矿资源的消费量逐年提高。按现有的年消费量,我国磷矿的使用年限不足20年[5]。另外,土壤中大量未充分利用的磷素很容易流失到环境中,造成水体富营养化等环境问题。提高土壤磷素利用率,减少磷肥使用量,不仅是持续高产的需要,也是节约磷资源、减少环境污染的迫切需求[6]。
解磷或溶磷微生物能够将植物难以利用的磷转化或活化为有效态磷[7-8]。自1903年Stalstrom[9]从土壤中成功分离到解磷细菌以来,世界各国相继开展了相关研究[10-11],其中很多菌株在活化土壤中难溶性磷、提高作物产量方面效果显著[12-16],有的已经商品化生产[17]。溶磷微生物主要通过产生有机酸、质子和酶类来活化难溶磷。筛选高效解磷菌株,进而研制生物肥料制剂已经成为一种高效、环保、经济的活化土壤磷素的生物措施。
黄河三角洲是我国三大三角洲之一,总面积达5.4×105hm2,其中70%以上为盐碱地,并且仍在以每年1.3×105hm2的速度增加[18]。对该地区的低产盐碱农田进行改良和培肥增效,对于缓解我国耕地紧缺、保障农产品的有效供给具有重要意义。虽然已有很多的溶磷微生物被筛选和鉴定,但它们大多分离自非盐碱化环境,难以在盐碱化土壤中定殖进而发挥其解磷作用[19]。近年来,耐盐溶磷微生物的研究受到农业生产的高度重视[20]。研究表明,盐碱化土壤是分离耐盐解磷菌的主要来源,从中分离出的解磷菌对该生境下难溶磷的转化有更好的应用潜力[4,21]。本研究从黄河三角洲地区农作物根际采集土样,旨在从中筛选出耐盐解磷菌,并对菌株的解磷能力和对盐碱化土壤有效磷含量提高情况进行研究,为开发适用于黄河三角洲地区盐碱化土壤的生物肥料提供菌种资源。
1 材料与方法
1.1 土壤来源
从黄河三角洲地区盐碱农田采集玉米、小麦、苜蓿、棉花、花生根际土壤样品 30份。采样时选取长势健壮的植株收集根际土,将植株的根小心挖出,抖去和根系结合松散的土壤,留下与根系结合紧密的土壤作为根际土。将采集的根际土壤装入无菌袋中,在冷藏条件下带回实验室,置于4℃冰箱保藏。
1.2 培养基和磷源
无机磷培养基(g/L):葡萄糖10 g,Ca3(PO4)25 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,MgSO4·7H2O 0.1 g,酵母提取物0.5 g,MnSO4·H2O 0.001 g,FeSO4·7H2O 0.001 g,蒸馏水1000 mL,琼脂 18 g,pH 7.0~7.5,115 ℃ 灭菌30 min。
LB培养基(g/L):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH 7.0,琼脂 18 g,121℃灭菌30 min。
供试磷源:AlPO4由生工生物工程有限公司提供,FePO4由生工生物工程有限公司提供,磷矿粉由泰州市长浦化学试剂有限公司提供。
1.3 溶磷菌的分离初筛
取新鲜根际土样1 g,用0.85%的生理盐水进行系列梯度稀释,然后分别吸取10-4、10-5、10-63个梯度的土壤悬液200 μL涂布至PVK平板上,置于恒温培养箱30 ℃倒置培养24~48 h,挑选出有溶磷圈的菌落,在LB平板上反复划线纯化并编号后于4 ℃保藏。
1.4 溶磷菌溶磷能力测定
1.4.1 基于平板法的菌株溶磷效果测定
将初筛获得的解磷菌经LB培养活化后,用接种环涂布于含Ca3(PO4)2的PVK平板中央,30 ℃培养2~3 d后,测定溶磷圈直径(D)和菌落直径(d),以D/d值来初步确定菌株的溶磷能力,每组试验设3个重复。
1.4.2 基于钼锑抗比色法的菌株溶磷效果测定
磷标准曲线的绘制:称取磷酸二氢钾配置成100 mg/L的磷标准贮备液,置于棕色试剂瓶中备用。测定前吸取5 mL磷标准贮备液于100 mL容量瓶中,用蒸馏水定容制成5 mg/L的磷标准使用液。分别吸取0、1、2、3、4、5、6 mL磷标准使用液于7个50 mL的容量瓶中,加蒸馏水至15~20 mL左右,再加入1滴2,4-二硝基酚指示剂,然后逐滴加入硫酸溶液调至溶液近无色,加入0.75 mL抗坏血酸溶液,混匀,30 s后加5 mL钼酸盐溶液,用水定容至50 mL,混匀。室温下放置30 min后用10 nm比色皿在700 nm波长下比色,以去离子水为参比,分别测量吸光度。以试剂空白校正吸光度为纵坐标,对应的磷浓度为横坐标,绘制磷标准曲线。此标准系列中磷浓度依次为0、0.1、0.2、0.3、0.4、0.5、0.6 mg/L。
从保藏斜面上刮取1环菌苔于LB液体中培养,30 ℃培养24 h后作为种子液,按1% (v/v)的比例,将种子液接种于装有50 mL PVK液体培养基的锥形瓶(150 mL)中,对照组接入等体积灭菌后的种子液,30 ℃、150 r/min振荡培养3 d,然后将培养液于8000 r/min离心10 min,取上清液测定pH值及有效磷含量。
1.5 菌株B19的微生物学鉴定
1.5.1 形态学特征及生理生化特性
在LB固体培养基上划线接种,30 ℃恒温培养24 h,观察菌株的生长情况及菌落特征;挑取单菌落置于洁净玻片上,革兰氏染色后,光学显微镜下观察细胞形态及染色情况。生理生化特性参照《常用细菌系统鉴定手册》[22]进行。
1.5.2 基于l6S rDNA基因序列测定的系统发育分析
采用细菌总DNA提取试剂提取菌株基因组DNA。用 细 菌l6S rDNA通 用 引 物(27f:5’-AGAGT TTGATCCTGGCTCAG-3’和1492r:5’-GGTTACCTTGTTACGACTT-3’)进行扩增。反应条件为:94 ℃ 5 min,94 ℃ 30 s,55℃ 30 s,72 ℃1 min,共30个循环,最后72℃延伸10 min。PCR产物用l%琼脂糖凝胶电泳检测,Bio-RAD凝胶成像仪成像观察电泳结果。PCR产物由生工生物工程(上海)股份有限公司进行测序,PCR产物测序后用BLAST进行相似性搜索和同源性比对,采用Clustal X2.0进行序列比对分析,得到序列之间的相似值,通过MEGA 6.0的邻接法构建系统发育树进行分析。
1.6 菌株B19的耐盐性
配置不同盐浓度(0%、2%、4%、6%、8%)的LB液体培养基,接种量为1%,30 ℃ 150 r/min振荡培养,间隔一定时间取样,于660 nm波长处测定吸光度。
1.7 菌株B19对难溶性磷酸盐的溶磷能力
将PVK中的Ca3(PO4)2分别换成AlPO4、FePO4和磷矿粉(加入量均为5 g/L),以考察菌株B19对难溶性磷酸盐的溶解能力,按照1.4.2中的方法进行培养和溶磷能力测定。
1.8 B19菌对土壤中有效磷含量作用效果研究
试验用土为中度盐碱化土壤,取自黄河三角洲沾化地区,土壤取自耕层(0~20 cm),基本性质见表1,土壤经室温晾干过2 mm筛并于121℃灭菌30 min后备用。

表1 供试的土壤化学性质
土壤培养试验参照Chen等[23]的方法进行:将菌株B19在LB液体培养基中于30 ℃培养12 h,10000 r/min离心10 min收集菌体,菌体沉淀用无菌水洗涤2遍后,用无菌蒸馏水重悬,制成107CFU/mL的菌悬液备用。试验在塑料盆(15 cm×14 cm×11 cm)中进行,每盆装土壤3 kg,加入B19菌液(浓度为107CFU/mL)300 mL,充分混匀。对照组加入300 mL的无菌水。试验在25℃下进行,试验期间定期补加无菌水,使土壤湿度保持在30%左右,每组试验设3个重复。每隔5 d取土样,风干后过2 mm筛,加入碳酸氢钠提取剂,振荡,过滤,吸取5.00~10.00 mL滤液,加入钼锑抗显色剂,轻轻摇动排出CO2后加水定容至50 mL,室温下放置30 min后在880 nm波长下比色,计算出土样中有效磷的含量。
1.9 小麦盆栽试验
为了研究解磷菌对植物生长的影响,进行小麦盆栽试验。试验在温室中进行,供试盐碱土壤同1.8。将菌株B19在LB液体培养基中于30℃培养12 h,10000 r/min离心10 min收集菌体,菌体沉淀用无菌水洗涤2遍后,用无菌蒸馏水重悬,制成107CFU/mL的菌悬液备用。试验在塑料盆(15 cm×14 cm×11 cm)中进行,每盆装经2 mm过筛的供试土壤3 kg,基肥(氮、磷、钾)施加量参照杨玉敏等[24]的报道进行,N、P2O5、K2O施用量分别为0.20、0.15、0.15 g/kg,分别为分析纯的尿素、磷酸钙和氯化钾。按表2设计要求将基肥和B19菌液加入土壤,充分混匀后,装入塑料盆加水至田间持水量的60%。挑取饱满的小麦种子(济麦22),用5%的NaClO消毒5 min,无菌水冲洗并浸泡8 h,然后用潮纱布包好静置一晚后播种,每盆15粒,每个处理10盆。试验期间重量法补水,保持土壤含水量为田间持水量的60%左右。培养30 d后,从各处理中随机抽取25株幼苗,洗净吸干水分测定幼苗株高、根系长度和整株鲜重和根鲜重。

表2 盆栽试验施肥方案
2 结果与分析
2.1 根际溶磷菌的筛选
采用透明圈法从根际土样中筛选到溶磷细菌27株,它们在含有磷酸钙的培养基上的D/d值范围在1.06 ~ 3.18之间(图1),菌株B19的溶磷圈见图2。通过钼锑抗比色法测定液体培养过程中的有效磷含量。根据磷标准液的测定结果绘制溶磷曲线图,获得y = 0.4407x - 0.0175(R=0.9651)的磷标准曲线。在此基础上,对发酵液的有效磷含量进行测定。27株溶磷菌液体培养时有效磷含量在30.4 ~ 230.2 mg/L之间。其中菌株B19(分离自小麦根际)和B22(分离自玉米根际)对磷酸钙的溶解能力最强,分别达到230.2和225.0 mg/L。B19经多次传代后溶磷水平稳定,且生长繁殖速度更快,故做进一步研究。
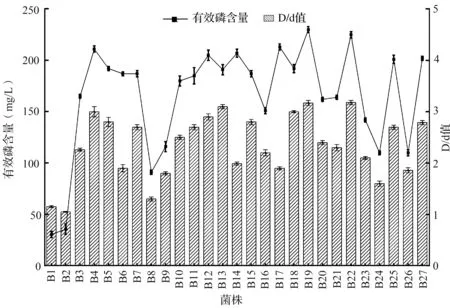
图1 各菌株的溶磷能力
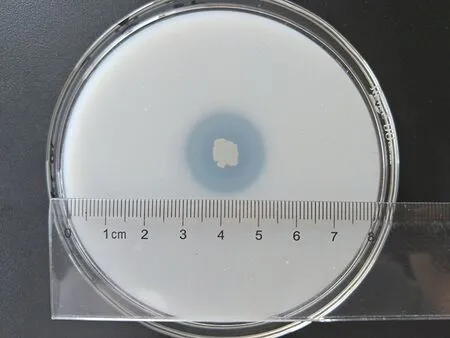
图2 菌株B19在PVK固体培养基上产生的溶磷圈
菌株B19在PVK无机磷液体培养基中培养时,发酵液的pH值快速下降,第1 d测到的pH值最低,为3.71,之后略有回升并稳定在4.25左右。培养液中有效磷磷含量在第3 d最高,达230.2 mg/L。对照组中的pH值和有效磷含量一直维持在初始水平(图3)。

图3 菌株B19液体培养时有效磷含量和pH值的变化
2.2 菌种鉴定
2.2.1 形态学特征
菌株B19为革兰氏阴性,细胞呈短杆状,无芽孢,在LB培养基上培养24 h后,菌落呈淡黄色,表面湿润,呈圆形,边缘整齐,易挑取。
2.2.2 生理生化特性
菌株主要生理生化特性见表3,根据《常用细菌系统鉴定手册》[22]可初步判断该菌属于泛菌属(Pantoeasp.)。
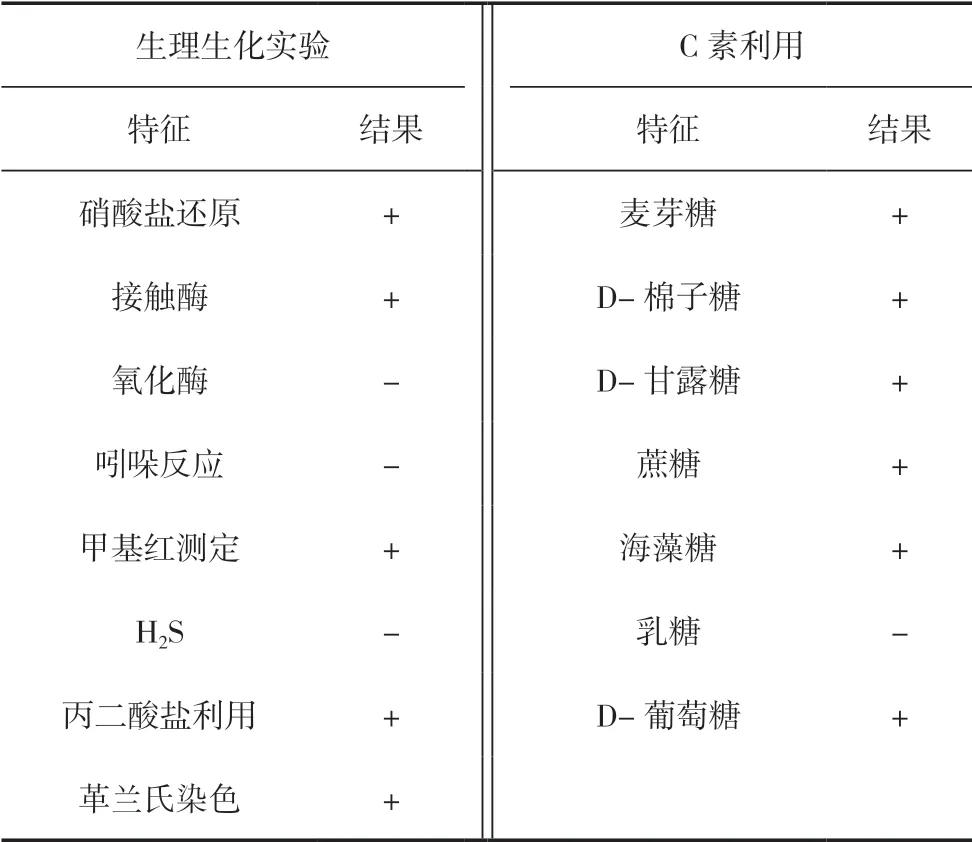
表3 菌株B19的生理生化特性
2.3 l6S rDNA基因系统发育分析
经PCR扩增后菌株B19的16S rDNA序列全长为1476 bp,将该序列提交GenBank 数据库(登录号为KJ957935)进行BLAST比对分析,利用MEGA6.0构建系统进化树,结果如图4所示。BLAST分析结果显示该序列与泛菌属(Pantoeaspp.)的16S rDNA序列具有很高的同源性,其中与菌 株Pantoeasp.strain CP4D7-04(MK534079.1)、Pantoea cypripediistrain DSM 3873(NR_041973.1)、Pantoeasp.strain CP4V2-03(MK534086.1)、Pectobacterium cypripediistrain B1(JF430157.1)的16S rDNA序列相似性均为99%,综合形态学特征及生理生化特性,鉴定菌株B19为杓兰泛菌,即Pantoea cypripediiB19。

图4 基于菌株B19 l6S rDNA基因序列的系统发育树
2.4 菌株B19的耐盐性
耐盐性试验结果如图5所示,菌株B19具有较强的耐盐性,在0%~4%的NaCl范围内生长良好。当NaCl浓度为6%时,OD660值增加不明显,说明菌株生长受到了强烈抑制;NaCl浓度为8%时OD660没有增长,说明菌株生长受到了完全抑制(图6)。

图5 不同处理下小麦幼苗的生长
2.5 菌株B19对难溶性磷酸盐的溶解能力
在AlPO4、FePO4、磷矿粉为磷源的PVK液体培养基中30℃培养5 d后,测得的有效磷含量分别为72.1、153.2、28.5 mg/L(表4)。

图6 B19在不同盐浓度下的生长情况

表4 B19对难溶性磷酸盐的溶解能力 (mg/L)
2.6 菌株B19在土壤中的溶磷能力
为了确定菌株B19在盐碱化环境中的应用潜力,对B19进行了盐碱化土壤溶磷效果的研究。土壤有效磷含量测定结果表明,在30 d的测定期内,与CK相比,施加B19后土壤有效磷含量均有不同程度地提高。第10 d土壤有效磷含量最高,由27.88 mg/kg增至37.98 mg/kg,比未接菌的对照组增加了36.2%(图7)。
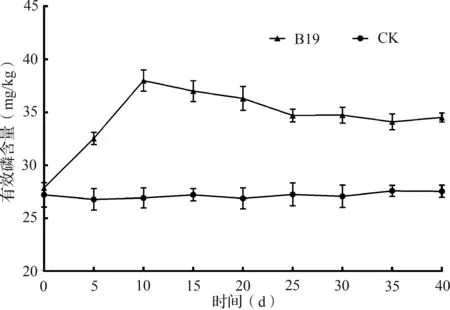
图7 菌株B19对盐碱土壤中有效磷的影响
2.7 溶磷菌对盆栽小麦生长的影响
小麦盆栽试验结果如图5和表5所示。施加B19溶磷菌的小麦幼苗在生长至第30 d时,其株高、根长、株鲜重和根鲜重均显著高于对照(P<0.05),株高增加了6.95 cm,提高了61.34%;根长增加了2.66 cm,提高了38.27%;株鲜重增加了0.043 g,提高了29.45%;根鲜重增加了0.022 g,提高了84.62%。以上结果说明菌株B19对小麦幼苗的生长有很好的促进作用。
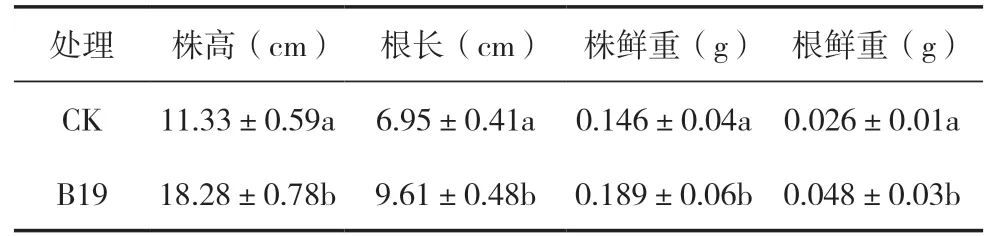
表5 不同处理下小麦的生长情况
3 讨论
3.1 溶磷菌B19的分离鉴定
土壤盐碱化会引起土壤板结、肥力下降,是限制农作物生长的主要障碍因素之一。受气候、水文地质条件、海水入侵等因素的影响,黄河三角洲地区盐渍化程度十分严重,有些区域盐度含量高达3%,pH值超过10,较高的盐度和pH值使得一般的溶磷菌很难存活和定殖。国内外已有少量耐盐溶磷菌的研究报道,主要包括青霉菌、木霉菌和疣孢蓝状菌等真菌[4,25-26],有关溶磷细菌及其在盐碱地肥力提升方面的研究却鲜有报道[27]。根际是受根系分泌物影响的土壤狭窄区域,富集于根际的微生物群落复杂多样,有“植物的第二基因组”之称,与植物的生长和健康密切相关,近年来报道的溶磷菌多数分离自植物根际[11]。本研究从黄河三角洲盐碱化根际土壤中筛选获得27株溶磷细菌,其中菌株B19分离自小麦根际,经鉴定为杓兰泛菌(Pantoea cypripedii)。
3.2 Pantoea cypripedii B19的溶磷特性
受土壤母质和成土过程的影响[28],黄河三角洲地区盐碱化土壤中的磷素主要以无机磷形态存在,占全磷含量的比例为55.95%~76.35%[29],其中Ca-P是主要成分[30]。故本试验中选取Ca3(PO4)2为难溶性磷源,通过固体培养和液体培养法对溶磷菌进行了筛选。透明圈法是初筛溶磷菌的通用方法,从试验结果来看,D/d值的大小基本上反映了菌株的溶磷能力;从测定结果来看,D/d值大的菌株,其在液体培养时表现出高的有效磷含量;总体来看,D/d值越大,有效磷含量越高。值得注意的是,菌株F6、F14和F17在固体培养时D/d值不高(分别为1.89、1.99和1.90),但在液体培养时却显示出很高的溶磷能力(分别为187、207和213 mg/L),这说明培养条件对菌株的溶磷能力有很大的影响,相较于固体培养,摇瓶培养条件下更利于它们的生长代谢,进而活化难溶性磷。另外,菌株B19的D/d值为3.17,仅次于菌株F22(3.18),但其在液体培养时的溶磷能力稍高一些(菌株B19为230.2 mg/L,菌株F22为225.0 mg/L),而且菌株B19有更好的遗传稳定性,因此选定其进行深入研究。虽然透明圈是通用的溶磷菌初筛方法,但很多溶磷菌并不产溶磷圈。叶劲松等[31]获得了一株解磷菌,其在PVK固体平板不产透明圈,但在摇瓶培养时表现出很强的溶磷能力,说明采用不同方法筛选和确定溶磷菌的必要性。
已报道的解磷细菌数量众多,主要包括芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、固氮菌属(Azotobacter)、节杆菌属(Arthrobacter)、假单胞菌属(pseudomonas)等类群[11]。研究发现,不同的菌株之间溶磷能力相差很大,迄今报道的溶磷能力较强的细菌为节杆菌Arthrobactersp.CCBC03,其摇瓶培养3 d时有效磷含量达519.7 mg/L,而分离自同一土样的戈登氏菌Gordoniasp.CCBC07对Ca3(PO4)2的 溶 解 量 仅 为31.5 mg/L[32]。需要指出的是,培养基对菌株的溶磷能力有很大影响,有研究表明,当将PVK培养基换成NBRIP培养基时,溶磷菌的溶磷能力可以提高3倍左右[33]。
泛菌(Pantoeasp.)在自然界分布广泛,其中在水、土壤及植物的种子中最为常见[34]。近年来研究报道有多株泛菌显示出很强的溶磷能力。Kaur等[35]从甜叶菊(Stevia rebaudiana)根际土壤中分离到1株溶磷菌Pantoea cypripediiPSB-3,对Ca3(PO4)2的溶解能力为253 mg/L。田间试验表明,接种PSB-3后,土壤肥力(有机碳、有效磷、总磷和酶活)和作物生长情况(产量和磷吸收)都有了显著提升。Singh等[36]从鹰嘴豆(Cicer arietinumL.)根际土壤中分离到一株溶磷菌Pantoea cypripediiPS1,其对Ca3(PO4)2的溶解能力约为160 mg/L,接种后可显著促进鹰嘴豆的生长。本研究筛选到的杓兰泛菌Pantoea cypripediiB19的溶磷能力为230 mg/L,在已发现的解磷菌中居中等水平。另外,菌株B19对多种其他难溶性磷酸(AlPO4、FePO4、磷矿粉)也显示出了较强的溶解能力,增加了其实际应用的广泛性。
除了菌株自身的遗传特性之外,环境因素,特别是胁迫因子也严重制约着微生物的溶磷能力[37-38]。已报道的溶磷菌多数分离自非盐碱化环境,高盐浓度往往导致溶磷能力的急剧下降[39],不能满足盐碱环境下的需要。相较于普通环境,分离自高盐环境下的微生物在高盐环境仍能保持溶磷能力。Srinivasan等[40]从盐渍化土壤中分离到13株耐盐解磷细菌,其中Aerococcussp.PSBCRG1-1在4.7%NaCl浓度时溶磷量最高,在11.7% NaCl浓度时仍具有很高的溶磷水平。Zhu等[37]从盐池沉积物中分离到一株嗜盐菌Kushneriasp.YCWA18,可以耐受20%的NaCl浓度,在6%的NaCl浓度下生长最快,在最适生长条件下11 d的溶磷量为283.16 μg/mL。本研究Pantoea cypripediiB19最高可耐受6%的NaCl浓度,属中度耐盐菌。当NaCl浓度高于6%时,菌株的生长开始受到抑制,对数生长期生长速率变慢。原因可能是高盐条件下,微生物需要消耗能量来抵御盐胁迫,用于自身生长代谢的能量变少,导致代时变长,细胞增长速率变慢[41]。B19在0%~4%的NaCl浓度范围都有较强的溶磷能力,从耐盐性方面来看,可以满足不同盐碱化环境。
3.3 Pantoea cypripedii B19对盐碱化土壤磷素的活化作用
菌株B19在实验室条件下(固体平板、液体培养)表现出了较强的溶磷能力,但其在土壤中的溶磷效果还有待验证。研究结果显示,施加Pantoea cypripediiB19后,土壤中有效磷含量有了明显提升,在试验初期溶磷上升比较快,第10 d土壤有效磷含量最高,比对照组提高了36.2%。Chen等[23]从木薯根系分离到一株内生解磷菌Pantoea dispersaCav.cy1,可使土壤(红土,pH值=5.89)有效磷含量增加228.73%。本研究中B19对土壤磷素的活化水平不是很高,这可能与盐碱土的理化性质有关,盐碱土壤中含有较高的Ca2+、Al3+[30],对磷有极强的固定作用。孙军娜等[28]研究了黄河三角洲新生湿地由河向海过渡带表层土壤磷形态变化情况,发现在低浓度磷源条件下,随着初始磷浓度的升高,土壤对磷的吸附量增加,吸附率在70%~99%之间。李寿田等[42]发现,即使施加高浓度的外源磷(2.97 g/kg),碱性钙质土对磷的固定率仍高达85.14%。
由于实验室条件与自然环境存在巨大差异,很多在实验室条件下表现高效的溶磷菌,在小区和大田试验中效果并不理想[43-44]。下一步我们将开展田间试验,进一步研究Pantoea cypripediiB19的溶磷和促生效果,为盐碱地生物肥料的开发提供技术支持。
4 结论
从黄河三角洲地区盐碱农田采集根际土壤30份,从中筛选获得27株溶磷细菌。对遗传性状更加稳定的B19菌株做了进一步研究。菌株B19的16S rDNA序列全长为1476 bp,与Pectobacterium cypripediistrain B1(JF430157.1)位于同一分支,序列相似性为99%。综合形态学特征及生理生化特性,确定菌株B19为杓兰泛菌(Pantoea cypripedii)。
菌株Pantoea cypripediiB19在0%~4%的NaCl浓度下生长良好,最高可耐受6%的NaCl浓度,对多种难溶性磷源都有较强的溶解能力。考察了菌株B19对盐碱化土壤磷素的活化情况,施加Pantoea cypripediiB19菌后,土壤中有效磷含量有了明显提升,第10 d土壤有效磷含量最高,比对照组提高了36.2%。盆栽试验结果表明,菌株B19对小麦植株促生效果显著,小麦幼苗平均根长较对照增加了38.27%,平均株高较对照增加了61.34%,说明溶磷菌B19在改善盐碱化土壤肥力方面具有很好的应用潜力。
