枣食芽象甲化学感受蛋白PyasCSP4的基因克隆、表达及配体结合特征
2022-08-13翟颖妍任博文谢毓芬
洪 波, 常 青, 翟颖妍, 任博文, 谢毓芬, 张 锋,*
(1. 陕西省生物农业研究所, 西安 710043; 2. 陕西省林业科学院, 西安 710082)
昆虫的嗅觉系统主要包括气味结合蛋白(odorant binding proteins, OBPs)、化学感受蛋白(chemosensory proteins, CSPs)、气味受体(olfactory receptors, ORs)、味觉受体(gustatory receptors, GRs)、离子型受体(ionotropic receptors, IRs)、感觉神经元膜蛋白(sensory neuron membrane proteins, SNMPs)和气味降解酶(odorant degrading enzymes, ODEs)等(Vosshalletal., 1999; De Bruyne and Baker, 2008; Sánchez-Graciaetal., 2009)。其中,CSPs最初是在黑腹果蝇Drosophilamelanogaster中被鉴定出来的,当时称为OS-D(olfactory specific protein D)(McKennaetal., 1994),直到大量CSPs从沙漠蝗Schistocercagregaria的触角化学感器中被鉴定出之后,开始命名为化学感受蛋白(Angelietal., 1999; Pelosietal., 2018; 周巧玲等, 2021)。近年来,随着高通量测序技术的快速发展,CSPs在鳞翅目、鞘翅目、双翅目、膜翅目等10多个目的昆虫中得到克隆和鉴定(Robertsonetal., 1999; Anderssonetal., 2013; 李慧等, 2018)。在鞘翅目昆虫中,目前已有赤拟谷盗Triboliumcastaneum(Dippeletal., 2014)、华北大黑鳃金龟Holotrichiaoblita(Sunetal., 2014)、沙葱萤叶甲Galerucadaurica(Lietal., 2018)、华山松大小蠹Dendroctonusarmandi(Lietal., 2018)、松墨天牛Monochamusalternatus(Alietal., 2019)、苹果小吉丁虫Agrilusmali(Lietal., 2021)、甘薯小象甲Cylasformicarius(Huaetal., 2021)、沟眶象Eucryptorrhynchusscrobiculatus和臭椿沟眶象Eucryptorrhynchusbrandti(Wangetal., 2021)等多个物种CSPs基因鉴定和蛋白功能的研究报道。
枣食芽象甲Scythropusyasumatsui(异名Pachyrhinusyasumatsui)又称枣飞象,属鞘翅目(Coleoptera)象甲科(Curculionidae),是一种严重危害枣属植物的寡食性害虫,目前广泛分布于我国北方红枣主产区(洪波等, 2017)。近年来,该虫在陕西和山西两省黄河沿岸枣区连年暴发成灾,危害呈加重趋势,而目前对于该虫的防治仍以传统化学农药为主。长期大量化学药剂的使用,导致枣食芽象甲产生抗药性,并对环境和食品安全构成严重威胁(张锋等, 2015; 杨斌等, 2019; 阎雄飞等, 2020)。因此,探索绿色、环保、高效的枣食芽象甲防治技术对实现红枣提质增效、保证红枣产业可持续发展有重要意义。由于该虫主要取食枣属植物,意味着嗅觉在其识别特定寄主植物方面发挥着重要作用。然而,近年来对枣食芽象甲的相关研究仅限于该虫对枣树挥发物的EAG和嗅觉行为方面(阎雄飞和李善才, 2012; 王晶玲等, 2017; 阎雄飞等, 2020),而对该虫的化学感受机制知之甚少,有关枣食芽象甲CSP基因鉴定及蛋白功能的研究尚未见报道。
本实验室基于前期已测定的枣食芽象甲成虫触角转录组数据分析,共鉴定到12个CSP基因(数据待发表),其中触角候选基因CSP4在转录组中的FPKM(fragments per kilobase million)值相对较高(FPKM=1 766.13),推测该基因在枣食芽象甲对挥发物的嗅觉识别过程中发挥重要作用。因此,本研究克隆和鉴定出枣食芽象甲化学感受蛋白基因PyasCSP4,运用RT-qPCR技术分析该基因在枣食芽象甲成虫各组织中的表达情况,通过原核表达纯化获取PyasCSP4目的蛋白,并利用荧光竞争性结合实验对该蛋白与35种枣树Zizyphusjujuba挥发物的结合特性进行测定和分析,以期了解PyasCSP4在枣食芽象甲嗅觉识别中的作用,为阐明枣食芽象甲的化学感受机制及开发基于行为调控的防控技术提供理论依据。
1 材料与方法
1.1 供试虫源
供试枣食芽象甲老熟幼虫于2020年4月中旬采自陕西省延川县枣园,带回实验室后置于养虫罐中并覆盖土壤(土壤相对湿度为60%,土壤厚度5 cm)。待成虫羽化后将雌、雄成虫分离,置于人工气候箱内以新鲜枣芽饲养。饲养温度为(25±1)℃,相对湿度为60%±5%,光周期为16L∶8D。
1.2 RNA提取和cDNA合成
选取枣食芽象甲3日龄雌、雄成虫各200头在体视镜下解剖,收集所有成虫的触角(雌雄各约400根),去除触角的头(雌、雄各20个)、胸(雌、雄各20个)、腹(雌、雄各20个)、足(雌、雄各50头,取前、中、后足)和翅(雌、雄各50头,取前、后翅),立即置于液氮中冷冻。采用Trizol法提取各组织样品的总RNA,用微量分光光度计(SimpliNano, 美国GE公司)测定各组织样品RNA的浓度和纯度,将浓度值大于100 ng/μL,OD260/OD280值为1.8~2.0的样品视为合格,然后取各组织总RNA 1 μg,利用反转录试剂盒[TaKaRa宝日医生物技术(北京)有限公司]反转录合成cDNA第1链,-20℃保存备用。
1.3 枣食芽象甲CSP4基因克隆
基于本实验室前期已测定的枣食芽象甲雌成虫触角转录组数据(GenBank登录号: SRR7871392),以枣食芽象甲雌成虫触角cDNA为模板,设计特异性引物(CSP4-F/CSP4-R) (表1)扩增候选CSP4基因序列。RT-PCR反应体系(20 μL): cDNA模板1.0 μL,正反向引物(10 μmol/L)各1.0 μL, 2×Taq MasterMix 10 μL, ddH2O 7.0 μL。反应程序: 95℃ 3 min; 95℃ 30 s, 56℃ 30 s, 72℃ 30 s, 共35个循环; 72℃延伸10 min。进行PCR产物的菌液PCR检验和测序验证。本研究所用引物和测序均由生工生物工程(上海)有限公司完成。

表1 引物信息Table 1 Primer information
1.4 枣食芽象甲CSP4基因的序列分析
利用在线工具ORF finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)预测CSP4基因的开放阅读框(ORF);使用SignalP 5.0 Server(https:∥services.healthtech.dtu.dk/service.php? SignalP-5.0)预测CSP4的信号肽序列;使用在线软件ExPASy的ProtParam工具(http:∥web.expasy.org/protparam/)预测氨基酸的分子量和等电点。使用DNAMAN 9.0软件进行不同物种的氨基酸序列同源性分析。将枣食芽象甲CSP4氨基酸序列与从NCBI中下载的鞘翅目昆虫的CSP氨基酸序列进行多序列比对分析,利用MEGA X软件的邻接法(neighbor-joining, NJ)构建系统发育树(设置bootstrap值为1 000)。
1.5 枣食芽象甲CSP4基因的相对表达量分析
以1.2节获得的各组织cDNA为模板,选取枣食芽象甲EF-1α(GenBank登录号: OK105108)和β-actin(GenBank登录号: OK322363)作为双内参基因,进行枣食芽象甲成虫组织中CSP4的表达量的qPCR检测,qPCR所用的特异性引物见表1。qPCR反应体系(20 μL): cDNA 1.0 μL, 正反向引物(10 μmol/L)各0.8 μL, TB Green®Premix Ex TaqTMⅡ 10 μL, ROX Reference Dye 0.4 μL, ddH2O 7.0 μL。反应程序: 95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 72℃ 30 s, 共40个循环,最后在60~95℃记录熔解曲线。枣食芽象甲成虫每个组织(触角、去除触角的头、胸、腹、足和翅) 测定3个重复样品,每个样品重复测定3次。
1.6 枣食芽象甲CSP4的原核表达及纯化
根据枣食芽象甲CSP4的编码区序列,去除信号肽序列后设计带有BamHⅠ和HindⅢ酶切位点的引物(CSP4-eF/CSP4-eR)(表1),以雌成虫触角cDNA为模板进行PCR扩增,将扩增产物纯化回收后连接至pMD19-T载体,并转化至DH5α感受态细胞,菌液PCR进行检验。将含有目的片段的pMD19-T/PyasCSP4重组质粒DNA和pET32a(+)质粒DNA用BamHⅠ和HindⅢ限制性内切酶(TaKaRa)分别进行双酶切,纯化回收后利用T4 DNA连接酶将目的片段连接到表达载体pET32a(+)上,转化至DH5α感受态细胞,鉴定阳性克隆并再次测序验证,最后将序列正确的重组质粒pET32a(+)/PyasCSP4转入BL21(DE3) 感受态细胞。
挑取含pET32a(+)/PyasCSP4质粒的单克隆菌落于LB液体培养基中37℃ 220 r/min振荡培养,当菌液OD600值为0.6~0.8时,加入终浓度为0.5 mmol/L的IPTG诱导5 h,离心收集菌体后利用超声波细胞粉碎机进行破碎,然后4℃ 12 000 r/min离心30 min后收集上清和沉淀,通过SDS-PAGE检测蛋白的表达情况。利用Ni-NTA镍柱(七海复泰生物科技有限公司)对上清液中的目的蛋白进行纯化,经不同梯度咪唑缓冲液(20, 40, 80, 100, 150, 200和300 mmol/L)洗脱后,获得的重组PyasCSP4蛋白洗脱液在Tris-HCl(pH 7.4)缓冲液中充分透析后,用于Western blot检测及后续实验。
使用重组肠激酶(翊圣生物科技股份有限公司)切去重组蛋白的His标签,纯化获得目的蛋白PyasCSP4,最后利用BCA法在全波长酶标仪(BioTek Epoch2,美国Biotek公司)下测定蛋白浓度。
1.7 Western blot免疫印迹检测
利用转膜仪(DYCZ-40S,北京六一生物科技有限公司)(电流300 mA,转膜时间1 h)使重组蛋白从SDS-PAGE胶转移至PVDF膜(0.22 μm,默克Millipore)上。首先用封闭液(TBST+5%脱脂奶粉)对膜封闭2 h,然后用1∶5 000倍稀释的抗His标签鼠单克隆抗体(康为世纪生物科技有限公司)室温封闭孵育过夜。第2天用洗脱液TBST洗膜5次,然后加入1∶10 000倍稀释的羊抗鼠二抗(康为世纪)室温反应2 h,再用洗脱液TBST洗膜5次,最后加入ECL化学发光试剂在成像系统(710Pro,北京百晶生物技术有限公司)中显色观察。
1.8 荧光竞争结合实验
选用35种本实验室前期通过GC-MS鉴定出的及相关文献报道(杨立军等, 2012; 阎雄飞等, 2017, 2020)的枣树幼芽和叶片挥发物(未发表数据)作为PyasCSP4蛋白的结合配体(表2),均购自Sigma-Aldrich和Aladdin试剂公司,以1-NPN作为荧光探针,使用色谱级甲醇将1-NPN和气味配体标样配置为1 mmol/L的试样。设定荧光分光光度计(F-2700,日本HITACHI公司)的激发光波长为337 nm,扫描发射波长为370~550 nm。首先移取PyasCSP4蛋白溶液至石英比色皿中,稀释为2 mL终浓度2 μmol/L的溶液,然后按2, 4, 6, 8, 10, 12, 14, 16 和20 μmol/L的终浓度依次加入1-NPN,并记录每个浓度下最大发射波长的荧光值,利用Scatchard方程计算PyasCSP4蛋白与1-NPN的解离常数K1-NPN。
向比色皿中加入2 μmol/L PyasCSP4重组蛋白溶液和2 μmol/L 1-NPN,充分混合后记录初始荧光值,然后将每种气味配体按2, 4, 6, 8, 10, 14, 16和20 μmol/L的终浓度依次加入比色皿,并记录荧光值,每样品3次重复。假设PyasCSP4蛋白活性为100%,且在饱和状态下蛋白与气味配体的结合比为1∶1,根据公式Ki=IC50/(1+[1-NPN]/K1-NPN)计算各配体的解离常数(Ki),其中IC50为PyasCSP4/1-NPN复合物的荧光强度值下降至50%时配体的浓度,[1-NPN]为未结合的1-NPN浓度。一般认为当Ki<10 μmol/L时,蛋白和配体的结合能力较强;而当Ki>20 μmol/L时两者的结合能力很弱,基本没有结合能力(Warisetal., 2020)。
1.9 数据分析
利用2-ΔΔCt方法计算PyasCSP4基因的相对表达量(Livak and Schimittgen, 2001)。PyasCSP4在不同组织间的表达量差异用单因素方差分析(one-way ANOVA)进行检验,在不同性别间的表达量差异用独立样本t检验(independent samplest-test)检测。
2 结果
2.1 枣食芽象甲CSP4基因的克隆及序列
基因克隆获取枣食芽象甲化学感受蛋白基因的cDNA序列,将该基因命名为PyasCSP4(GenBank登录号: OK322362),其开放阅读框(ORF)全长366 bp,编码121个氨基酸,氨基酸序列的N端有18个氨基酸组成的信号肽序列,去除掉信号肽的成熟肽由103个氨基酸组成,含4个保守的半胱氨酸残基,不存在跨膜结构域,为典型的分泌蛋白。成熟蛋白预测分子量大小为11.70 kD,理论等电点为8.67,不稳定指数为32.30,亲水性平均值(GRAVY)为-0.806,表明其为亲水性蛋白。
2.2 PyasCSP4与其他昆虫CSPs的多序列比对及系统发育
PyasCSP4与鞘翅目昆虫华山松大小蠹、间大小蠹Dendroctonusadjunctus、甘薯小象甲Cylasformicarius及其他昆虫CSPs的氨基酸多序列比对发现(图1),PyasCSP4序列与其他昆虫一样都具有4个保守的半胱氨酸残基,且分布符合鞘翅目昆虫C1-X6-C2-X18-C3-X2-C4(X为除去半胱氨酸的其他氨基酸)的特征(Maleszka and Stange, 1997)。通过对PyasCSP4序列同源性比较发现,PyasCSP4与其他鞘翅目昆虫CSP序列同源性相对较低,与间大小蠹DadjCSP2的氨基酸序列一致性最高,仅为65%;与甘薯小象甲CforCSP8、华山松大小蠹DarmCSP2和苜蓿叶象甲AnthonomusgrandisAgraCSP12的氨基酸序列一致性分别为62%, 61%和57%。将PyasCSP4与其他7种鞘翅目昆虫的CSPs(79种)构建系统发育树,结果显示PyasCSP4没有与其他种类聚为一支(图2),表明PyasCSP4与目前已有研究的其他鞘翅目昆虫CSP进化关系较远。

图1 枣食芽象甲PyasCSP4与其他昆虫CSPs的氨基酸序列比对Fig. 1 Amino acid sequence alignment of PyasCSP4 fromScythropus yasumatsui with CSPs from other insect species蛋白来源物种及GenBank登录号 Origin species of proteins and their GenBank accession numbers: CforCSP8: 甘薯小象甲 Cylas formicarius, QWS70520; DarmCSP2: 华山松大小蠹 Dendroctonus armandi, AXF53965; DadjCSP2: 间大小蠹 Dendroctonus adjunctus, QPZ89236; AgraCSP11: 苜蓿叶象甲 Anthonomus grandis, AVI04881; AgraCSP12: 苜蓿叶象甲 Anthonomus grandis, AVI04882; CbowCSP6: 大猿叶甲 Colaphellus bowringi, ALR72520; AmalCSP6: 苹果小吉丁虫 Agrilus mali, AXG21599; MaltCSP10: 松墨天牛 Monochamus alternatus, AIX97085; AmelCSP6: 西方蜜蜂 Apis mellifera, NP_001071287; CpalCSP14: 大草蛉 Chrysopa pallens, AKW47193; CnipCSP14: 日本通草蛉 Chrysoperla nipponensis, AKW47216; RpedCSP2: 点蜂缘蝽 Riptortus pedestris, AWW17226. 星号表示保守位点的半胱氨酸残基。The conserved cysteines are indicated with asterisks.

图2 邻接法构建的基于氨基酸序列的枣食芽象甲PyasCSP4与其他昆虫CSPs的系统发育树(1 000次重复)Fig. 2 Phylogenetic tree of PyasCSP4 from Scythropus yasumatsui and CSPs from other insect species constructedby neighborhood-joining method based on their amino acid sequences (1 000 replicates)蛋白来源物种及GenBank 登录号Origin species of proteins and their GenBank accession numbers: 枣食芽象甲Scythropus yasumatsui (PyasCSP4); 赤拟谷盗Tribolium castaneum(TcasCSP1, NP_001039273; TcasCSP2, NP_001039277; TcasCSP4, NP_001039285; TcasCSP5-8, NP_001039287-NP_001039290; TcasCSP9, NP_00103928; TcasCSP10-14, NP_001039278-NP_001039282; TcasCSP15, NP_001039291; TcasCSP17, NP_001039284; TcasCSP18, NP_001039286; TcasCSP19, EFA07577; TcasCSP20, NP_001039274); 华山松大小蠹Dendroctonus armandi (DarmCSP1, AXF54070; DarmCSP2, AXF53965; DarmCSP3-5, AXF54071-AXF54073; DarmCSP6, AXF54077; DarmCSP7-9, AXF54074-AXF54076); 松墨天牛Monochamus alternatus (MaltCSP1-7, AIX97041-AIX97047); 甘薯小象甲Cylas formicarius (CforCSP1-7, QFO46789-QFO46795; CforCSP8-10, QWS70520-QWS70522); 棉铃象甲Anthonomus grandis (AgraCSP1-2, AVI04873-AVI04874; AgraCSP4-9, AVI04876-AVI04880; AgraCSP10, AWF93846; AgraCSP11-12, AVI04881-AVI04882); 暗黑鳃金龟Holotrichia parallela (HparCSP1-16, AKI84384-AKI84399); 苹果小吉丁虫Agrilus mali (AmalCSP1-8, AXG21594-AXG21601).
2.3 PyasCSP4的组织表达谱
组织表达结果表明(图3),PyasCSP4在枣食芽象甲成虫不同组织中均有表达,在雌成虫触角和翅中的表达量显著高于在雌成虫其他组织中的(F5,12=1 195.08,P<0.05),其中PyasCSP4在雌成虫翅中的表达量最高,分别为雌成虫头(去除触角)、胸、腹和足中表达量的1.26, 2.90, 4.34和8.36倍;PyasCSP4在雄成虫触角和翅中的表达量显著高于在雄成虫其他组织中的(F5,12=206.31,P<0.05),其中PyasCSP4在雄成虫触角中的表达量最高,分别为在雄成虫头(去除触角)、胸、腹和足中表达量的1.14, 1.82, 3.56和2.91倍。PyasCSP4在成虫触角、头(去除触角)、足和翅中的表达量存在性别差异,在雌成虫触角(t=13.65,P<0.05)、头(去除触角)(t=9.11,P<0.05)和翅(t=21.71,P<0.05)中的表达量显著高于在雄成虫中的,在雄成虫足(t=7.63,P<0.05)中的表达量显著高于在雌成虫中。
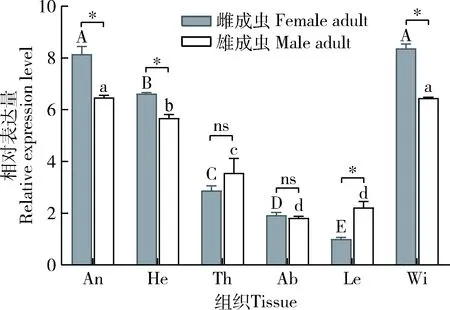
图3 PyasCSP4在枣食芽象甲成虫不同组织中的表达量Fig. 3 Expression levels of PyasCSP4 in differenttissues of Scythropus yasumatsui adultsAn: 触角Antenna; He: 头(去除触角) Head without antenna; Th: 胸Thorax; Ab: 腹Abdomen; Le: 足Leg; Wi: 翅Wing. 图中数据为平均值±标准误;柱上不同大写字母和小写字母分别表示雌成虫和雄成虫不同组织间的基因相对表达量差异显著(P<0.05, Tukey氏法),星号和ns分别表示雌、雄成虫间相同组织中的基因相对表达量经t检验差异显著(P<0.05)和差异不显著(P>0.05)。Data in the figure are mean±SE. Different uppercase and lowercase letters above bars indicate significant difference in the gene relative expression levels among different tissues of female adults and male adults, respectively (P<0.05, Turkey’s test). The asterisk and ns indicate significant difference (P<0.05) and no significant difference (P>0.05), respectively, in the gene relative expression levels in the same tissue between female adults and male adults by t-test.
2.4 重组蛋白PyasCSP4的原核表达及纯化
重组表达质粒pET32a(+)/PyasCSP4转入感受态细胞BL21,经IPTG诱导表达后用12% SDS-PAGE检测,结果表明未经IPTG诱导的菌液中没有出现目标蛋白条带,目标蛋白主要在上清中表达(图4)。表达蛋白经过纯化和肠激酶切后,分别在30 kD左右(图4: A, 5泳道)和12 kD左右(图4: A, 6泳道)出现单一条带,表明获得了纯度较高的蛋白。Western blot免疫印迹检测也表明在相应位置产生特异性条带,说明该条带为目的蛋白条带(图4: B, 7泳道)。测定肠激酶切后的PyasCSP4蛋白浓度为0.66 mg/mL。
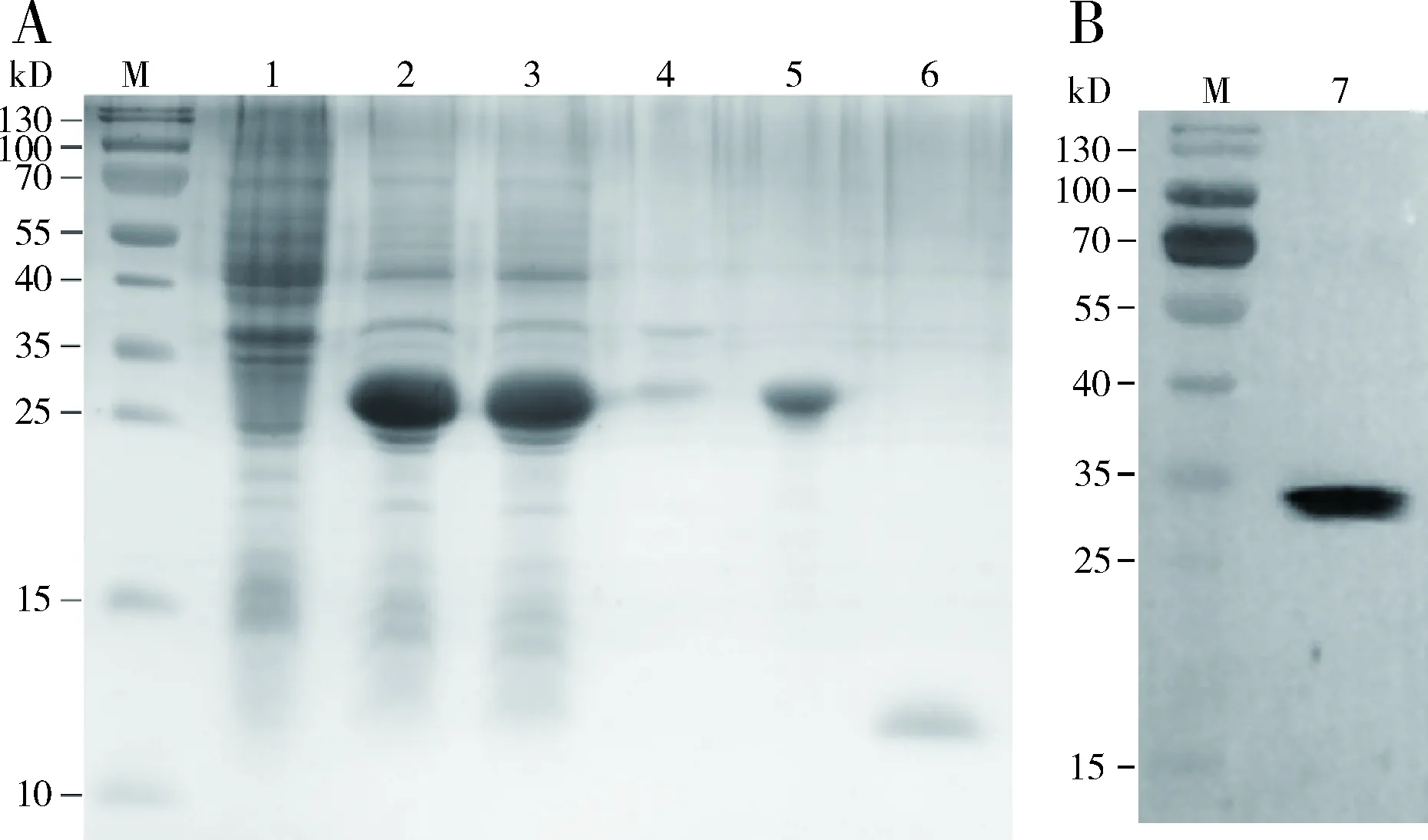
图4 PyasCSP4重组蛋白的SDS-PAGE(A)及Western blot(B)检测Fig. 4 SDS-PAGE (A) and Western blot (B) analysesof the recombinant PyasCSP4M: 蛋白标准分子量 Protein molecular weight marker; 1: 未经IPTG诱导的pET32a(+)/PyasCSP4表达产物 Expression product of pET32a(+)/PyasCSP4 without induction with IPTG; 2: 经IPTG诱导的pET32a(+)/PyasCSP4表达产物 Expression product of pET32a(+)/PyasCSP4 induced with IPTG; 3: 上清中的表达产物 Expression product in supernatant; 4: 包涵体中的表达产物 Expression product in inclusion bodies; 5: 纯化的PyasCSP4重组蛋白 Purified recombinant PyasCSP4; 6: 经肠激酶切除His标签后纯化的PyasCSP4重组蛋白 Purified recombinant PyasCSP4 without His-tag; 7: 纯化的PyasCSP4重组蛋白Western blot检测 Purified recombinant PyasCSP4 detected by Western blot.
2.5 重组PyasCSP4与枣树挥发物的结合能力
利用Scatchard方程计算出重组PyasCSP4与1-NPN的解离常数(Ki)为4.311 μmol/L(图5),表明两者间具有较强的结合能力且具有饱和效应。荧光竞争结合实验测定结果表明,有25种化合物配体能将CSP4/1-NPN复合物的荧光强度值下降至50%(Ki<20 μmol/L),表明PyasCSP4的结合谱较宽(表2)。PyasCSP4与7种醇类化合物均能结合,其中与1-戊烯-3-醇和芳樟醇有较强的结合能力,Ki分别为8.17和9.85 μmol/L,与其他5种醇类均具有中等的结合能力(图6: A)。在9种萜类化合物中,PyasCSP4与α-蒎烯、α-水芹烯和罗勒烯的结合能力最强,Ki分别为6.29, 6.58和6.69 μmol/L,与3-蒈烯、莰烯和D-柠檬烯也有中等的结合活性,Ki分别为10.60, 12.77和13.36 μmol/L,与月桂烯结合能力很弱,与β-石竹烯和角鲨烯没有结合能力(图6: B)。在9种酯类中,PyasCSP4与异戊酸叶醇酯、丁酸乙酯和2-甲基丁酸叶醇酯的结合能力较强,Ki分别为8.47, 9.13和9.30 μmol/L,与乙酸丁酯和2-甲基丁酸乙酯有中等结合能力,与乙酸叶醇酯、己酸乙酯结合能力很弱,与棕榈酸甲酯和油酸甲酯没有结合能力(图6: C)。在6种醛类中,PyasCSP4除与反-2-己烯醛没有结合能力外,与其他5种化合物均具有中等以上的结合能力,其中与辛醛的结合能力较强,Ki为8.47 μmol/L(图6: D)。在4种其他化合物中,PyasCSP4与柠檬腈和2-甲基-1-苯基丙烯的Ki分别为10.64和14.42 μmol/L,与丁香酚的结合能力很弱,与十二烷没有结合能力(图6: E)。

图5 重组蛋白PyasCSP4与1-NPN的结合曲线Fig. 5 Binding curve of the recombinant PyasCSP4with 1-NPN
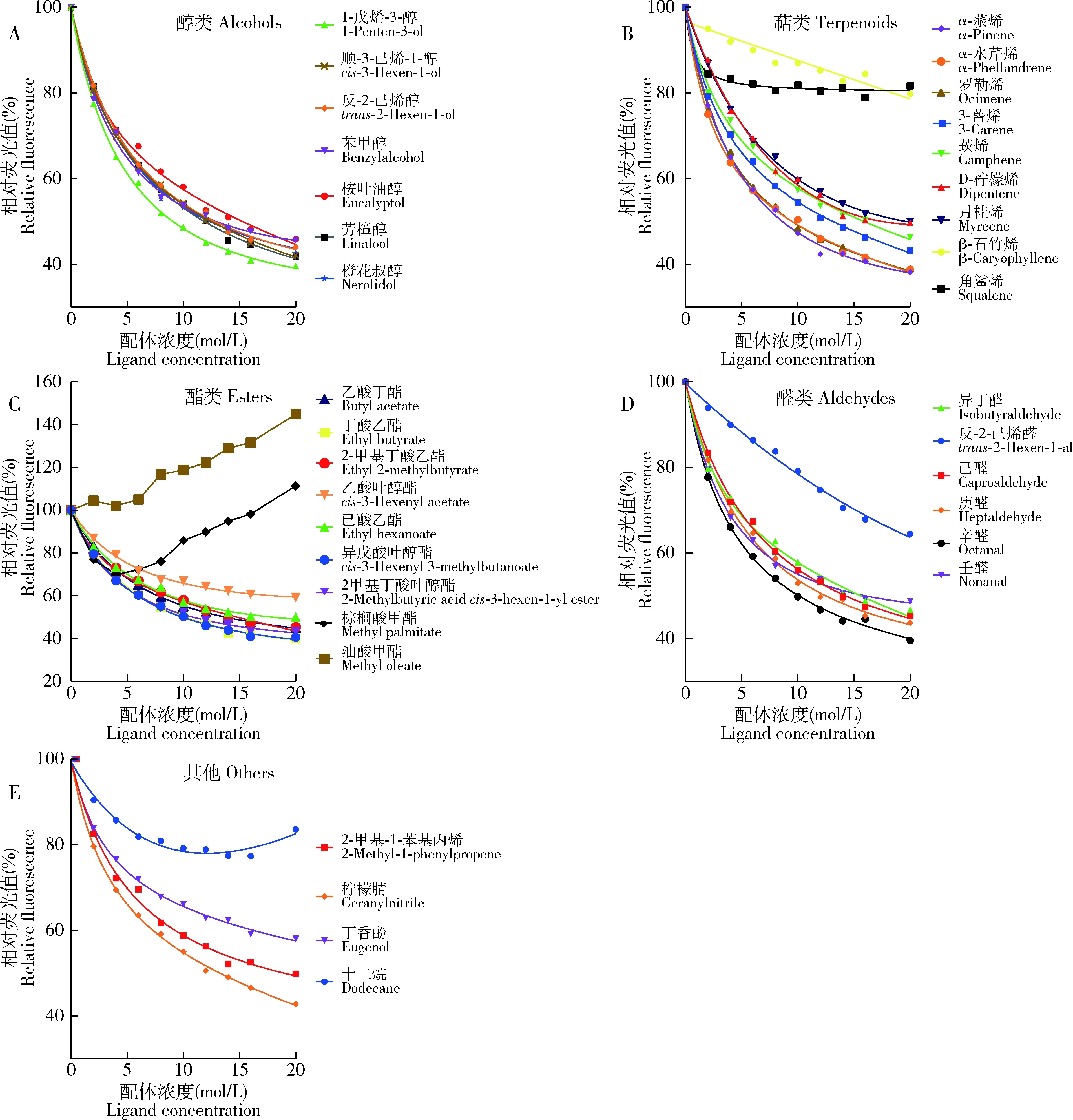
图6 重组蛋白PyasCSP4与不同枣树挥发物的结合曲线Fig. 6 Binding curves of the recombinant PyasCSP4 with different jujube volatiles
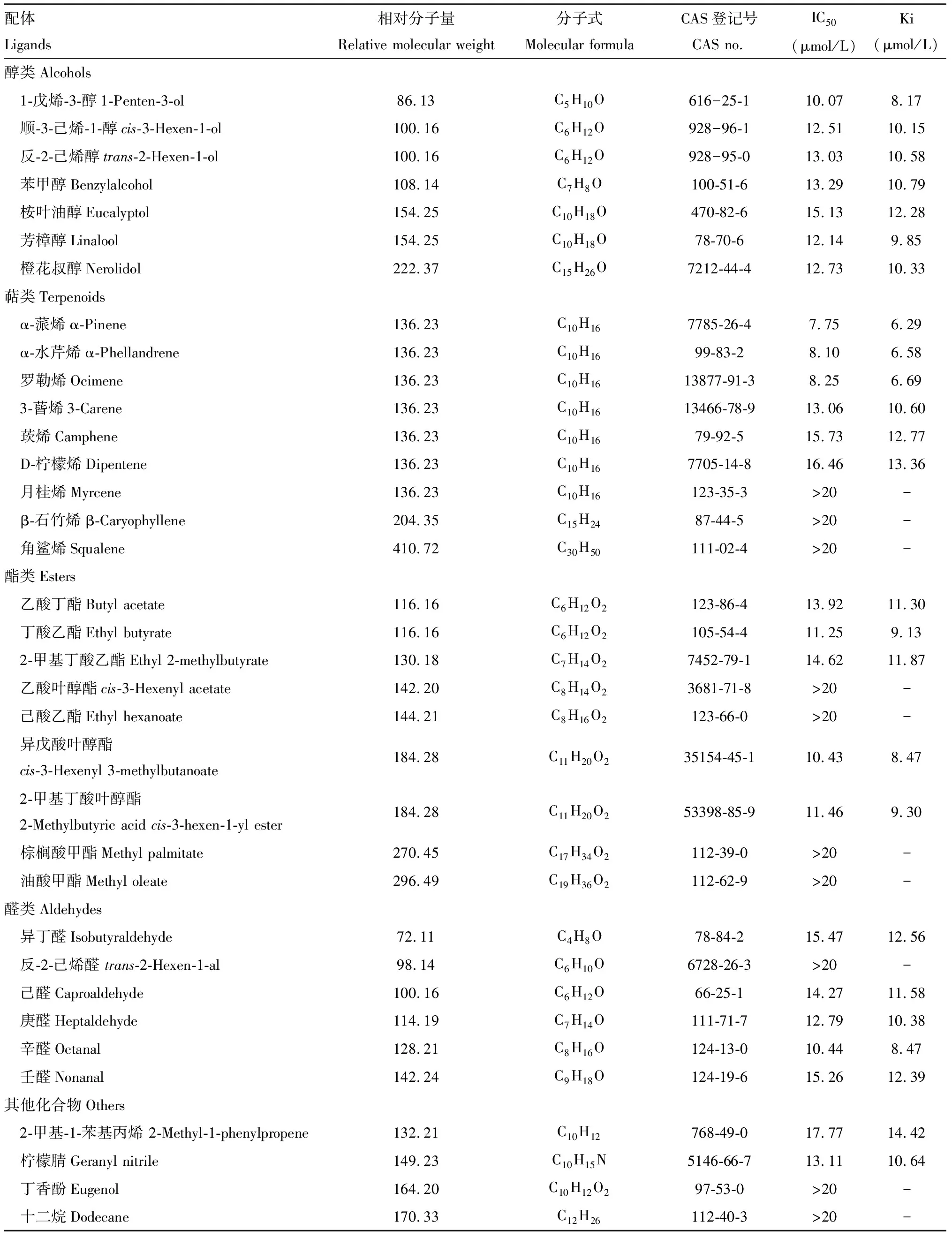
表2 重组蛋白PyasCSP4与不同枣树挥发物(配体)的结合特性Table 2 Binding characteristics of the recombinant PyasCSP4 with different jujube volatiles (ligands)
3 结论与讨论
本研究首次克隆获得了枣食芽象甲化学感受蛋白基因PyasCSP4的cDNA序列。序列分析表明该基因编码的氨基酸序列具有4个保守的半胱氨酸残基,N端有18个氨基酸组成的信号肽序列,不存在跨膜结构域,是典型的分泌蛋白,且排列方式为C1-X6-C2-X18-C3-X2-C4(图1),与鞘翅目、双翅目、半翅目和鳞翅目等昆虫的CSP蛋白相似,表明化学感受蛋白在昆虫种间和种内具有保守性(Xuetal., 2009)。氨基酸序列比对及系统发育关系表明,PyasCSP4与其他鞘翅目昆虫CSP的序列同源性较低,且PyasCSP4在系统发育树中没有与其他CSP聚为一支(图2),表明PyasCSP4与目前已有研究的其他鞘翅目昆虫CSP的进化关系较远,推测可能与相近物种CSP研究较少有关(李慧等, 2018; 饶福强等, 2021)。
RT-qPCR结果 (图3) 表明,PyasCSP4基因在枣食芽象甲雌、雄成虫不同组织中均有表达,但表达量有所差异,该基因在雌成虫的触角和翅中表达量显著高于其他组织。PyasCSP4在翅中表达量较高的结果与绿盲蝽AlucCSP2和AlucCSP3(Huaetal., 2013)、褐飞虱NlugCSP5(Yangetal., 2014)、粘虫MsepCSP8(Younasetal., 2018)和梨小食心虫GmolCSP8(Lietal., 2019)等基因的组织表达谱结果相似。且研究发现CSP在东亚飞蝗翅上的化学感器中大量表达,表明除触角外,翅部也可能参与化学感受过程,并在嗅觉和味觉识别中发挥重要作用(Zhouetal., 2008; Huaetal., 2013)。因此,推测PyasCSP4可能参与了枣食芽象甲对嗅觉或味觉的识别,其具体功能还有待于进一步研究。另外,PyasCSP4基因在枣食芽象甲雌、雄成虫腹部的表达量较低(图3),推测PaysCSP4可能不参与性腺中性信息素的识别和运输(Lietal., 2015)。
本研究通过对PyasCSP4进行原核表达和纯化,获取了可用于荧光竞争结合实验的目的蛋白。荧光竞争结合实验结果 (图6) 表明,PyasCSP4具有广泛的气味结合谱,能够与多种气味配体,包括醇、萜、酯、醛、烯烃及腈类等物质产生较为广谱的结合能力,尤其与α-蒎烯、α-水芹烯和罗勒烯等萜类物质的结合能力最强(表2)。阎雄飞等(2020)测定枣食芽象甲成虫对26种枣树挥发性物质的EAG和行为反应结果表明,罗勒烯、棕榈酸甲酯和壬醛对雌、雄成虫均有明显吸引作用,反-2-己烯醇对雌成虫表现出引诱作用。PyasCSP4与罗勒烯、壬醛和反-2-己烯醇这3种挥发物均有中等以上的结合能力(表2),表明其可能在枣食芽象甲搜寻寄主植物过程中发挥重要化学感受作用;而PyasCSP4与棕榈酸甲酯不能结合,推测其与棕榈酸甲酯的分子特性有关。相关研究表明,在一定范围内,蛋白和配体的结合能力随气味分子的碳原子数量增加而逐渐降低(Yuetal., 2009; Yinetal., 2012)。本研究中PyasCSP4除与橙花叔醇(C15)有中等结合能力外,与其他碳原子数量超过11的配体,如与十二烷(C12)、β-石竹烯(C15)、棕榈酸甲酯(C17)、油酸甲酯(C19)和角鲨烯(C30)均无法结合(表2),表明气味分子碳原子数量对PyasCSP4与配体的结合影响较大。另外,配体的分子空间构象也能影响PyasCSP4的结合能力,如α-蒎烯、α-水芹烯、罗勒烯、3-蒈烯、莰烯、D-柠檬烯和月桂烯均为镜像异构体,PyasCSP4与α-蒎烯、α-水芹烯和罗勒烯表现出很强的结合活性,与3-蒈烯、莰烯和D-柠檬烯结合能力为中等,而与月桂烯不能结合(表2)。因此,为了精确揭示PyasCSP4与气味分子的具体结合机制,还需解析其蛋白晶体结构或通过同源建模及蛋白与配体的分子对接进行验证(李广伟等, 2017)。
综上,本研究推测PyasCSP4在枣食芽象甲嗅觉识别和定位寄主植物的过程中发挥重要作用,这为阐明枣食芽象甲嗅觉机制,进一步开展以枣食芽象甲CSP为靶标的绿色防控措施提供了科学参考。在后续研究中,将对PyasCSP4进行RNA干扰(RNAi)分析,从电生理和行为学水平验证该基因在枣食芽象甲中的生理功能。
猜你喜欢
杂志排行
昆虫学报的其它文章
- Morphological differentiation in the Asian honey bees (Apis cerana) in China
- 我国余甘子新害虫锡兰玻壳蚧的形态及生物学特性
- 贝氏小奥林螨连续饲养的草栖钝绥螨生命表参数和捕食能力
- 施药后不同时间玉米田中常用农药残留对玉米螟赤眼蜂的影响
- Inhibition of glucose oxidase gene decreases the resistance of Mythimna separata (Lepidoptera: Noctuidae) larvae to Bacillus thuringiensis infection
- RNAi介导的GdHsp60和GdHsp70基因沉默对沙葱萤叶甲幼虫抗寒性的影响
