RNAi介导的GdHsp60和GdHsp70基因沉默对沙葱萤叶甲幼虫抗寒性的影响
2022-08-13张宏玲李凯旋李艳艳庞保平
张宏玲, 任 浩, 李凯旋, 田 宇, 张 恒, 李艳艳,李 玲, 庞保平, 谭 瑶,*
(1. 内蒙古农业大学草原昆虫研究中心, 呼和浩特010019; 2. 镶黄旗草原工作站, 内蒙古镶黄旗013250;3. 正镶白旗草原工作站, 内蒙古正镶白旗 013800)
沙葱萤叶甲Galerucadaurica属鞘翅目(Coleoptera)叶甲科(Chrysomelidae)萤叶甲亚科(Galerucinae)。据报道该虫现主要分布于俄罗斯、蒙古国、朝鲜、韩国以及中国的内蒙古、新疆、甘肃等地(杨星科等, 2010),是一种主要以幼虫取食百合科(Liliaceae)葱属Allium植物的典型草地害虫(昊翔等, 2015)。近年来,沙葱萤叶甲在内蒙古草原大面积暴发,严重影响了当地草产业、畜牧业发展、降低了农牧民收入,并加剧了草地退化的程度(陈龙等, 2018a),对北方草原生态安全和地方经济发展带来了严重的威胁。内蒙古地区属于温带大陆性气候带,夏季凉爽,冬季严寒,抗寒性是保证昆虫越冬存活的前提条件(Kangetal., 2007),而抗寒性的强弱决定了昆虫低温下存活的概率(Chen and Kang, 2005)。沙葱萤叶甲以卵在极寒条件下越冬,幼虫发育也伴随着低温变化,其在短时间内对强烈变化的温度的快速适应保证了种群的迅速增加(马崇勇等, 2012),这种抗寒特性是使其维持种群数量的重要生态对策(Tanetal., 2018)。前期对沙葱萤叶甲的抗寒性研究主要集中于低温胁迫对沙葱萤叶甲各虫态生长发育的影响(李浩等, 2014, 2015; 高靖淳等, 2015; Zhouetal., 2016)、沙葱萤叶甲响应低温胁迫的生理生化机制(周晓榕等, 2016)、低温胁迫下抗寒相关基因的挖掘(路标等, 2017; 陈龙等, 2018b)和克隆与表达(谭瑶等, 2017; 陈龙等, 2019; Huoetal., 2019)。抗寒基因的功能研究并未深入开展。
热激蛋白(heat shock proteins, HSPs)是一类受到外界刺激后在生物体内迅速合成或表达量升高的蛋白(King and MacRae, 2015)。根据分子量及生物学功能不同,HSPs可分为HSP100家族、HSP90家族、HSP70家族、HSP60家族、HSP40家族和小分子HSPs(SHSPs)6个家族。热激蛋白在进化上具有高度保守性(Sietal., 2016),涉及蛋白质折叠、装配、跨膜转运、细胞凋亡,充当分子伴侣等功能(Hartl and Hayer-Hartl, 2009; Seddigh, 2019)。依据诱导表达特性,昆虫中的热激蛋白可分为组成型热激蛋白(cognate heat shock protein)和诱导型热激蛋白(inducible heat shock protein),主要负责维持细胞内环境稳定,促进变性蛋白质修复,在机体受逆境胁迫后保护蛋白、多肽(Nollen and Morimoto, 2002)。在许多研究中热激蛋白基因常作为昆虫响应高低温变化的分子指示标记被报道,Dahlgaard等(1998)用高温处理果蝇,经检测发现Hsp70的表达与果蝇耐热性呈正相关;Sonoda等(2006)研究表明:用低温处理二化螟Chilosuppressalis非滞育幼虫诱导了Hsp90的高表达;Yu等(2018)采用qPCR方法分析了-11~27℃温度处理下二化螟幼虫HSP60家族的Tcp-1基因mRNA的表达水平,发现受到低温胁迫后该基因的表达上调;Quan等(2020)通过研究云杉色卷蛾Choristoneurafumiferana中的8个ATP依赖的HSP转录本(CfHSPs),发现1个HSP70基因在幼虫期受冷胁迫后表达上调。长期以来,热激蛋白被认为在昆虫对外界环境温度适应性中发挥了重要作用,但在不同昆虫、不同虫态中不同热激蛋白的具体作用种类和机制仍不清楚。前期研究发现:在越冬虫态及低温驯化下的沙葱萤叶甲中,编码Hsp60蛋白(GdHsp60)和诱导型Hsp70蛋白(GdHsp70)的基因显著高表达(谭瑶等, 2017; Tanetal., 2018)。这是否增强了沙葱萤叶甲抗寒能力,介导了越冬时期的抗寒性,尚不清楚。
本研究为明确GdHsp60和GdHsp70基因在沙葱萤叶甲抗寒性中的功能,采用饲喂法和显微注射法进行RNAi实验,检测不同导入方法的沉默效果以及靶标基因被沉默后对沙葱萤叶甲幼虫抗寒能力的影响。为深入开展沙葱萤叶甲幼虫适应高寒环境的生态对策与分子机制奠定基础,也为沙葱萤叶甲的监测预警及科学防控提供理论依据。
1 材料与方法
1.1 供试昆虫
将2019年9月采自内蒙古锡林郭勒镶黄旗草原的沙葱萤叶甲越冬卵在4℃冷藏箱(YC-260L,安徽美菱生物医疗)中保存,于2020年4月初转放入25±1℃、相对湿度70%±5%、光周期14L∶10D的人工气候箱中培养(PRX-350C,宁波海曙赛福实验仪器厂),待幼虫孵化后以室内种植的韭菜为食料进行饲养。
1.2 主要试剂与仪器
RNA提取试剂TaKaRa RNAiso Plus,Taq酶预混液Premix TaqTM(TaKaRa TaqTMVersion 2.0 Plus Dye),去gDNA反转录试剂盒PrimeScriptTMRT Reagent Kit with gDNA Eraser,TA克隆载体pMD19-T Vector Cloning Kit,DNA分子量衡量标准DL2000 DNA Marker,荧光定量试剂盒SYBR Green Real-time PCR Master Mix 均购自大连宝生物工程有限公司;核酸琼脂糖凝胶回收试剂、大肠杆菌EscherichiacoliDH5α感受态细胞购自天根生化科技有限公司;dsRNA合成试剂盒T7 Ribo MAXTMExpress RNAi System试剂盒购自Promega公司;引物合成及序列测定由生工生物工程(北京) 股份有限公司完成。其他试剂为国产分析纯试剂。普通PCR仪(T100 Thermal Cycler,Bio-Rad,美国);荧光定量PCR仪(FTC-3000P,Funglyn Biotech,加拿大);超微量分光光度计(Nano Photometer TM P-Class,德国);智能型人工气候箱(PRX-350C,宁波海曙赛福实验仪器厂);低温培养箱(LRH-100CB型,上海一恒仪器公司);医用冷藏箱(YC-260L,安徽美菱生物医疗)和多路温度自动记录仪(TP9024U型,深圳市拓普瑞电子有限公司)。
1.3 dsRNA的合成
用TaKaRa RNAiso Plus(Total RNA提取试剂)提取沙葱萤叶甲幼虫总RNA,并通过超微量分光光度计和1%琼脂糖凝胶电泳检测总RNA的浓度及质量;使用PrimeScriptTMRT Reagent Kit with gDNA Eraser反转录试剂盒合成cDNA,于-20℃保存备用。根据GdHsp60(GenBank登录号: KY460463)和GdHsp70(GenBank登录号: KY460462)的cDNA全长序列,设计特异性引物进行PCR扩增(表1)。PCR反应体系(25 μL):cDNA 模板1 μL,上下游引物(10 pmol /L) 各1 μL,Premix TaqTM12.5 μL,RNase-Free ddH2O 9.5 μL。反应程序: 94℃ 3 min;94℃ 30 s,58℃ 60 s,72℃ 2 min,循环30次;72℃ 10 min。
将通过测序验证的GdHsp60和GdHsp70基因序列输入在线网站http:∥www.flyrnai.org/cgi-bin/RNAi_find_primers.pl,设计5′端含有T7启动子序列的dsRNA引物(表1)。按照T7 Ribo MAXTMExpress RNAi System 试剂盒说明书合成dsRNA并测定其浓度,1%琼脂糖凝胶电泳检测合成的dsRNA分子量大小是否与预期一致,-80℃保存。 根据预试验结果,当dsRNA浓度为1 000 ng/μL时,对GdHsp60和GdHsp70基因表达RNAi效果良好。

表1 引物信息Table 1 Primer information
1.4 饲喂法RNAi
分别收集新孵化幼虫(1龄第1天)和2龄幼虫(蜕皮第1天),置于干净的培养皿中,每皿20头,每个处理10皿。以长度为15 mm在浓度为1 000 ng/μL的dsRNA(dsGdHsp60和dsGdHsp70)中浸泡30 s的韭菜叶片为饲料,分别用以喂饲供试幼虫。饲喂1 d后提供新鲜的韭菜叶片。每日记录幼虫死亡率、观察生长发育情况,空白对照饲喂灭菌水处理的韭菜叶片,阴性对照饲喂浸泡过dsGFP的韭菜叶片(贾浩康等, 2019; Mishraetal., 2021)。为明确干扰效果最优处理时间,分别在dsRNA处理幼虫0, 12, 24, 36, 48和72 h后每个处理收集虫体20头,在液氮中快速冷冻,-80℃保存用于后续基因表达检测。
1.5 显微注射法RNAi
选取发育进度一致的2龄幼虫(蜕皮第1天),用毛笔小心刷去表皮的土壤和灰尘,用固体胶将其暂时粘在干净的载玻片中,使用显微注射器(SHTMADZU,日本)将0.4 μL(1 000 ng/μL)的dsRNA(dsGdHsp60和dsGdHsp70)注射入幼虫腹部第8节段,注射后放入带气孔的离心管中单独饲养,并观察其死亡率(Gurusamyetal., 2020; Youetal., 2020)。以注射灭菌水和注射dsGFP分别作为空白对照和阴性对照,于处理0, 12, 24, 36, 48和72 h时采样。
1.6 qPCR测定RNAi后GdHsp60和GdHsp70的相对表达量
根据GdHsp60和GdHsp70的cDNA全长序列,设计特异性引物用于qPCR检测(表1)。qPCR反应体系(10 μL):cDNA模板1 μL,上下游引物(10 μmol/L)各0.2 μL,SYBR Green Real-time PCR Master Mix反应液 5 μL,灭菌水3.6 μL。选用沙葱萤叶甲琥珀酸脱氢酶(succinate dehydrogenase, SDHA)基因作为内参基因(Tanetal., 2016),引物见表1。1.4和1.5节各处理3个重复,每个重复20头个体。使用q-PCR仪(FTC-3000,Funglyn Biotech,加拿大)进行测定,反应程序: 95℃预变性10 min; 95℃变性15 s, 60℃退火1 min, 72℃延伸30 s, 40个循环。
1.7 热电偶法测定GdHsp60和GdHsp70沉默后沙葱萤叶甲2龄幼虫的过冷却点与结冰点
为检测沉默GdHsp60和GdHsp70对沙葱萤叶甲2龄幼虫抗寒性的影响,采用热电偶法测定过冷却点(super-cooling point, SCP)与结冰点(freezing point, FP)。使用的仪器有低温培养箱(LRH-100CB型,上海一恒仪器公司)和多路温度自动记录仪(TP9024U型,深圳市拓普瑞电子有限公司)。将试虫置于塞有少量脱脂棉花的移液枪头中,插入测温计热敏探头,使热敏探头能固定在枪头内并恰好紧贴1.5节处理24 h后的虫体,随后置于低温培养箱中,设置程序使箱内温度从室温以约1℃/min的速率下降至-40℃,记录试虫体温变化(李浩等, 2015; 史彩华等, 2016)。每个处理3次重复,每次重复20头幼虫。
1.8 生物测定GdHsp60和GdHsp70被沉默后沙葱萤叶甲2龄幼虫的致死温度和-5℃低温处理的致死时间
为比较靶标基因沉默对沙葱萤叶甲2龄幼虫抗寒能力的影响,在室内测定半致死温度(Ltemp50) 和90%致死温度(Ltemp90)及-5℃处理下的半致死时间(Ltime50)和90%致死时间(Ltime90)。致死温度测定方法:将1.5节处理24 h后的幼虫分别在25, -6, -8, -10, -12和-14±0.5℃的低温培养箱中处理2 h后,统计死亡率,计算Ltemp50和Ltemp90。致死时间测定方法:1.5节处理24 h后的幼虫在温度为-5℃低温培养箱中分别处理0, 12, 24, 48, 96, 144及192 h(欧阳芳和戈峰, 2014; 李浩等, 2015),之后将试虫转移到25℃人工气候箱内饲养,观察存活情况,以能自主爬行作为存活标准,统计死亡率以计算Ltime50和Ltime90。每个处理5组重复,每组重复20头幼虫。
1.9 数据分析
采用2-ΔΔCt法进行相对定量分析(Livak and Schmittgen, 2001)。通过SPSS 26.0软件对试验数据进行统计分析,Kolmogorov-Smirnov检验沙葱萤叶甲过冷却点和结冰点数据是否符合正态分布。同一因素下,不同处理组相对表达量差异采用单因素方差分析(One-way ANOVA,LSD 法)。回归分析(logistic regression)拟合出死亡率与时间、温度的关系变化曲线,确定半致死时间(Ltime50)及半致死温度(Ltemp50)(欧阳芳和戈峰, 2014)。
2 结果
2.1 饲喂法RNAi后沙葱萤叶甲幼虫中GdHsp60和GdHsp70的表达水平
与饲喂dsGFP的对照组相比,1龄幼虫饲喂dsGdHsp60 12 h后GdHsp60的表达量极显著下降(P<0.01),48 h下降程度最高,表达水平降低了76.07%(P<0.05)(图1: A),72 h时表达量有所恢复(P=0.06);饲喂dsGdHsp70 24 h后GdHsp70的表达水平降至最低,降低了59.54%(P<0.05),72 h后恢复至正常水平(P=0.90)(图1: B)。与饲喂dsGFP的对照组相比,2龄幼虫饲喂dsGdHsp60 24 h后GdHsp60的表达量显著下降(P<0.05),在36 h后表达量最低,降低了34.00%(P<0.05),之后开始恢复(图1: C);饲喂 dsGdHsp70 12 h后,GdHsp70的表达量降至最低,显著降低了83.49%(P<0.05),在72 h时完全恢复(图1: D)。结果表明,饲喂dsGdHsp60和dsGdHsp70均能够有效降低沙葱萤叶甲1、2龄幼虫体内靶标基因的表达水平。

图1 饲喂dsRNA后沙葱萤叶甲1(A, B)和2龄(C, D)幼虫GdHsp60(A, C)和GdHsp70(B, D)的相对表达量Fig. 1 Relative expression levels of GdHsp60 (A, C) and GdHsp70 (B, D) in the 1 st (A, B)and 2nd (C, D) instar larvae of Galeruca daurica fed with dsRNA以灭菌水处理的空白对照组(CK)的基因表达量为基准,以dsGFP处理组为阴性对照组。下同。图中数据为平均值±标准误(n=3),柱上星号和双星号分别表示差异显著(P<0.05)和极显著(P<0.01, ANOVA, LSD);图2同。The expression levels of genes in the blank control group (CK)(treatment with sterile water) were used as the standard, and the dsGFP treatment group was used as the negative control group. The same below. Data in the figure are mean±SE (n=3). The asterisk and double asterisk above bars indicate significant difference (P<0.05) and extremely significant difference (P<0.01), respectively, by ANOVA, LSD. The same for Fig. 2.
2.2 显微注射法RNAi后沙葱萤叶甲幼虫中GdHsp60和GdHsp70的表达水平
与显微注射dsGFP的对照组相比,注射12 h后,沙葱萤叶甲2龄幼虫体内GdHsp60和GdHsp70的表达量均极显著降低(P<0.01),在24 h表达水平均降至最低,分别降低了84.15%和92.38%(P<0.01);随着时间延长,两个基因的表达量逐步上升,其中注射dsGdHsp60 36 h后GdHsp60的表达量虽有所上升,但与对照相比仍存在极显著差异(P<0.01);而GdHsp70的表达量在注射48 h后基本恢复到正常水平(P=0.78)(图2)。结果表明,注射dsGdhsp60 和dsGdhsp70均能够显著降低沙葱萤叶甲幼虫体内相应靶标基因的表达水平。
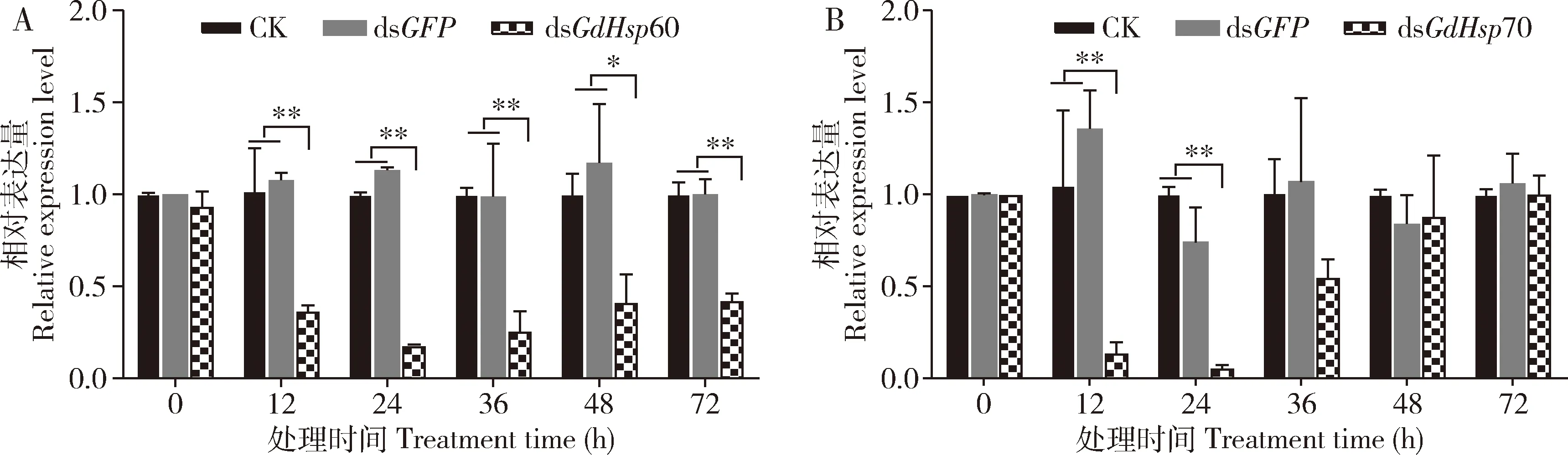
图2 显微注射dsRNA后沙葱萤叶甲2龄幼虫中GdHsp60(A)和GdHsp70(B)的相对表达量Fig. 2 Relative expression levels of GdHsp60 (A) and GdHsp70 (B) in the 2nd instar larvaeof Galeruca daurica after microinjection with dsRNA
2.3 GdHsp60和GdHsp70沉默对沙葱萤叶甲2龄幼虫过冷却点与结冰点的影响
沙葱萤叶甲2龄幼虫在注射dsGdHsp60和dsGdHsp70 24 h后,其过冷却点与结冰点均显著升高(P<0.05)(图3: A, B)。 注射dsGFP后虫体过冷却点与结冰点分别为-14.71±0.11℃和-13.94±0.90℃,与空白对照相比均无显著性变化(P>0.05)。注射dsGdHsp60后虫体过冷却点与结冰点分别为-10.56±0.42℃和-7.66±0.56℃,与对照相比显著升高(P<0.001) (图3: A, B);注射dsGdHsp70后虫体过冷却点与结冰点分别为-9.08±0.23℃和-6.09±0.28℃,与对照相比显著升高(P<0.001)(图3: A, B);同时,注射dsGdHsp60和dsGdHsp70 24 h后过冷却点和结冰点也存在显著差异(P<0.05) (图3: A, B)。

图3 通过显微注射法分别对GdHsp60和GdHsp70进行RNAi 24 h后沙葱萤叶甲2龄幼虫的过冷却点(A)和结冰点(B)Fig. 3 Super-cooling points (A) and freezing points (B) of the 2nd instar larvae of Galeruca dauricaafter RNAi of GdHsp60 and GdHsp70 by microinjection for 24 h图中数据为平均值±标准误(n=25),柱上字母表示不同处理存在显著性差异(P<0.05, ANOVA, LSD)。图4同。Data in the figure are mean±SE (n=25). Letters above bars indicate significant differences among different treatments (P<0.05) by ANOVA, LSD. The same for Fig. 4.
2.4 GdHsp60和GdHsp70沉默对沙葱萤叶甲2龄幼虫Ltime50和Ltemp50的影响
为验证分别沉默GdHsp60和GdHsp70后是否降低了沙葱萤叶甲幼虫的抗寒能力,室内测定了沙葱萤叶甲2龄幼虫在注射dsRNA后在不同低温处理下的存活率。结果表明(图4: A),低温处理2 h后幼虫低温存活率随处理温度的降低呈显著下降趋势(CK:F5.29=247.98,P<0.001; 注射dsGFP:F5.29=259.08,P<0.001; 注射dsGdHsp60:F5.29=192.02,P<0.001; 注射dsGdHsp70:F5.29=308.91,P<0.001),除25℃常温处理外,在各低温处理下处理组存活率均显著低于对照组CK和dsGFP(P<0.05)。实验组与对照组CK和dsGFP致死中温度Ltemp50分别为:CK: -10.57(-10.98~-10.17)℃; dsGFP: -10.63(-11.03~-10.24)℃; dsGdHsp60: -8.33(-8.73~-7.91)℃和dsGdHsp70: -8.21(-8.62~-7.79)℃(表2)。各组幼虫在-5℃低温处理不同时间,存活率存在极显著差异(CK:F6.34=292.68,P<0.001; 注射dsGFP:F6.34=354.75,P<0.001; 注射dsGdHsp60:F6.34=474.07,P<0.001; 注射dsGdHsp70:F6.34=347.66,P<0.001)。与0 h低温处理相比,dsGFP注射幼虫处理12 h后显著下降(P<0.05),随着处理时间的延长,各组存活率均逐渐降低;除低温处理0 h外,-5℃处理不同时间的实验组与对照组相比,幼虫存活率均存在显著差异(P<0.05)(图4: B)。SPSS回归分析(logistic regression)很好地描述了死亡率与处理时间的关系,经计算在-5℃低温处理下,实验组与对照组CK和dsGFP半致死时间(Ltime50) 及95%置信区间分别为:CK: 87.92(79.18~96.87) h; dsGFP: 87.13(78.41~96.07) h; dsGdHsp60: 49.25(41.26~57.31) h; dsGdHsp70: 52.21(44.18~60.22) h(表3),这说明沉默GdHsp60和GdHsp70均会降低幼虫在短时间对极端低温的耐受能力。
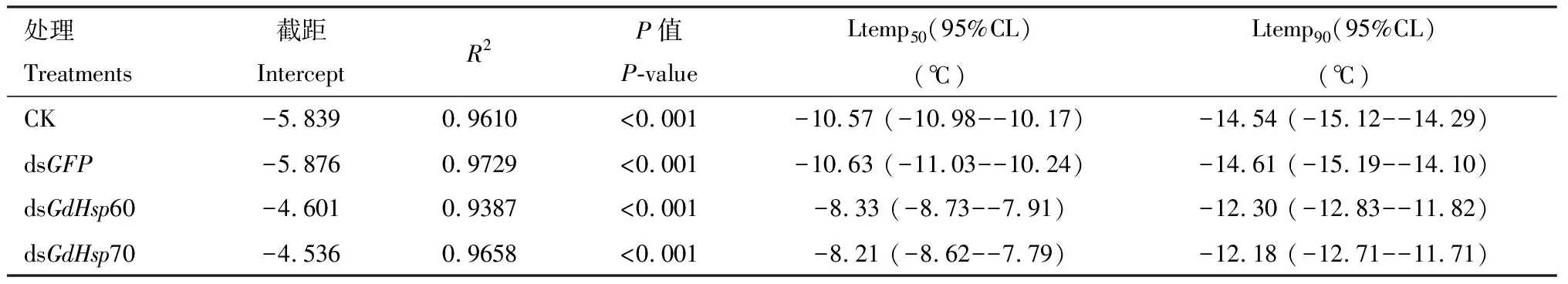
表2 通过显微注射法分别对GdHsp60和GdHsp70进行RNAi 24 h后沙葱萤叶甲2龄幼虫的致死温度Table 2 Lethal temperature (Ltemp) for the 2nd instar larvae of Galeruca dauricaafter RNAi of GdHsp60 and GdHsp70 by microinjection for 24 h
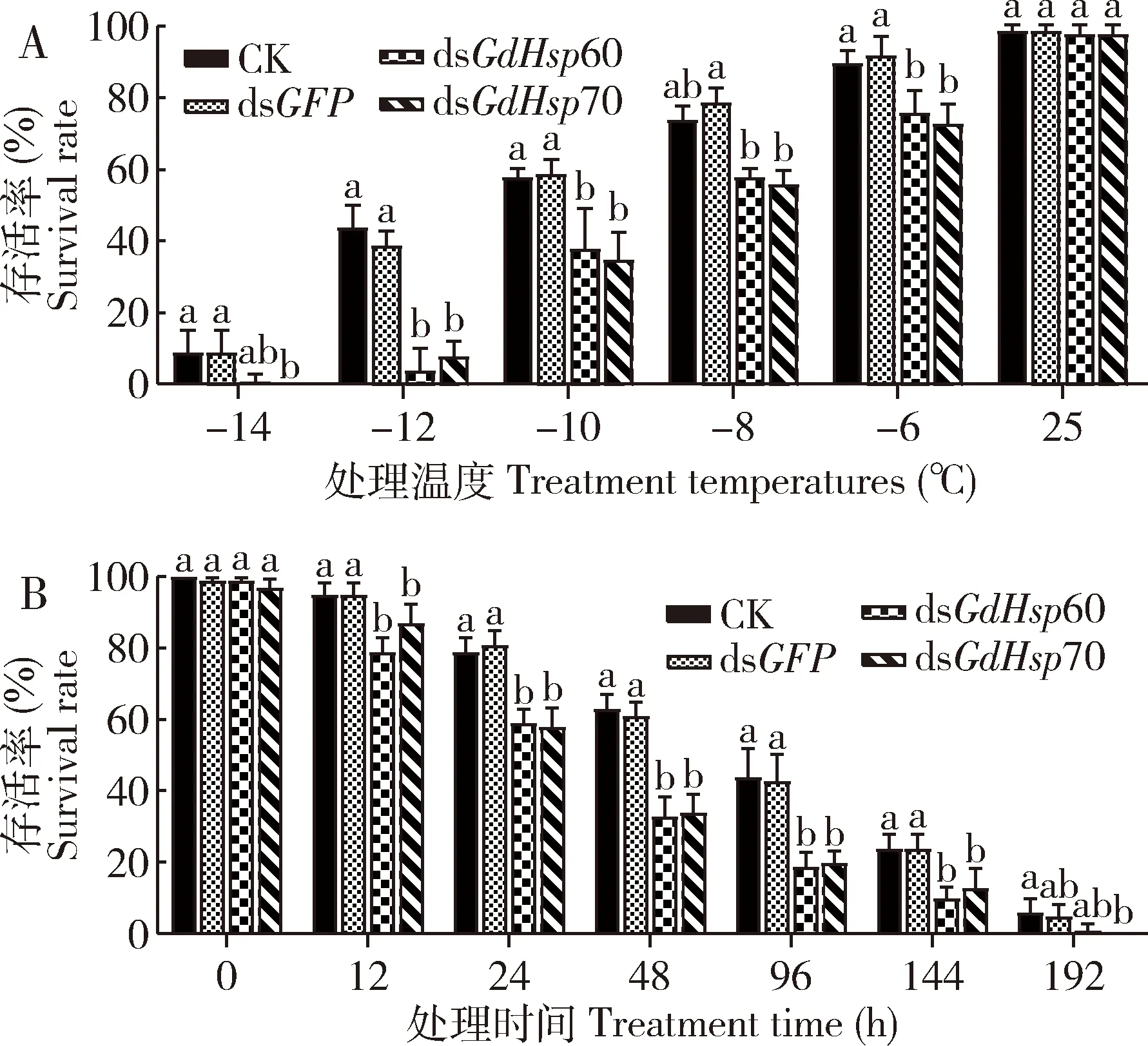
图4 通过显微注射法分别对GdHsp60和GdHsp70进行RNAi 24 h后沙葱萤叶甲2龄幼虫在不同低温下处理2 h(A)和-5℃处理不同时间(B)的存活率Fig. 4 Survival rates of the 2nd instar larvae of Galerucadaurica exposed to different low temperatures for 2 h (A)and -5℃ for different time (B) after RNAi of GdHsp60and GdHsp70 by microinjection for 24 h
3 讨论
RNAi常用的导入方法有注射法、浸泡法、饲喂法和转基因法等,其对靶标基因的沉默效率与dsRNA导入方法、靶基因 RNAi作用区域选择、dsRNA长度、浓度以及dsRNA溶剂的选择都密切相关(Wangetal., 2016; Perkinetal., 2017)。根据沙葱萤叶甲的生物学特性,我们选取保守区域设计引物并采用饲喂法和显微注射法进行RNA干扰。饲喂dsGdHsp60和dsGdHsp70均能够有效降低沙葱萤叶甲1和2龄幼虫体内靶标基因的表达水平(图1), 由于不同个体取食能力的差异, 以及dsRNA通过昆虫肠道时可能会发生一定程度的降解等原因,饲喂法干扰效率较注射法低。通过显微注射法导入dsRNA后,12~48 hGdHsp60和GdHsp70基因沉默现象持续出现,并呈现出了显著的时间效应(图2)。这在其他昆虫研究中也有类似的现象,史学凯等(2017)通过分析不同RNAi方法对飞蝗Locusta应用SPSS回归分析拟合出死亡率与时间、温度的关系变化曲线。SPSS (logistic regression) was used to fit the curve of mortality with time and temperature, respectively. 表3同The same for Table 3.
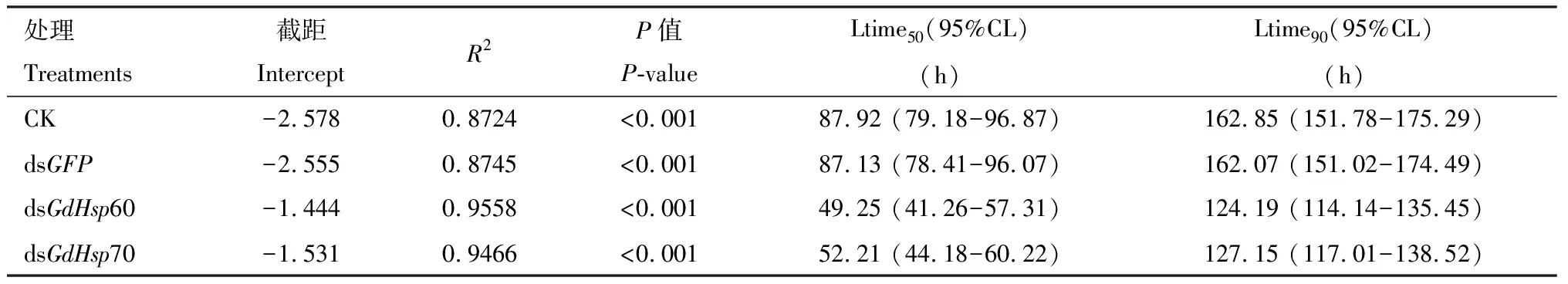
表3 通过显微注射方法分别对GdHsp60和GdHsp70进行RNAi 24 h后-5℃低温对沙葱萤叶甲2龄幼虫的致死时间Table 3 Lethal time (Ltime) of low temperature of -5℃ to the 2nd instar larvae of Galeruca dauricaafter RNAi of GdHsp60 and GdHsp70 by microinjection for 24 h
migratoria触角高表达基因的沉默效率,发现飞蝗触角浸泡法和涂抹法干扰LmCYP3117C1没有显著效果,腹部注射法对飞蝗触角LmCYP3117Cl的沉默效率较低,触角窝注射法可以高效沉默LmCYP3117C1。贾浩康等(2019)利用RNAi技术沉默白背飞虱Sogatellafurcifera3龄若虫的MCO4基因,检测发现显微注射法可以成功沉默白背飞虱的MCO4基因,沉默效率远高于饲喂法。但在柳蓝叶甲Plagioderaversicolora幼虫RNAi实验中,饲喂dsSrp54k的非无菌幼虫比注射dsSrp54k的幼虫有更高的死亡率和肠道细菌增量,认为dsSrp54k分子被柳蓝叶甲取食后可间接引起肠道菌群紊乱,提高了叶甲的死亡率(Xuetal., 2021)。尽管沙葱萤叶幼虫取食dsGdHsp60和dsGdHsp70后体内的分子机制尚未探明,但基于使用两种RNAi方法后干扰效率及稳定性的比较,对于沙葱萤叶幼虫RNAi实验,注射法较优。
热激蛋白作为高度保守的分子伴侣,有助于提高生物对逆境的耐受性(Lietal., 2018),增强其在恶劣环境条件下的生存和适应能力,在生物对各种环境胁迫的应答中起着关键作用(Luetal., 2017)。前期发现GdHsp70基因在沙葱萤叶甲的生长发育和高低温胁迫响应中都有重要作用(谭瑶等, 2017);而冷、热胁迫均可诱导沙葱萤叶甲2龄幼虫GdHsp10和GdHsp60的mRNA表达(Tanetal., 2018)。尽管很多研究报道了昆虫热激蛋白响应低温胁迫或冷驯化,但其介导昆虫抗寒性功能的深入研究却鲜有报道。过冷却是指植物或昆虫的组织液可以承受0℃以下的低温而不结冰的现象(Andreadis and Athanassiou, 2017),这是昆虫抵御低温而存活的方式之一(岳雷等, 2013; Andreadis and Athanassiou, 2017; Niuetal., 2020),过冷却点则是衡量昆虫抗寒性的重要指标。过冷却现象及过冷却点的测定在许多昆虫的诸多虫态中都有研究报道(黄聪等, 2014; Fengetal., 2016; Mohammadzadeh and Izadi, 2018; 许向利等, 2020),我们前期研究表明沙葱萤叶甲不同发育阶段的过冷却点均存在显著差异,过冷却点由低到高的发育阶段依次是卵、1龄幼虫、2龄幼虫、蛹、3龄幼虫及成虫(李浩等, 2014)。本研究通过对注射dsGdHsp60和dsGdHsp70后的沙葱萤叶甲2龄幼虫测定过冷却点和结冰点,结果显示均显著高于对照(图3),说明通过干扰GdHsp60和GdHsp70的表达确实可以降低沙葱萤叶甲2龄幼虫对寒冷的耐受性。对GdHsp60和GdHsp70基因干扰后的沙葱萤叶甲2龄幼虫进行低温处理,通过计算Ltemp50和Ltime50可以系统量化和表征致死温度、暴露时间和低温存活率之间的关系。结果显示RNAi分别干扰两个基因后实验组Ltemp50显著升高(表2),而Ltime50均显著低于对照组(表3),进一步表明分别干扰两个热激蛋白基因的表达均可降低沙葱萤叶甲幼虫的抗寒性。同时,对比结果可以看出GdHsp70基因被干扰后可能对沙葱萤叶甲幼虫的抗寒性影响更大,注射dsGdHsp60和dsGdHsp70 24 h后过冷却点、结冰点存在显著性差异,但是对2龄幼虫Ltime50和Ltemp50的影响不存在显著差异,之后将进一步验证两个基因之间抗寒功能的相关性和差异。
本研究通过不同方法导入靶向dsRNA检测基因表达量变化,发现与饲喂法相比,采用显微注射法将dsRNA导入沙葱萤叶甲幼虫体内,对GdHsp60和GdHsp70基因表达有更强的干扰效果,可作为开展沙葱萤叶甲幼虫RNAi的主要干扰方法。随后对目标基因沉默后的幼虫进行了过冷却点、结冰点、Ltemp50及Ltime50的测定,发现分别干扰两个热激蛋白基因显著降低了抗寒能力。本文首次通过RNAi实验研究沙葱萤叶甲Hsp相关基因的抗寒性功能,这对深入探索昆虫抗寒性的分子机制有重要参考价值,也为采用RNAi进行沙葱萤叶甲的防控提供潜在的新靶标。
猜你喜欢
杂志排行
昆虫学报的其它文章
- Morphological differentiation in the Asian honey bees (Apis cerana) in China
- 我国余甘子新害虫锡兰玻壳蚧的形态及生物学特性
- 贝氏小奥林螨连续饲养的草栖钝绥螨生命表参数和捕食能力
- 施药后不同时间玉米田中常用农药残留对玉米螟赤眼蜂的影响
- Inhibition of glucose oxidase gene decreases the resistance of Mythimna separata (Lepidoptera: Noctuidae) larvae to Bacillus thuringiensis infection
- 枣食芽象甲化学感受蛋白PyasCSP4的基因克隆、表达及配体结合特征
