Tc17细胞及相关细胞因子在银屑病样皮炎模型小鼠中的表达*
2022-08-12张平俞莺胡枫陈宏翔
张平,俞莺,胡枫,陈宏翔
(1.武汉市第一医院皮肤科,武汉 430022;2.华中科技大学同济医学院附属同济医院风湿免疫科,武汉 430030;3.华中科技大学同济医学院附属协和医院皮肤科,武汉 430022)
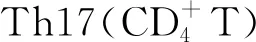
1 材料与方法
1.1实验动物 6~8周龄无特定病原体(SPF)级BALB/c雄性小鼠,体质量18~22 g,由三峡大学实验动物中心提供,实验动物生产许可证号:SCXK(鄂)2017-0012,实验动物合格证号:No.42010200006609。饲养条件:恒温23 ℃,相对湿度50%~60%;昼夜各12 h交替,小鼠自由摄取食物饮水。
1.2材料与仪器 转移缓冲液Transcription Factor Buffer Set(BD PharmingenTM,批号:562574);小鼠外周血淋巴细胞分离液试剂盒(天津灝洋生物制品科技有限公司,批号:LTS1092);BD培养基(佛波酯50 ng·mL-1、离子霉素500 ng·mL-1、莫能霉素1 μg·mL-1,上海金畔生物科技有限公司),APC anti-mouse IL-17A抗体(美国Biolegend公司,批号:506915);FITC anti-mouse CD4 抗体(美国Biolegend公司,批号:100405);PE anti-mouse CD3 抗体(美国Biolegend公司,批号:100205);流式细胞仪(美国Beckmancoulter公司,型号:CytoFLEX);低速离心机(德国Eppendorf,型号:5702R)。总RNA提取试剂(Trizol,Ambion公司,批号:15596-026);SYBR Green Master Mix(南京诺唯赞生物科技有限公司,批号:Q111-02);Taq Plus DNA 聚合酶[天根生化科技(北京)有限公司,批号:ET105-01];DL2000 DNA Marker[天根生化科技(北京)有限公司,批号:MD114-02];焦碳酸二乙酯(diethy pyrocarbonate,DEPC,北京索莱宝科技有限公司,批号:R1600);实时荧光定量PCR仪[美国Applied Biosystems(ABI)公司,型号:QuantStudio 6]。5%咪喹莫特(imiquimod,IMQ)软膏(湖北科益药业股份有限公司,批号:210801)。
1.3动物分组与模型的建立 取小鼠20只,适应性喂养1周,采用随机数字表法分为模型组与正常对照组各10只。两组均刮除背部皮毛,裸露部位皮肤面积3 cm×3 cm,裸露部位每天9:00局部给药,摄影记录皮肤变化。模型组皮肤涂抹5%IMQ软膏60 mg·d-1,连续7 d,制备银屑病样皮炎模型;正常对照组不处理。银屑病样皮炎小鼠成模标准参照文献[5],银屑病面积与严重度指数(psoriasis area and severity index,PASI)评分0~4分。红斑:无,0分;淡红,1分;红色,2分;深红,3分;紫红,4分。鳞屑:无,0分;局部细薄鳞屑,1分;多数皮损表面片状鳞屑,2分;几乎全部皮损表面较厚鳞屑,3分;全部皮损表面很厚鳞屑堆积,4分。皮肤增厚:无,0分;略高于正常皮肤,1分;中等程度隆起,2分;明显肥厚隆起,3分;高度肥厚、隆起极为明显,4分。三项积分之和为累积得分。
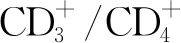
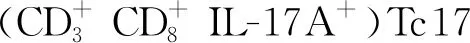

表1 引物序列
2 结果
2.1成模情况 见图1。连续涂抹5%IMQ软膏7 d,模型组小鼠背部皮肤逐渐形成浸润性暗红斑片,表面覆着成层白色鳞屑,皮肤厚度增加;第3天和第7天平均PASI评分分别为4.8和9分;组织切片苏木精-伊红(HE)染色(×400)显示表皮角化过度,棘层增厚,皮突延长,真皮浅层血管增生、扩张及炎性细胞浸润;HE染色(×100)见表皮增厚,真皮浅层毛细血管扩张,真皮深层及皮下组织内见较多圆形、椭圆形毛囊断面。正常对照组小鼠背部皮肤光滑平整。
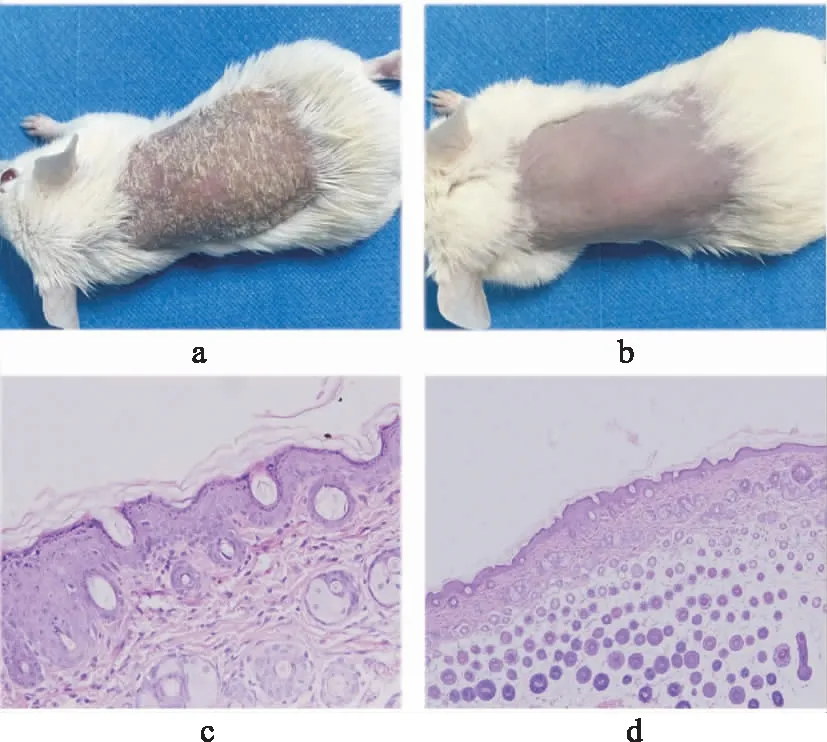
a.模型组;b.正常对照组;c.模型组HE染色(×400);d.模型组HE染色(×100)。
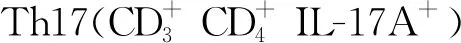
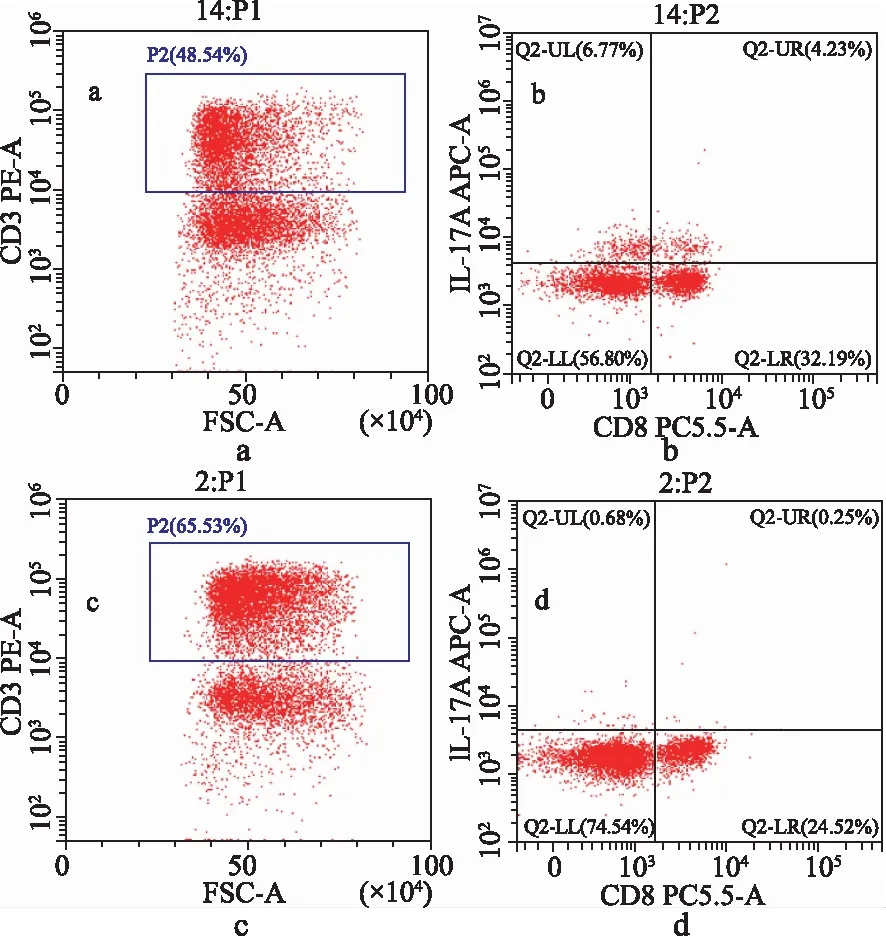
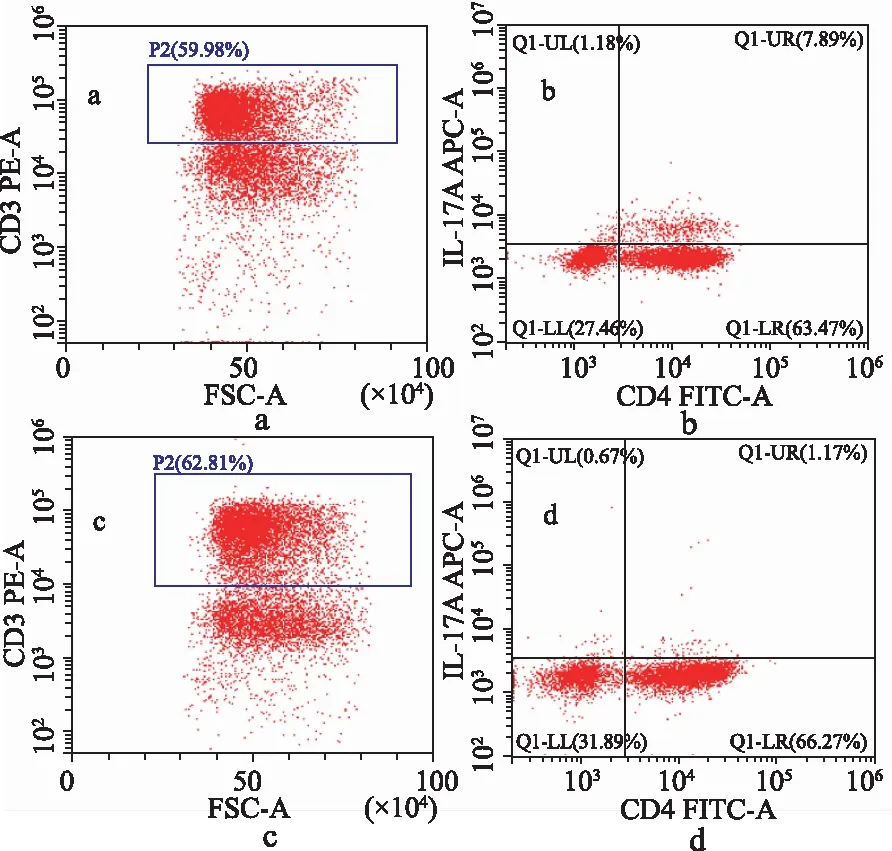
a.模型组总细胞(蓝色方框);b.模型组细胞(右上象限);c.正常对照组总细胞;d.正常对照组细胞。
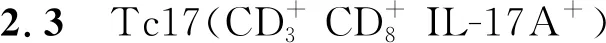
a.模型组总细胞;b.模型组细胞;c.正常对照组总细胞;d.正常对照组细胞。
2.4Tc17细胞相关细胞因子表达水平 见图4。以2-ΔΔCt法计算相对表达量,与正常对照组比较,模型组流式分选收集的Tc17细胞中IL-17A与RORγt表达水平显著增高,分别为(3.13±0.49)[正常对照组(0.95±0.21),t=-9.05,P<0.01]和(3.35±0.22)[正常对照组(1.09±0.27),t=-14.51,P<0.01]。模型组Tc17细胞IL-22及STAT3表达量分别为(2.41±0.22)[正常对照组(1.11±0.10),t=-12.21,P<0.01]和(2.02±0.40)[正常对照组(0.89±0.17),t=-5.78,P<0.01]。
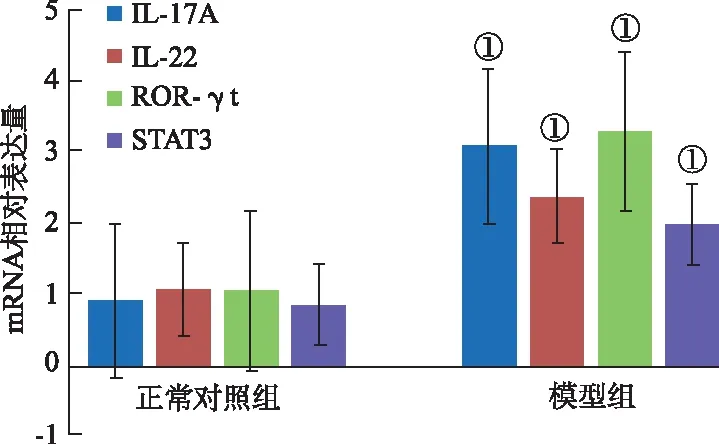
①与正常对照组比较,P<0.01。
3 讨论
银屑病发病机制复杂,固有免疫和适应性免疫均参与其中。动物模型的建立为研究其潜在发病机制和开展药物治疗提供了有利平台。本研究结果显示,5%IMQ软膏诱导形成银屑病样皮炎小鼠模型与寻常型银屑病患者的皮损表现和组织病理改变相似程度高,外用IMQ第3天皮肤出现浸润性暗红斑片,PASI评分平均值4.8分;第7天皮损明显增厚,面积扩大,表面片状鳞屑增多,PASI评分平均值9分,说明银屑病样皮炎小鼠皮肤模型造模成功。银屑病动物模型主要有诱导性、自发突变性、转基因及异体移植模型[6]。诱导模型常见有药物涂抹在动物如豚鼠、小鼠皮肤上诱发银屑病样增生;自发性包括鳞片状皮肤突变鼠、慢性增殖性皮炎或缺皮脂突变鼠等。各类模型均不能全面反映银屑病的发生发展过程,诱导动物模型能引起免疫调控因子变化,并促使炎性反应及损伤发生。IMQ是Toll样受体激动剂,可通过刺激TLR7/8激活天然免疫并进一步激发适应性免疫。研究表明[7],IMQ诱导的皮炎部分依赖于T细胞的存在,在IL-23或IL-17受体缺失的小鼠,疾病发展几乎完全受阻,IL-23/IL-17轴在银屑病样皮炎发病机制中发挥关键作用。
本实验结果提示,Tc17细胞参与银屑病样皮肤炎症过程,且Tc17与Th17细胞促进银屑病发病的部分信号通路相似。本实验初步分析了银屑病样小鼠血液中Tc17细胞比例及其表达相关细胞因子状况,尚缺乏Tc17和Th17细胞相互关系的研究及Tc17细胞亚型的深入分类。在不同免疫病理状态下,免疫细胞可分化为不同类型的亚群,Tc17细胞在特定极化条件下,还可向Tc1亚群转化,深入研究 Tc17的功能和分化机制,可为进一步探索银屑病的复杂机制提供新思路。
