TLR-4/MyD88通路激活和小胶质细胞极化在氧化低密度脂蛋白导致的小鼠视网膜损伤中的作用△
2022-08-12杨名珠周庆儒邱瑞琪
李 雷 杨名珠 周庆儒 邱瑞琪 雷 博
年龄相关性黄斑变性(AMD)是世界范围内50岁以上人群视力损害的主要原因,AMD的发病率随着年龄的增长而增加。据估计,到2040年,全球AMD患者的数量将达到3亿[1]。目前,临床上认为慢性炎症、氧化损伤和内质网应激是导致AMD的主要原因[2]。脂质,如胆固醇、三酰基甘油和低密度脂蛋白(LDL),在视网膜变性中起着重要的作用,特别是在AMD发展的早期和中期阶段[3]。氧化低密度脂蛋白(ox-LDL)是LDL的氧化修饰产物,不能通过LDL受体途径代谢[4]。ox-LDL改变了脂质代谢、氧化应激、炎症以及细胞凋亡相关基因的转录,可能与AMD的发病机制有关[5]。
在哺乳动物的视网膜中有三种胶质细胞:Müller细胞、星形胶质细胞和小胶质细胞。其中,小胶质细胞是视网膜的常驻巨噬细胞,其在中枢神经系统和视网膜疾病的发生发展中起着重要作用[6]。像外周血中的单核细胞一样,小胶质细胞活化后可以极化为两种主要亚型:“经典激活”的M1型和“选择性激活”的M2型,M1型主要起到促进炎症发生的作用,M2型主要与抑制炎症和修复有关。M1型和M2型细胞的数量变化可以引起不同的反应,在AMD患者中,最初以M2型细胞为主,起到炎症修复的作用,随着病情进展,促炎因子增多使得M1型细胞增多,炎症反应扩大[7]。
Toll样受体-4(TLR-4)是Toll样受体家族中的一员,在调节炎症反应中发挥重要作用,它可以激活下游MyD88和TRIF两个不同的信号通路[8]。其中,MyD88可以增加核转录因子(NF)-κB的表达[9]。我们先前的研究发现,ox-LDL可以导致视网膜发生炎症反应和新生血管形成[5]。抗血管内皮生长因子(VEGF)治疗是目前临床实践中治疗AMD的主要方法,但部分患者疗效不佳[10]。因此,更好地了解AMD的早期发病机制是找到新的治疗方法的必要条件。本研究的目的是探讨ox-LDL诱导的视网膜形态和功能损伤是否和TLR-4/MyD88通路激活以及小胶质细胞极化相关。
1 材料与方法
1.1 主要仪器与试剂扫频源光学相干断层扫描仪(视微影像科技有限公司,河南),视觉电生理仪(艾尔曦医疗设备有限公司,重庆),双光子激光共聚焦显微镜(蔡司公司,德国)。人源ox-LDL(奕源生物技术公司,广州),反转录试剂盒(Takara 生物技术有限公司,北京),TUNEL检测试剂盒、4,6-二氨基-2-苯基吲哚(DAPI)(碧云天生物技术有限公司),β-actin (CST 公司,美国),离子钙结合适配器分子1(Iba-1)抗体(Abcam公司,美国),TLR-4抗体(Santa Cruz公司,美国),二抗(MILLIPORE 公司,美国),iNOS抗体、CD206抗体(赛维尔生物科技有限公司,武汉),MyD88抗体、荧光二抗(Cell Signaling Technology公司,美国),BCA蛋白试剂盒(Beyotime,上海)。
1.2 动物实验
1.2.1 实验动物与分组8周龄雄性C57BL/6小鼠(杰克森实验室,美国)40只,体重(19±1) g,维持12 h/12 h 的光-暗循环,并提供充足的食物和水。实验中尽量减少动物的不安和不适。随机分为实验组和对照组两组,每组各20只,均以右眼为实验眼。所有涉及动物的实验程序都按照ARVO关于在眼科和视觉研究中使用动物的声明进行。
1.2.2 视网膜下注射实验组小鼠右眼视网膜下注射1 μL ox-LDL,对照组小鼠右眼视网膜下注射1 μL 磷酸盐缓冲液(PBS)。ox-LDL浓度根据课题组前期实验结果设置为100 mg·L-1[7]。小鼠腹腔注射体积分数1.25%三溴乙醇麻醉,复方托吡卡胺滴眼液散瞳。使用30号胰岛素针的针头在巩膜的锯齿缘下方穿刺造孔,将32号汉密尔顿注射器插入孔内,注意避免损伤晶状体,在解剖显微镜下将1 μL ox-LDL或PBS注射到视网膜下间隙,以注射区域看到视网膜下水泡样脱离表明注射成功。所有动物均使用左氧氟沙星眼膏涂眼预防感染,注射后每日观察。
1.2.3 OCT检测视网膜下注射 2周后,两组各随机取10只小鼠,同1.2.2方法麻醉、散瞳后行OCT检查,记录视神经外1个视盘直径距离的视网膜外核层(ONL)和内核层(INL)厚度。根据文献[11],使用视网膜ONL与INL的比值作为评价光感受器损伤情况的指标。
1.2.4 ERG检测视网膜下注射2周后,两组各随机取10只小鼠适应黑暗环境过夜。第2天,同1.2.2方法麻醉、散瞳后行ERG检测,所有操作均在暗红光下进行。暗适应刺激强度为从-3~1 log cd·s·m-2,明适应刺激强度为0 log cd·s·m-2和1 log cd·s·m-2,记录a波和b波的振幅。
1.2.5 小鼠视网膜qPCR检测视网膜下注射 2周后,两组各随机取10只小鼠颈椎脱位法处死,取右眼,分离出视网膜并匀浆。用Trizol试剂从视网膜中提取总RNA,反转录试剂盒将RNA反转录为cDNA。用 SYBR Green Master Mix 对得到的cDNA进行扩增,β-actin 为内参。反应程序为50 ℃ 2 min,之后95 ℃ 2 min 40个循环,95 ℃ 15 s和60 ℃ 1 min。实验重复3次。使用 2-ΔΔCt对数据进行处理。引物序列: Iba-1上游引物为5’-GATTTGCAGGGAGGAAAAGCT-3’,下游引物为5’-AACCCCAAGTTTCTCCAGCAT-3’;TLR-4上游引物为5’-GCCGTTGGTGTATCTTTG-3’, 下游引物为5’-GCTGTTTGCTCAGGATTC-3’;MyD88:上游引物为5’-AACAGAAGCGACTGATTCC-3’,下游引物为5’-TCATTGAACACGGGTTGAG-3’;CD206 上游引物为5’-CTCTGTTCAGCTATTGGACGC-3’,下游引物为5’-CGGAATTTCTGGGATTCAGCTTC-3’;iNOS 上游引物为5’-CAAGCACCTTGGAAGAGGAG-3’,下游引物为5’-AAGGCCAAACACAGCATACC-3’;β-actin:上游引物为5’-ATCACTGCCACCCAGAAG-3’,下游引物为5’-TCCACGACGGACACATTG-3’。
1.2.6 小鼠视网膜Western blot检测视网膜下注射 2周后,两组各随机取4只小鼠颈椎脱位法处死,取右眼,分离出视网膜并匀浆,用含有10 g·L-1蛋白酶抑制剂的RIPA裂解缓冲液在冰上裂解30 min,4 ℃ 12 000 r·min-1离心15 min,收集上清。BCA蛋白试剂盒测定蛋白浓度。样品用5×SDS上样缓冲液稀释,100 ℃煮沸5 min。等量的总蛋白在135 g·L-1的SDS-聚丙烯酰胺凝胶上分离,转移到聚偏二氟乙烯膜上。用体积分数5%脱脂牛奶封闭膜1.5 h,4 ℃下分别与Iba-1(1200)、TLR-4(1400)、MyD88(1100)一抗孵育过夜,二抗(110 000)在室温下轻轻摇动PVDF膜2 h。ECL试剂盒显影曝光,使用ImageJ软件分析,以β-actin为参照。实验重复3次。
1.2.7 小鼠视网膜免疫荧光染色检测视网膜下注射2周后,两组各取剩余的6只小鼠颈椎脱位法处死,摘出右眼,室温下用40 g·L-1多聚甲醛固定 4 h,然后用不同浓度的蔗糖溶液在4 ℃下脱水。在冰冻切片机上通过角膜-视神经轴线切厚6 μm的连续切片。阻断液为以PBS为溶剂的50 g·L-1牛血清白蛋白和体积分数0.3%的Triton X-100。洗涤液以体积分数0.1% Tween 20溶解在PBS中制备。将载玻片放置在暗盒中,室温下加入阻断液1 h。一抗Iba-1(1200)、iNOS(1200)、CD206(1200)4 ℃下过夜,室温下加入荧光结合的二抗(15000)1 h。
1.2.8 小鼠视网膜TUNEL染色检测TUNEL染色按照试剂盒说明书进行,取1.2.7切片,在室温下用4,6-二氨基-2-苯基吲哚对细胞核染色。在相同的曝光和增益条件下获得图片,用ImageJ软件分析。
1.3 细胞实验
1.3.1 细胞的培养与分组人视网膜色素上皮(RPE)细胞系ARPE-19细胞购自美国模式菌种收集中心(ATCC,Manassas,VA,美国)。使用含体积分数10%胎牛血清、10 g·L-1青霉素和链霉素的DMEM/F12培养基,置于37 ℃、体积分数5% CO2培养箱中培养。随机分为ox-LDL组(培养基中加入100 mg·L-1ox-LDL处理24 h)和PBS组(培养基中加入等体积的PBS处理24 h)。
1.3.2 ARPE-19细胞的qPCR检测ox-LDL组和PBS组ARPE-19细胞分组处理24 h后,2.5 g·L-1胰蛋白酶消化,离心,收集细胞后,行RNA的提取、反转录以及扩增,方法同动物实验。引物序列:TLR-4上游引物为5’-AGACCTGTCCCTGAACCCTAT-3’,下游引物为5’-CGATGGACTTCTAAACCAGCCA-3’;MyD88上游引物为5’-CTAAGAAGGACCAGCAGAG-3’,下游引物为5’-GAAGCATCAGTAGGCATCA-3’;β-actin上游引物为5’-TCACTATTGGCAACGAGCGGTTC-3’,下游引物为5’-CTCCTGCTTGCTGATCCACATCTG-3’。实验重复3次。
1.3.3 ARPE-19细胞的Western blot检测细胞分组处理24 h后,PBS洗涤2次,用含有1 g·L-1蛋白酶抑制剂的RIPA裂解缓冲液在冰上裂解30 min,余方法同动物实验,其中一抗为TLR-4(1400)、MyD88(1100)。使用ImageJ软件分析,β-actin为参照。实验重复3次。
1.3.4 ARPE-19细胞的TUNEL染色ARPE-19细胞分组处理24 h后, PBS清洗,于40 g·L-1多聚甲醛中固定30 min。再次PBS清洗后,在黑暗条件下用含有体积分数0.1% Triton X-100的冷PBS孵育细胞2 min。TUNEL反应缓冲液在37 ℃加湿室中避光孵育细胞1 h,PBS洗3次。荧光显微镜下拍照,ImageJ软件分析。
1.4 统计分析结果用均数±标准差表示,采用GraphPad Prism 7软件进行统计分析。ERG数据采用双因素方差分析和Bonferroni校正,其余结果用非配对t检验进行分析。检验水准:α=0.05。
2 结果
2.1 ox-LDL提高小鼠视网膜中TLR-4和MyD88表达小鼠视网膜下注射2周后,qPCR和Western blot检测结果显示, 与对照组相比,实验组小鼠视网膜中TLR-4和MyD88的mRNA和蛋白表达水平均升高(均为P<0.01)(图1)。

图1 qPCR和Western blot检测两组小鼠视网膜中TLR-4和MyD88的mRNA和蛋白表达 A:qPCR检测结果(**P<0.01,***P<0.001);B:Western blot检测结果。
2.2 ox-LDL激活小鼠视网膜小胶质细胞小鼠视网膜下注射2周后,qPCR和Western blot检测结果显示,与对照组相比,实验组小鼠视网膜中Iba-1的mRNA和蛋白表达水平均显著升高(均为P<0.05)。免疫荧光染色检测结果显示,与对照组相比,实验组小鼠Iba-1阳性细胞数显著增加(图2)。

图2 qPCR、Western blot和免疫荧光染色检测两组小鼠视网膜中Iba-1的mRNA和蛋白表达 A:免疫荧光染色结果;B:qPCR检测结果(**P<0.01);C:Western blot检测结果。
2.3 ox-LDL诱导小胶质细胞M1极化视网膜下注射2周后,qPCR检测结果显示,与对照组相比,实验组小鼠视网膜中M1表型标志物iNOS的mRNA表达水平升高(P<0.001),而M2表型标志物CD206的mRNA表达水平变化不明显(P>0.05)。免疫荧光染色检测结果显示,与对照组相比,实验组iNOS阳性细胞增加,而CD206阳性细胞数无明显差异(图3)。
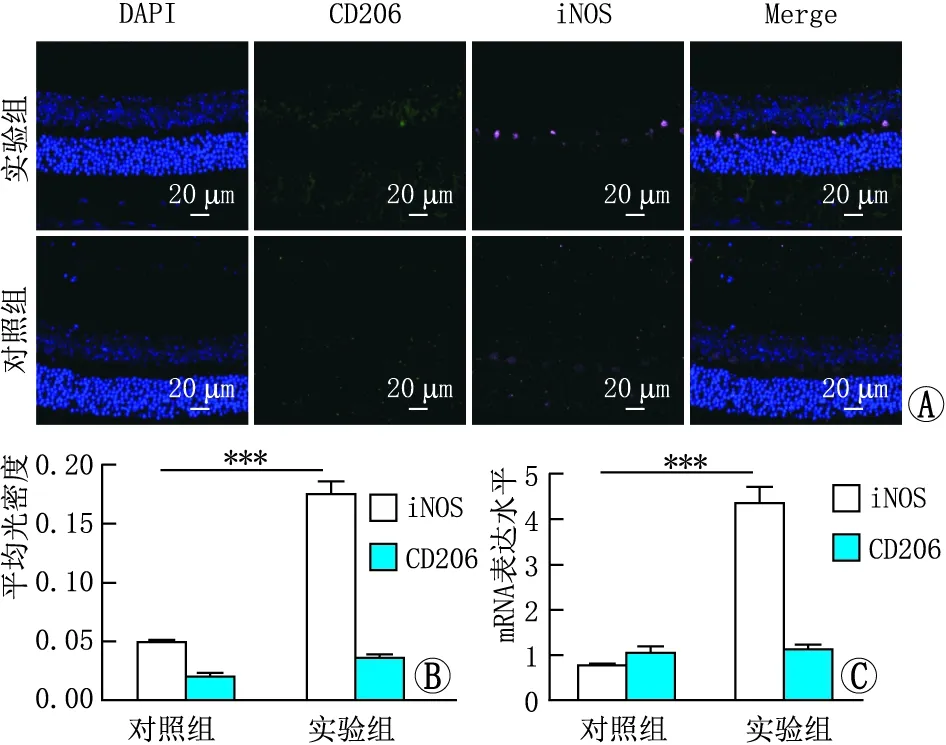
图3 qPCR和免疫荧光染色检测两组小鼠视网膜中iNOS 和CD206的mRNA和蛋白表达 A:免疫荧光染色结果;B:免疫荧光染色结果的平均光密度分析(***P<0.001);C:qPCR检测结果(***P<0.001)。
2.4 ox-LDL损伤小鼠视功能ERG检测结果显示,与对照组相比,实验组小鼠视网膜的a波和b波振幅均明显下降(均为P<0.001)(图4)。

图4 ERG检测两组小鼠视网膜功能 A:ERG结果;B:暗适应a波振幅统计结果(***P< 0.001);C:明适应b波振幅统计结果(***P< 0.001);D:暗适应b波振幅统计结果(***P<0.001)。
2.5 ox-LDL损伤小鼠视网膜形态OCT检测结果显示,与对照组(4.0±0.2)相比,实验组(3.0±0.1)小鼠视网膜的ONL/INL比值下降(P<0.01)。TUNEL染色结果显示,与对照组相比,实验组小鼠视网膜中TUNEL染色阳性细胞数增加,细胞凋亡数量增加,且细胞凋亡主要发生在ONL(图5)。

图5 两组小鼠视网膜形态 A:OCT检测;B:TUNEL染色结果。
2.6 ox-LDL提高ARPE-19细胞TLR-4和MyD88表达并诱导细胞凋亡qPCR和Western blot检测结果显示,与PBS组相比,ox-LDL组ARPE-19细胞TLR-4和MyD88的mRNA和蛋白表达水平均明显升高(均为P<0.01)。TUNEL染色结果显示,与PBS组相比,ox-LDL组ARPE-19细胞的TUNEL染色阳性细胞数显著增加(图6)。
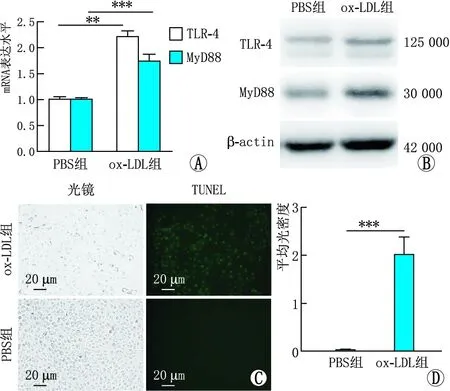
图6 两组ARPE-19细胞凋亡及TLR-4和MyD88的mRNA和蛋白表达情况 A:qPCR检测结果(**P< 0.01,***P<0.001);B:Western blot检测结果;C:TUNEL染色结果;D:TUNEL染色结果分析(***P<0.001)。
3 讨论
ox-LDL引起小胶质细胞的激活与AMD的炎症和发病机制有关[12-13]。本研究参考文献[5]的报道,使用ox-LDL处理ARPE-19细胞和小鼠,以模拟AMD的病理过程,分析其中可能的机制,结果显示,ox-LDL可活化小胶质细胞,诱导其向促进炎症发生的M1型极化,并引起光感受器细胞凋亡和视功能障碍;ox-LDL导致的视网膜损伤可能与TLR4/MyD88通路的激活有关。
在之前的研究中我们发现,ox-LDL可以通过激活P2X7R/NLRP3/caspase-1通路上调炎症因子白细胞介素1β(IL-1β)的表达,并增加NF-κB的表达,说明ox-LDL可以引起视网膜炎症反应[5]。本实验中,我们用ox-LDL处理ARPE-19细胞和C56BL/6小鼠进一步证明了NF-κB的激活可能与上游TLR-4/MyD88通路相关,推测该通路可能参与了AMD的发病。
炎症反应是AMD的重要发病因素,而小胶质细胞在此过程中发挥重要作用[12,14]。在正常情况下,小胶质细胞作为视网膜中的常驻免疫细胞位于丛状层,而在炎症状态下,小胶质细胞增殖并迁移至损伤部位。在急性炎症期,小胶质细胞活化引起的神经炎症可以促进神经保护和再生过程,并促进组织稳态的快速恢复。炎症持续的情况下,如视网膜退行性疾病,小胶质细胞会被病理性激活并释放大量的炎症介质,造成组织损伤和疾病恶化[15]。小胶质细胞在视网膜遗传性疾病、感染以及创伤时会引起视网膜神经节细胞和光感受器细胞的退化,小胶质细胞的激活与视网膜炎症和退行性疾病的发生发展密切相关[6]。我们在小鼠视网膜中检测了小胶质细胞激活的标志物Iba-1的表达,在视网膜下注射ox-LDL后,Iba-1阳性细胞的数量增加。
同外周循环的单核细胞相似,小胶质细胞在活化后发生极化反应,其极化后主要分为M1和M2两种亚型,M1型主要起到促进炎症发生的作用,M2型主要与抑制炎症和修复有关。一些促炎细胞因子,如IL-1β,可以激活并极化小胶质细胞为M1型[7]。既往研究表明,AMD小鼠模型和细胞模型中IL-1β的表达增加[5]。我们检测了小胶质细胞的极化情况,结果显示,视网膜下注射ox-LDL 2周后,小鼠视网膜中的小胶质细胞被激活并极化为M1型,我们推测活化的M1型小胶质细胞是ox-LDL引起炎症反应的重要一环,与之前的文献报道一致[14,16]。
ERG检测结果显示,无论是在暗适应还是明适应情况下,实验组小鼠视网膜的a波和b波振幅均显著下降。a波反映光感受器细胞的功能,b波反映双极细胞和Müller细胞的功能。OCT检测结果显示,与对照组相比,实验组小鼠视网膜ONL/INL比值显著下降。此外,TUNEL染色结果显示,实验组小鼠视网膜中细胞凋亡主要发生在ONL。结合ERG的结果, 我们推测ox-LDL主要损伤视网膜感光细胞层。
RPE层是光感受器和脉络膜毛细血管之间的代谢屏障,在维持视网膜功能中起着关键作用。另外,RPE细胞也会向视网膜下间隙中分泌数种抑制性细胞因子,维持视网膜免疫抑制状态[17]。RPE细胞损伤被认为是AMD的触发因素之一[18]。我们之前的研究表明,ox-LDL导致人RPE细胞中促炎因子和活性氧的增加[5]。因此,我们推测ox-LDL可能通过激活上游TLR-4/MyD88通路,进而激活NF-κB引发炎症反应[5]。NF-κB上调pro-IL-1β和NLRP3的转录,之后将NLRP3、pro-caspase-1和caspase招募域(ASC)组装为多蛋白复合物。P2X7R激活引起的K+外排能够激活这种多蛋白复合物,将pro-caspase-1转化为caspase-1。在caspase-1激活后,pro-IL-1β被裂解为IL-1β并分泌到细胞外,介导炎症反应[19-20]。RPE层的损伤和IL-1β等炎症因子的增加可能是使小胶质细胞被激活并极化为M1型的重要原因。而M1型小胶质细胞会进一步促进多种炎症因子释放,如IL-1β和肿瘤坏死因子-α,加重炎症反应[7]。此外,M1型小胶质细胞高表达iNOS,诱导细胞产生大量一氧化氮,从而导致代谢性缺氧和活性氧的释放[21]。这些结果也与本课题组前期的实验结论相一致[5]。
本研究提供了ox-LDL可能激活视网膜中TLR4通路和活化小胶质细胞的证据,但仍存在悬而未决的问题。TLR-4是脂多糖的结合靶点,虽然有报道ox-LDL受体LOX-1与TLR-4的激活呈正相关[22],但其具体调控机制尚不清楚,值得进一步研究。
综上,我们发现ox-LDL引起的视网膜功能和形态的损伤可能与激活TLR-4/MyD88通路,并导致小胶质细胞活化和极化为M1表型有关。本研究加深了对ox-LDL介导的视网膜炎症反应的了解,为深入认识AMD的发病机制提供了实验依据。
