地黄多糖对过氧化氢诱导的人晶状体上皮细胞氧化损伤的保护作用△
2022-08-12罗丽丹李达佑曹玲英刘婷婷
罗丽丹 李达佑 钟 华 曹玲英 刘婷婷
白内障是由于老化作用而导致晶状体混浊所引起的眼部疾病,常发生于65岁以上老年人,当病情进展到最后阶段时会导致患者失明[1]。手术为当前治疗白内障的有效策略,由于患者多为老年人,手术治疗出现并发症的风险较高。因此,了解白内障的发病机制,有利于寻找药物预防白内障的发展,减轻白内障致盲的风险。晶状上皮细胞氧化损伤是白内障病情进展的病理学基础。以往的研究多聚焦于人晶状体上皮细胞(HLEC)中活性氧(ROS)引起的蛋白质氧化、DNA损伤、脂质过氧化损伤及其引起的细胞凋亡[2]。研究显示,ROS也可激活细胞焦亡信号参与白内障的发生[3]。焦亡发生时,NOD样受体蛋白3(NLRP3)与凋亡相关斑点样蛋白和caspase-1前体组成炎症小体复合物,响应环境和细胞应激,剪切并激活自身蛋白酶caspase-1,从而导致切割消皮素D(GSDMD)激发细胞膜穿孔,诱导细胞损伤。地黄为治疗白内障的中药方剂所含的共有成分,如杞菊地黄丸[4]、六味地黄汤加减方[5]等,地黄多糖是地黄的重要活性成分,具有较强的抗氧化能力[6]。然而,地黄多糖对HLEC氧化损伤的作用机制尚不明确。本研究采用过氧化氢(H2O2)诱导HLEC建立细胞氧化损伤模型,探讨地黄多糖对HLEC氧化损伤及焦亡的调控作用,以期为白内障的治疗提供新思路。
1 材料与方法
1.1 材料B-3细胞(HLEC)、EMEM培养基(美国ATCC公司),地黄多糖(四川维克奇生物公司),H2O2、青霉素、链霉素、羧甲基纤维素钠(美国Sigma公司),ROS试剂盒(上海碧云天生物技术有限公司),白细胞介素(IL)-1β和IL-18 ELISA试剂盒、丙二醛(MDA)比色试剂盒、CCK-8试剂盒、胎牛血清(上海生工生物工程有限公司),NLRP3、caspase-1、pro-caspase-1、GSDMD、GAPDH抗体和HRP二抗(英国Abcam公司),GSDMD-N抗体和荧光二抗(美国Affinity公司)。
1.2 方法
1.2.1 细胞培养取B-3细胞接种于含青霉素(100 U·L-1)、链霉素(100 mg·L-1)的双抗及体积分数20%胎牛血清的EMEM培养基中,置于37 ℃含体积分数5%CO2恒温培养箱中培养,每2 d更换1次培养液。
1.2.2 H2O2和地黄多糖作用浓度的筛选取对数生长期的B-3细胞接种于96孔板(每孔5×103个细胞),每个浓度设6个复孔,进行如下实验:(1)分别使用含0 mol·L-1、12.5 mol·L-1、25.0 mol·L-1、50.0 mol·L-1、100.0 mol·L-1、200.0 mol·L-1、400.0 mol·L-1、800.0 mol·L-1H2O2的培养基处理B-3细胞24 h,加入10 μL CCK-8溶液培养2 h,测定450 nm下光密度(D450),计算细胞活力,筛选细胞活力为50%左右时的H2O2浓度进行后续实验。(2)分别使用含0 mg·L-1、2.5 mg·L-1、5.0 mg·L-1、10.0 mg·L-1、20.0 mg·L-1、40.0 mg·L-1、80.0 mg·L-1、160.0 mg·L-1地黄多糖的培养基处理B-3细胞24 h,CCK-8法同上,检测并计算细胞活力,筛选无毒剂量。(3)分别使用含0 mg·L-1、2.5 mg·L-1、5.0 mg·L-1、10.0 mg·L-1、20.0 mg·L-1、40.0 mg·L-1地黄多糖的培养基预处理B-3细胞24 h,随后换为含100 mol·L-1H2O2的培养基培养24 h,CCK-8法同上,检测并计算细胞活力,筛选地黄多糖抑制H2O2致B-3细胞损伤的最佳作用浓度。
1.2.3 细胞分组依据筛选的地黄多糖抑制H2O2致B-3细胞损伤的最佳作用浓度处理细胞,将B-3细胞分为:空白组、H2O2组和地黄多糖组。空白组:用10 g·L-1羧甲基纤维素钠预处理细胞24 h后,换为EMEM培养基培养24 h;H2O2组:用10 g·L-1羧甲基纤维素钠预处理细胞24 h后,换为含100 mol·L-1H2O2的EMEM培养基培养24 h;地黄多糖组:用含40 mg·L-1地黄多糖的培养基预处理细胞24 h后,换为含100 mol·L-1H2O2的EMEM培养基培养24 h。
1.2.4 细胞焦亡情况观察取对数生长期的B-3细胞接种在放有盖玻片的24孔板中,分组处理后,培养至细胞爬片,取玻片先后经PBS浸洗3次、40 g·L-1多聚甲醛固定20 min、山羊血清封闭25 min、一抗(GSDMD-N,1200)孵育过夜、Cy3标记荧光二抗(1500)避光孵育45 min,最后封片,在荧光显微镜下采集图像并分析。另外,将PBS浸洗后的玻片,依次经10 g·L-1锇酸固定1 h、乙醇逐步脱水、干燥、真空喷镀金属化处理后在扫描电镜下采集图像。
1.2.5 细胞ROS水平和MDA含量检测将B-3细胞分组处理后,换用含10 mol·L-1DCFH-DA的无血清培养基培养20 min,离心收集细胞,制备密度为1×106个·mL-1的单细胞悬液,上流式细胞仪检测ROS水平。另外收集细胞裂解液,离心取上清,按照体积比12加入MDA检测工作液,测定D530,计算MDA含量。
1.2.6 培养液中IL-1β、IL-18含量检测收集各组培养液,离心取上清,依次加入IL-1β、IL-18 ELISA试剂盒中各试剂,测定D450,计算IL-1β、IL-18含量。
1.2.7 NLRP3/caspase-1途径相关蛋白表达水平检测Western blot检测各组B-3细胞NLRP3/caspase-1通路蛋白表达水平。收集各组细胞(1×106个),提取总蛋白并测定浓度。取20 g蛋白样品煮沸变性后上样,电泳分离各蛋白并转膜,随后将PVDF膜与5 g·L-1脱脂奶粉室温封闭1 h,加一抗(NLRP3、caspase-1、GSDMD-N、pro-caspase-1、GSDMD、GAPDH,1500)孵膜过夜,HRP二抗(12000)孵膜1 h,最后用化学发光液显影,采集图像并分析。
1.3 统计学分析采用统计学软件SPSS 25.0和GraphPad 8.0分析数据,计量数据以均数±标准差描述,并用单因素方差分析和SNK-q检验进行比较。检验水准:α=0.05。
2 结果
2.1 筛选合适的H2O2和地黄多糖作用浓度
2.1.1 筛选合适的H2O2诱导浓度细胞活力检测结果显示,B-3细胞存活率随H2O2作用浓度增加逐渐降低,其中100 mol·L-1H2O2诱导24 h后,B-3细胞存活率为(50.48±8.05)%,接近半数抑制浓度(100.60 mol·L-1),故采用100 mol·L-1H2O2诱导24 h建立B-3细胞氧化损伤模型(图1)。
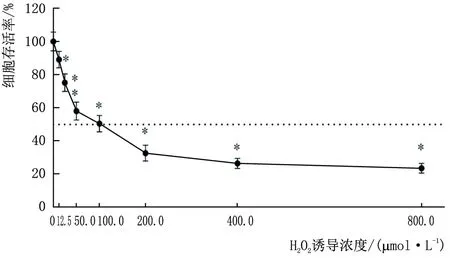
图1 不同浓度H2O2诱导后B-3细胞存活率 与0 mol·L-1 H2O2相比,*P<0.05。
2.1.2 筛选地黄多糖最佳作用浓度经计算,地黄多糖的半数抑制浓度为133.10 mg·L-1,与0 mg·L-1地黄多糖相比,2.5 mg·L-1、5.0 mg·L-1、10.0 mg·L-1、20.0 mg·L-1、40.0 mg·L-1地黄多糖干预对B-3细胞存活率无明显影响,差异均无统计学意义(均为P>0.05),即为无毒剂量(图2)。
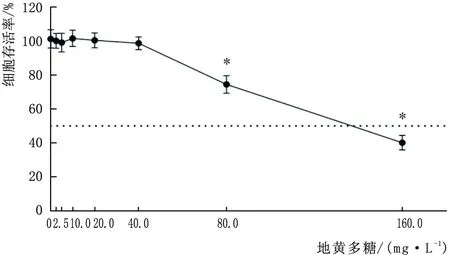
图2 不同浓度地黄多糖干预后B-3细胞存活率 与0 mg·L-1 地黄多糖相比,*P<0.05。
2.1.3 筛选地黄多糖抑制H2O2致B-3细胞损伤的最佳作用浓度与100 mg·L-1H2O+0 mg·L-1地黄多糖相比,2.5 mg·L-1、5.0 mg·L-1、10.0 mg·L-1、20.0 mg·L-1、40.0 mg·L-1地黄多糖干预后100 mol·L-1H2O2诱导损伤的B-3细胞存活率显著增高(均为P<0.05),后续采用40.0 mg·L-1地黄多糖干预24 h进行研究(图3)。
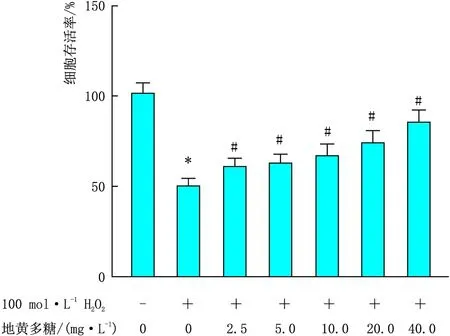
图3 地黄多糖抑制H2O2致B-3细胞损伤的最佳作用浓度 与0 mol·L-1 H2O2 + 0 mg·L-1 地黄多糖相比,*P<0.05;与100 mol·L-1 H2O2 + 0 mg·L-1 地黄多糖相比,#P<0.05。
2.2 扫描电镜及免疫荧光染色观察各组细胞焦亡情况扫描电镜结果显示:空白组细胞呈圆球形,边界规则;H2O2组细胞肿胀变大,边界不规则;地黄多糖组细胞肿胀程度减轻(图4)。与空白组[每视野(1.20±0.13)个GSDMD-N阳性(+)细胞]相比,H2O2组GSDMD-N+细胞数为每视野(15.33±1.25)个,GSDMD-N+细胞数显著增加(P<0.05);与H2O2组相比,地黄多糖组GSDMD-N+细胞数为每视野(5.33±0.46)个,GSDMD-N+细胞数显著减少(P<0.05)(图4)。

图4 扫描电镜及免疫荧光染色观察细胞焦亡情况 (扫描电镜:×5000;GSDMD-N免疫荧光染色:×400)
2.3 各组B-3细胞ROS水平和MDA含量检测结果与空白组相比,H2O2组B-3细胞ROS水平、MDA含量均显著增加(q=53.049、26.537,均为P<0.05);与H2O2组相比,地黄多糖组B-3细胞ROS水平、MDA含量均显著降低(q=46.997、17.233,均为P<0.05)(表1)。
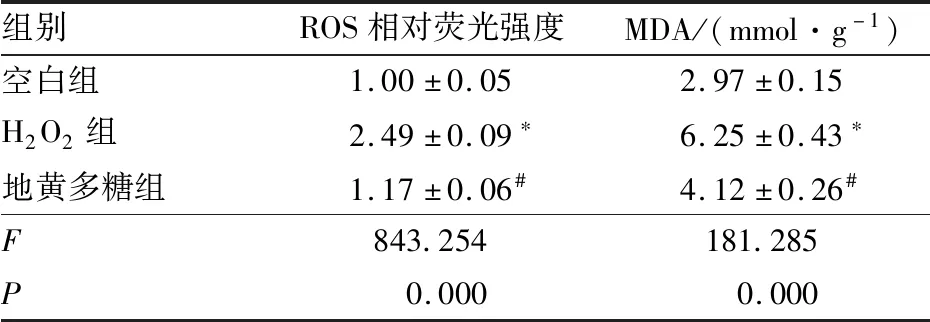
表1 各组B-3细胞ROS水平和MDA含量
2.4 各组培养液中IL-1β、IL-18含量与空白组相比,H2O2组培养液中IL-1β、IL-18含量均增加(q=35.136、28.992,均为P<0.05);与H2O2组相比,地黄多糖组培养液中IL-1β、IL-18含量均降低(q=20.694、11.618,均为P<0.05)(表2)。
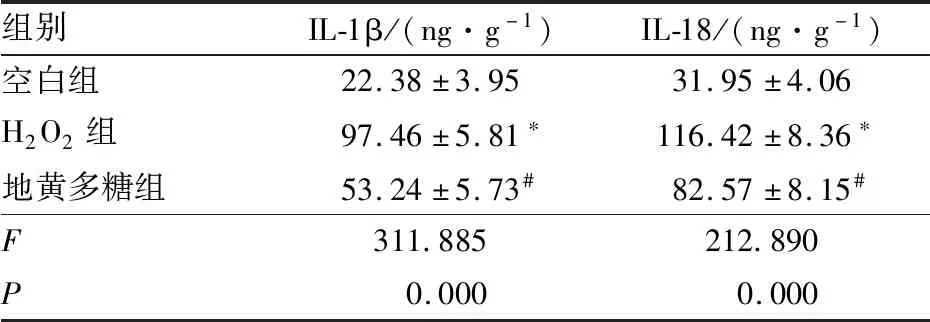
表2 各组培养液中IL-1β、IL-18含量比较
2.5 各组B-3细胞NLRP3/caspase-1通路活化情况与空白组相比,H2O2组B-3细胞NLRP3蛋白表达水平及caspase-1/pro-caspase-1、GSDMD-N/GSDMD均升高(q=36.908、17.285、17.926,均为P<0.05);与H2O2组相比,地黄多糖组B-3细胞NLRP3蛋白表达水平及caspase-1/pro-caspase-1、GSDMD-N/GSDMD均降低(q=28.963、11.907、11.951,均为P<0.05)(图5和表3)。
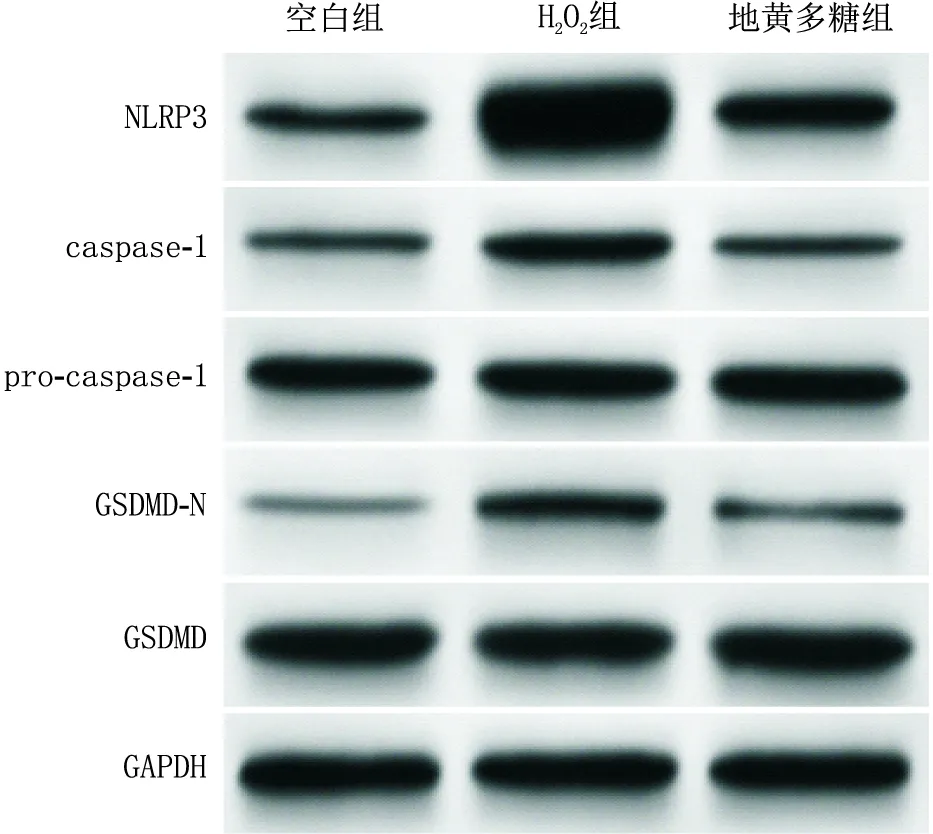
图5 Western blot检测各组B-3细胞NLRP3/caspase-1通路蛋白表达水平
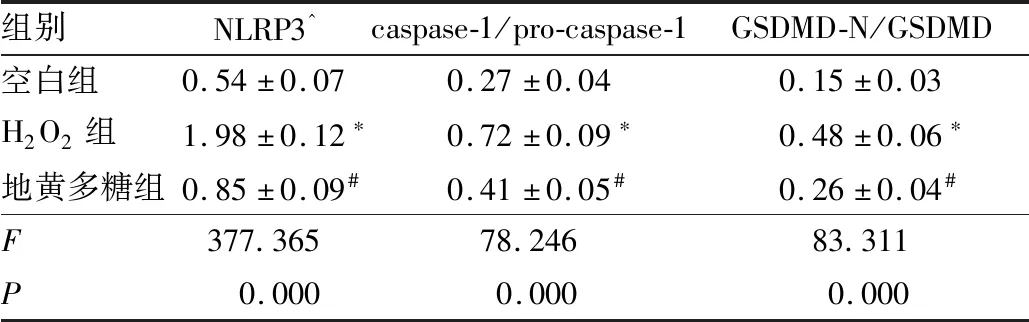
表3 各组B-3细胞NLRP3/caspase-1通路蛋白表达水平
3 讨论
近些年,白内障仍然是导致失明的主要眼病,其所造成的全球负担逐年增加[7-8]。HLEC中氧自由基的过量生成可引起细胞焦亡,最主要的特征是炎症因子释放[9]。本研究结果显示,H2O2诱导可明显降低B-3细胞活性,增加细胞内ROS水平、NLRP3蛋白表达水平和培养液中IL-1β、IL-18含量。而天然多糖类化合物地黄多糖具有抗氧化作用,能够减轻H2O2对B-3细胞造成的氧化损伤,同时下调NLRP3蛋白表达,并通过抑制pro-caspase-1的剪切活化,抑制GSDMD-N诱导的细胞穿孔和IL-1β等释放,进而抑制HLEC焦亡。这表明地黄多糖对H2O2诱导的B-3细胞具有抗氧化和抗焦亡作用。
氧化应激在白内障发病机制中起着关键作用[10]。衰老机体内抗氧化剂减少,ROS等氧化剂水平增多,导致细胞过氧化损伤、代谢紊乱、死亡[11]。本研究发现,在100 mol·L-1H2O2作用24 h后,B-3细胞ROS水平及MDA含量显著上升,细胞增殖活性明显降低。对中药方剂中的有效活性成分进行分析是提高中药认知度的重要策略,作为地黄的主要活性成分,地黄多糖的抗氧化作用被广泛关注。OU等[12]研究表明,地黄多糖可以增强抗氧化酶活性,减轻氧化损伤,从而发挥骨保护作用。彭辉等[13]研究显示,地黄多糖对缺氧/复氧下心肌细胞的氧化应激和凋亡有明显保护作用,可以增强抗氧化酶活性并抑制凋亡蛋白表达。本研究证实,地黄多糖干预后,B-3细胞中ROS水平及MDA含量降低,表明地黄多糖可以减轻HLEC因ROS水平升高而导致的氧化损伤,这可能与地黄多糖的保护作用有关。
细胞焦亡为一种新型程序性细胞死亡方式,已证实人体内存在经典和非经典焦亡途径,虽然启动信号不一致,但两种途径最终都通过形成NLRP3炎症小体活化caspase-1,进一步剪切、激活GSDMD,由其活性形式GSDMD-N与细胞膜中脂类结合,破坏膜的完整性,诱导细胞焦亡的发生[14-16]。研究表明,NLRP3炎症小体是在细胞对氧化应激等做出反应时所形成的,在白内障患者晶状体中会积累一定程度的caspase-1和IL-1β[17]。动物实验证明,LEC中caspase-1、caspase-11和GSDMD表达水平增加与晶状体透明度变差同步发生,且caspase-1抑制剂可减轻细胞焦亡[18]。本研究观察到,地黄多糖下调了NLRP3蛋白的表达,减少了细胞焦亡的发生,抑制了GSDMD和pro-caspase-1的剪切活化,同时减少了培养液中IL-1β、IL-18含量,说明地黄多糖可作用于炎症小体,抑制caspase-1和GSDMD的激活,抑制细胞焦亡,这可能是地黄多糖保护H2O2作用下HLEC免受损伤的作用机制之一。
综上所述,地黄多糖可以减轻H2O2作用下B-3细胞的氧化损伤,推测其作用机制与抑制细胞焦亡有关,这为临床治疗白内障提供了新的研究方向,但其详细作用机制仍需深入探究。
