紫色西番莲转色期果实色泽与品质的动态变化及其相关性
2022-08-12郝玺文吴建鸿林香信
李 巍,郝玺文,吴建鸿,郭 嘉,林香信*
(1.福建省农业科学院农业质量标准与检测技术研究所/福建省农产品质量安全重点实验室, 福建 福州 350003; 2.中国农业大学资源与环境学院, 北京 100193)
紫色西番莲PassifloraedulisSims也被称为鸡蛋果,属于西番莲科西番莲属的一种藤本植物,原产于巴西和澳大利亚等地区,现广泛分布于热带和亚热带地区[1-3]。因其具有多种芳香的风味,可散发菠萝、草莓、荔枝和柠檬等10多种水果的香味,而且它的果皮和果肉均富含色素、糖、有机酸、维生素、氨基酸等多种可促进人们健康的营养成分,近年来备受人们的喜爱[4-8]。紫色西番莲汁香味浓郁、酸甜可口,且因其具有良好的耐寒性、抗病性,可为遗传育种和资源开发提供了良好的材料,所以受到广大科研工作者的青睐。紫色西番莲在未成熟时果皮呈绿色,经过转色期的果实会逐渐转变为紫红色或深紫色,西番莲果实的颜色和品质是评估其营养价值、成熟度以及供栽培者和消费者分级的主要标准[4,9]。
目前,我国西番莲主要以鲜食为主,但是果实采收后果皮易失水皱缩,使商品价值降低,严重影响其销售价值,在福建[10]、贵州[11]、海南[12]、云南[13]、广州[14]等地对不同品种西番莲的研究中均证实了采摘成熟度对西番莲的贮藏及品质都有非常显著的影响。但是所研究的结果不同,蓝英杰等[12]建议七成熟采摘较好;郭靖等[14]建议把不同成熟度果实放一起采收最优;寸待泽等[13]建议八成熟适合较长距离运输,九成熟适合较近距离运输。那么学者们对成熟度的判断依据是否一致呢?因此,研究西番莲转色期的果皮色泽的变化,以及果皮色泽和果实品质之间关系显得尤为重要。本研究以紫色西番莲台农1号为试验材料,对西番莲在转色期内果皮的叶绿素和花色苷含量,以及果实的主要品质(糖和酸)的动态变化规律进行研究,并探讨果皮色泽与果实品质之间的相关性,旨在为科学判断西番莲的采收成熟度和合理采收西番莲以提高其贮藏品质提供参考依据。
1 材料与方法
1.1 试验材料和地点
供试品种为台农1号西番莲幼苗,来源于福建省南平市邵武的紫色西番莲育苗基地。于2019年4月在北京市中国农业大学资源与环境学院温室,使用直径60 cm、高80 cm的花盆进行土壤栽培试验,土壤来自北京市中国农业大学上庄实验站。每盆1株西番莲,幼苗地上部约15 cm高,所有西番莲幼苗长势良好且均一,未见明显损伤。施用复混肥(N-P2O5-K2O为15-15-15)200 g·株-1作为基肥。每隔1 d每盆浇灌1 L去离子水。
1.2 试验方法
待西番莲进入转色期,即50%的西番莲开始转色后,根据果皮转色情况以及授粉时间,分5个转色阶段(分别为转色期1、2、3、4、5)进行取果,每个阶段取6个果实,将果皮和果肉分开,果肉在液氮浴下进行轻度研磨以去除籽粒,之后放入-80℃冰箱保存。果皮经液氮冷冻后同样放入-80℃冰箱保存备用。
1.3 指标测定
1.3.1果实体积 使用游标卡尺测定西番莲横径(a)和纵径(b)后,根据椭圆计算公式V=4/3πa2b求得果实体积。
1.3.2叶绿素含量 参照国家推荐标准NYT3082-2017《水果、蔬菜及其制品中叶绿素含量的测定分光光度法》[15],将果皮鲜样加液氮捣碎后,取0.1 g于三角瓶中,加入5.00 mL浸提剂(无水乙醇和丙酮体积比为1∶1的混合液),使用封口膜密封,室温下避光静置提取5 h,过滤后使用紫外-可见分光光度计在645 nm和663 nm处测定试液的吸光度值。并根据国标所给公式计算叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl)含量。
1.3.3总花色苷含量 参照文献[16],将果皮鲜样捣碎后,取0.2 g,加入7.2 mL浸提剂(86%的乙醇溶液,含0.054%盐酸、0.1%柠檬酸),于31℃水浴加热2 h后,在6 000 r·min-1离心机中充分离心,使用紫外-可见分光光度计测定样品A510 nm、A620 nm、A650 nm,并根据差减法[4]校准样品花色苷吸光度,最后计算花色苷含量。
1.3.4可溶性糖组分的含量 可溶性糖的提取:称取粉碎过的西番莲果肉样品 0.2 g 于 15 mL 离心管中,添加 4 mL 蒸馏水,用涡旋仪混合均匀后于 50℃震荡水浴 30 min,于 6 000 r·min-1离心 15 min,取上清液用 0.45 μm 水系滤膜过滤于液相小瓶中。每个处理的样品 3 个重复。HPLC检测:采用高效液相色谱-示差折光检测器(Waters E2695)测定西番莲中可溶性糖的组成和含量,采用ZORBAX NH2色谱柱(5 μm,4.6 mm×250 mm)进行HPLC分离,色谱柱温度设为40℃。流动相为70%乙腈水溶液,以100%流动相 A等度洗脱,流速为1 mL·min-1。运行时间为 15 min,进样量为10 μL。使用果糖、葡萄糖、蔗糖标准品对西番莲中的可溶性糖进行定性和定量分析,结果以mg·hg-1FW表示。
1.3.5有机酸组分的含量 有机酸的提取:同1.2.4糖组分的提取。HPLC检测:采用高效液相色谱-二极管阵列检测器测定苹果中有机酸组成和含量,检测波长设为 214 nm。采用Titank C18 色谱柱(5 μm,4.6 mm×250 mm)进行HPLC分离,色谱柱温度设为30℃。流动相A为40 mmol·L-1磷酸二氢钾(使用磷酸调节pH至2.4),流动相B为甲醇,流动相A比例为97%,流动相B比例为3%,以流速0.8 mL·min-1进行等度洗脱。运行时间为15 min,进样量为10 μL。使用苹果酸、柠檬酸和马来酸标准品对苹果中的有机酸进行定性和定量分析,结果以mg·hg-1FW 表示。
1.4 统计分析
运用EXCELL整理数据,采用IBM SPSS Statistics 23分析软件进行方差分析和显著进行分析,并结合Origin 2021进行绘图。
2 结果与分析
2.1 西番莲在转色期果皮色泽和体积的变化规律
果实外观色泽是评价果实商品质量和价值的一个重要指标。紫色西番莲进入转色期后,果实的大小(图1B)基本上不发生明显的变化,而果皮颜色逐渐从绿色向红色转变(图1A)。果皮的叶绿素(Chl)含量整体呈逐渐降低的趋势(图2A)。叶绿素a(Chl a)、叶绿素b(Chl b)和叶绿素(Chl)含量在转色期1和转色期2没有显著差异,但在转色期2后显著降低,均在转色期5达到最低值。Chl a含量的下降幅度与Chl含量的下降幅度基本一致,Chl b含量虽然也呈下降趋势,但下降的幅度没有Chla含量的降幅大,说明西番莲果皮叶绿素含量下降的主要是由于叶绿素a含量的下降,而且叶绿素的降解过程主要发生在西番莲转色的中后期阶段。

注:不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05);下图同。

图2 西番莲转色期果皮叶绿素和花色苷含量的变化
西番莲转色期间果皮中的叶绿素a/叶绿素b(Chl a/Chl b)的比值(图3),在转色期4取得最大值,显著高于转色期2和转色期5,整体上呈现出先增加后减少的趋势。但在转色期4到转色期5的过程中该比值迅速下降,这可能是该过程中叶绿素a的含量迅速下降而叶绿素b的含量变化较小的结果。这也是西番莲从转色期1到转色期4,果皮颜色由蓝绿转变为黄绿色的主要原因。西番莲在转色期间果皮花色苷含量是逐渐增加,且5个时期均具有显著性差异,同时从花色苷/叶绿素的比值上亦可以看出,5个转色时期均有显著性差异,随着西番莲的逐渐成熟,其比值逐渐增大,这表明西番莲的转色过程伴随有花色苷的生成。

图3 西番莲转色期果皮色素相对含量的变化
2.2 西番莲转色期果实品质的变化规律
由图4可知,西番莲在转色期间果肉总糖含量整体呈先增后趋于平稳,且在转色期3和4达到最大值,显著大于转色期1,这说明糖分的累积集中于转色前期。西番莲果肉总酸含量则呈逐渐降低的趋势,且在转色期2和4达到最大值,显著大于转色期5,这说明有机酸的降解主要集中于转色后期。糖酸比整体呈上升趋势,在转色期5达到最大值,在转色期1~3和转色期4~5,西番莲果肉糖酸比均呈现显著的上升。综上所述,西番莲转色期间的碳水化合物是发生了糖组分逐渐累积和酸组分逐渐降解的过程。

图4 西番莲转色期总糖、总酸和糖酸比的变化
那么糖和酸的各组分又发生了怎样的变化呢?西番莲果肉中的果糖和葡萄糖在转色中后期(转色期3、4、5)的含量显著大于转色前期(转色期1)(图5A),这说明在西番莲的转色过程中伴随着果糖和葡萄糖的累积,且这种累积过程主要集中在转色前期。而蔗糖含量在西番莲不同转色阶段差异不显著,这说明在西番莲的转色过程中并没有发生蔗糖的显著降解和转化。而果肉中果糖和葡萄糖的相对含量在转色期间大体呈逐渐增加的趋势(图5B),在转色期5达到最大值,显著高于转色期1和2;蔗糖相对含量呈现降低的趋势。综上所述,西番莲果肉中蔗糖相对含量的降低并非因为果肉中蔗糖含量的减少,而是因为果糖和葡萄糖含量的增加,说明西番莲转色期间糖含量的变化主要取决于果糖和葡萄糖含量的变化。
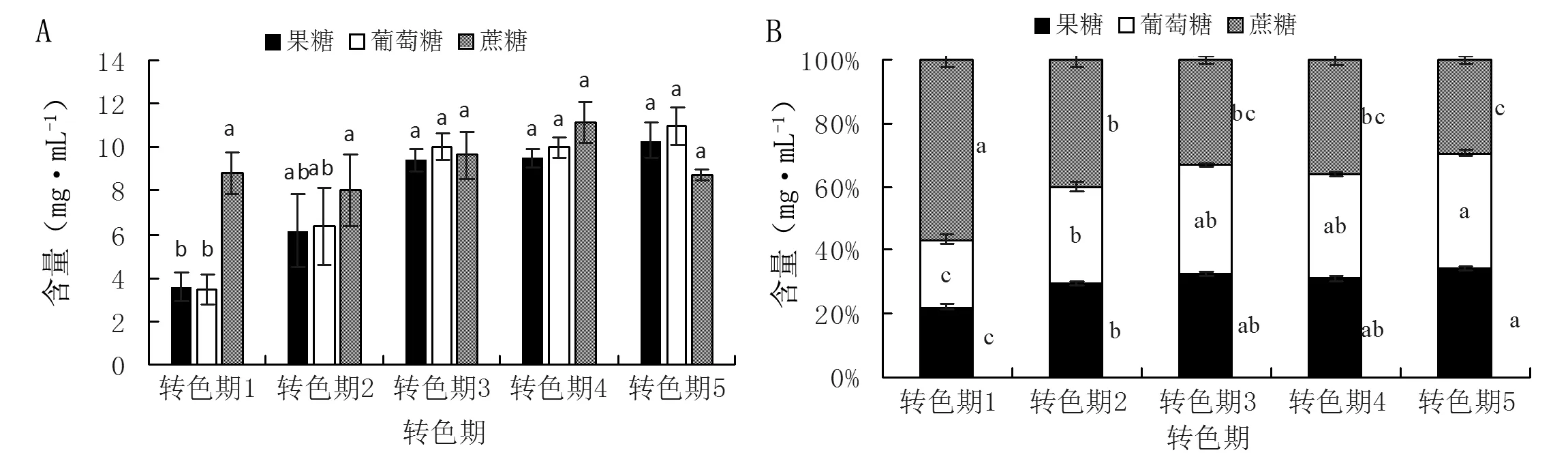
图5 西番莲转色期果肉糖组分的变化
西番莲果肉中苹果酸含量在转色期4出现激增,随后在转色期5又骤降至原有水平,而柠檬酸含量在不同转色时期没有显著性差异(图6A),这说明在西番莲转色过程中没有发生柠檬酸的显著降解和转化。而从各组分的相对含量上看,西番莲果肉中苹果酸在转色期4达到最大值,且显著高于转色期1、2、3;柠檬酸相对含量则与苹果酸变化相反(图6B),但是变化显著的时期主要是存在西番莲转色期3~5。综上所述,说明影响西番莲转色期间果肉酸组分含量变化的主要是苹果酸含量的变化。

图6 西番莲转色期果肉酸组分的变化
2.3 西番莲果皮色泽和果肉品质之间的相关性
西番莲转色期间的叶绿素和叶绿素a的相关系数为1,亦说明果皮中叶绿素a含量下降是叶绿素含量下降的主要原因。叶绿素、叶绿素b、叶绿素a和花色苷含量呈极显著负相关,说明西番莲果实在转色期间随着果皮叶绿素的降解伴随着花青素的合成,也是果实颜色由绿色转红色的主要原因。果糖、葡萄糖含量与叶绿素a、叶绿素b、叶绿素含量呈极显著负相关;果糖、葡萄糖含量与花色苷含量呈极显著正相关,这表明西番莲转色期间果皮颜色的改变和果肉糖酸组分的变化有关,原因可能是花色苷的合成需要光合产物的糖类作为底物,所以花色苷的含量与糖的合成与累积有非常密切的关系。
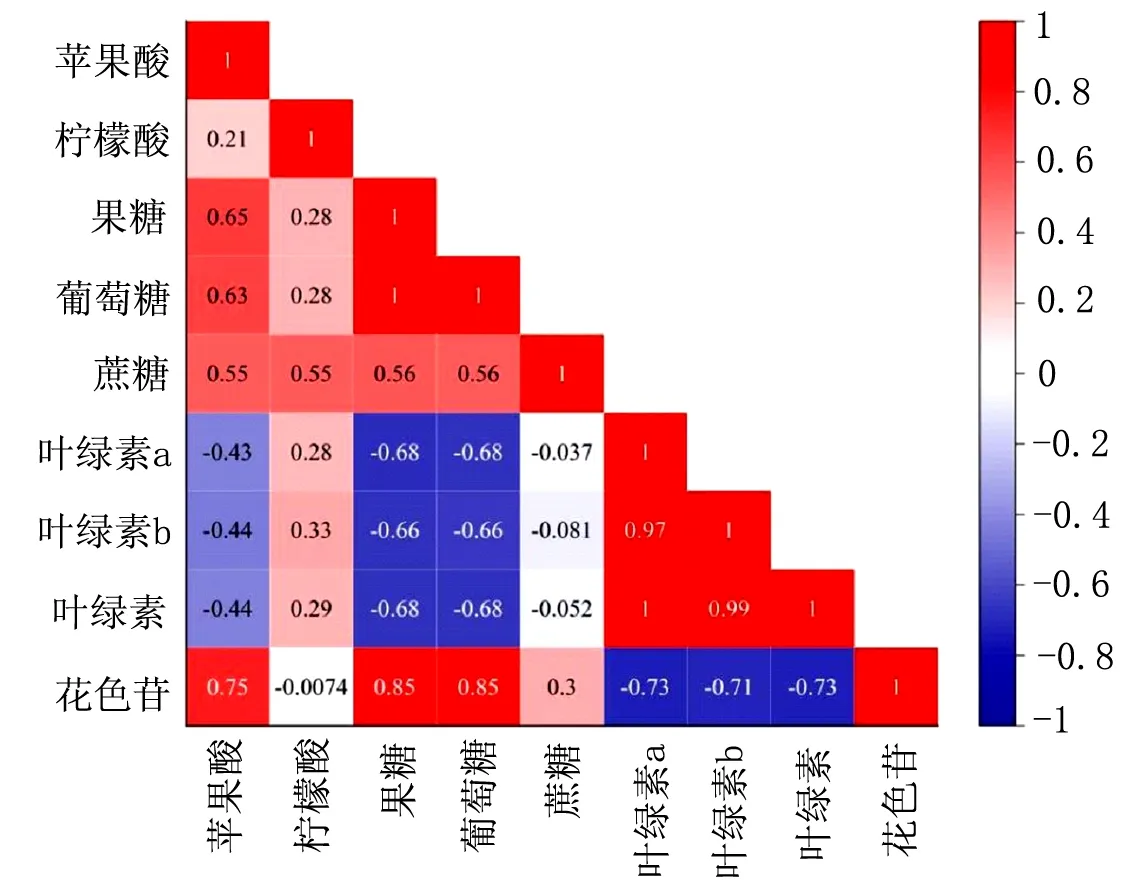
图7 西番莲转色期果皮色泽和果肉品质之间各指标的相关分析
3 讨论
3.1 西番莲转色期果皮色素的变化
果实的色泽发育是其成熟与否的重要判断标准之一[9]。前人研究结果发现,樱桃番茄在进入转色期后叶绿素含量呈逐渐降低的趋势,完熟期含量最低[17];随着猕猴桃果实发育进程,叶绿素a、叶绿素b、总叶绿素含量在花后100 d呈现迅速下降趋势[18],并且叶绿素a含量的下降较快,而叶绿素b含量的下降幅度较小[19],这与本研究西番莲果实转色期内叶绿素含量也呈下降趋势,且叶绿素a含量是其下降的主导因素的研究结果一致。这可能是由于在果实转色过程中,脱镁叶绿素a单加氧酶(PaO)的活性总体呈上升趋势,促进叶绿素a的降解[20-21]。前人在血橙[22]、荔枝[21]、葡萄[23]、辣椒[24]等园艺作物的研究中发现,花色苷含量在转色阶段呈上升趋势,并在完熟期达到最大值,这与本试验中西番莲果皮花色苷的变化趋势一致。
有研究学者认为果实的颜色是叶绿素和花色苷共同塑造的[21],猕猴桃的颜色取决于色素类物质的绝对含量和相对比例[19]。本试验中,叶绿素a与叶绿素b的比值在转色前期上升,是西番莲果皮颜色从黄绿变为蓝绿的表现,而该比值在转色期4迅速下降,也是西番莲颜色从蓝绿转变为黄绿的表现。这与顾凡等[24]在文紫椒上的研究结果一致。
3.2 西番莲转色期果肉糖酸组分的变化
果实中糖酸组分含量及占比在很大程度上决定了果实的品质与风味[25],众多的研究结果表明,紫色西番莲属于蔗糖积累型和柠檬酸优势型水果,果实中可溶性糖主要包括果糖、葡萄糖和蔗糖,有机酸以苹果酸和柠檬酸为主[26],与本试验结果一致。可溶性糖在果实转色期中积累,在许多果实的着色研究中都有报道。葡萄在转色期至成熟期的发育过程中葡萄糖、果糖含量逐渐增加,且集中在转色前期[25]。樱桃中主要糖组分葡萄糖和果糖,在果实发育前期有一个平稳积累期,转色期后其含量均迅速增加,至果实成熟期其积累均减慢[27-28]。这与本试验结果,西番莲的糖组分的变化规律一致,西番莲果实糖分的累积主要集中在转色前期,而酸分的降解主要集中在转色后期,其糖酸比分别在转色前期和后期迅速上升。寸待泽等[13]也证实了在转色后期西番莲的酸含量急剧降低,建议选择在转色期4~5进行采摘比较适合,这与本研究的研究结果也有一致性。
3.3 西番莲转色期果皮色素和果肉糖酸组分的相关性
有研究证明,葡萄果实随着叶绿素的降解和花青苷的合成,果实的颜色由绿转红,最终达到果实所特有的颜色特征[23]。在李子[29]、辣椒[24]、荔枝[30]等研究结果都表明,在果实转色的过程中,果肉果糖、葡萄糖含量同果皮花色苷含量呈极显著正相关,同叶绿素含量呈极显著负相关,这与本研究叶绿素含量和花色苷含量呈极显著负相关,糖组分含量与叶绿素含量呈极显著负相关,糖组分含量与花色苷含量呈极显著正相关的研究结果一致,说明西番莲的转色过程中,同时发生着叶绿素的降解和花色苷的积累,而且果皮色泽的变化与果肉糖酸组分的变化有着密切的关系,其原因可能是花色苷的合成需要光合产物的糖类作为底物,所以花色苷的含量与糖的合成与累积有非常密切的关系[24]。
4 结论
西番莲在转色阶段叶绿素含量呈下降趋势,花色苷呈上升趋势,两者呈显著负相关,表明西番莲转色期间同时发生着叶绿素的降解和花色苷的积累,叶绿素含量的下降主要是由于叶绿素a含量的变化所引起的。西番莲果实在转色期间糖的累积主要发生在转色前期,其中主要变化的组分是果糖和葡萄糖;酸的降解主要发生在转色后期,其中主要变化的组分是苹果酸;糖组分含量与花色苷含量呈显著正相关,糖酸组分含量与叶绿素含量呈显著负相关,说明果皮颜色的变化与果肉糖酸组分的变化有关。
