豚鹿SSR标记开发与遗传多样性分析
2022-08-12耿广耀由玉岩刘群秀
耿广耀 由玉岩 刘群秀
(1.上海动物园,上海,200335;2.北京动物园,圈养野生动物技术北京市重点实验室,北京,100044)
微卫星DNA(microsatellite DNA)又称简单重复序列(simple sequence repeat,SSR),广泛分布在真核、原核生物和病毒基因组中,是基因组中变化最快、多态性较高和两端较为保守的一段序列[1],具有易检测、分型重复性好和统计方法多样等优点,可做为一种有效的遗传标记,广泛应用于种群遗传多样性研究、物种保护、物种鉴定和亲权分析等方面[2-5]。不同物种的微卫星标记可在近缘物种中相互借用[6],但不同物种有时会表现出特异性,进而出现引物通用性较差,不能确定扩增产物是否为期望序列,因此在应用微卫星进行遗传多样性研究时需要针对特定物种进行标记开发[7-8]。
豚鹿(Axisporcinus)隶属鹿科(Cervidae)花鹿属(Axis),是国家一级重点保护野生动物,分布在南亚次大陆至东南亚的中南半岛区域,我国境内野生种群在20世纪60年代已灭绝,圈养种群仅分布在成都动物园、上海动物园和北京动物园。目前关于豚鹿分子标记开发的研究有限,余建秋等[9]利用磁珠富集法获取7个微卫星位点对成都动物园27只豚鹿个体进行亲权分析;Wang等[10]利用RAD-seq对成都动物园圈养豚鹿进行遗传多样性研究。本研究基于Illumina MiSeq测序平台对上海动物园圈养豚鹿进行微卫星标记开发,筛选出7个SSR标记对该种群进行遗传多样性分析,探究这些标记在圈养豚鹿种群中的适用性,为豚鹿种群保护研究提供科学依据。
1 材料与方法
1.1 样品及总DNA提取
1.2 SSR分子标记开发
将提取的DNA通过超声随机打断,制备测序文库。利用p(AG)10、p(AC)10、p(AAC)8、p(ACG)8、p(AAG)8、p(AGG)8、p(ACAT)6和p(ATCT)68种探针富集基因组文库中的SSR片段。利用Illumina MiSeq平台测序富集得到的SSR片段,并利用Primer 3 V2.3.6对Cluster内简单序列长度多态性(simple sequence length polymorphism,SSLP)大于2的SSR序列进行引物设计。
1.3 引物验证与分型
选取80个SSR引物荧光标记后,对10个随机样品进行扩增和毛细管电泳检测,筛选出扩增效率高和稳定性好的多态性SSR引物。利用筛选出的SSR引物对22只豚鹿个体进行PCR扩增和毛细管电泳检测。PCR反应体系为20.0 μL:DNA模板1.0 μL(浓度为15 ng/μL),Taq酶0.5 μL,10 μmol/L的上、下游引物各1.0 μL,超纯水14.0 μL,10×buffer 2.0 μL,dNTP 0.5 μL。反应程序:95 ℃预变性5 min;95 ℃变性30 s,52~62 ℃退火30 s,72 ℃延伸30 s,10个循环;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃延伸7 min。
1.4 数据分析
利用Cervus 3.0和PopGene 3.2[11]分别计算各位点等位基因数(number of alleles,Na)、有效等位基因数(effective number of alleles,Ne)、多态信息含量(polymorphism information content,PIC)、观测杂合度(observed heterozygosity,Ho)、期望杂合度(excepted heterozygosity,He)和哈迪-温伯格平衡(Hardy-Weinberg equilibrium,H-W)等。
2 结果与分析
2.1 豚鹿基因组中SSR位点信息
利用微卫星识别工具(MIcroSAtellite identification tool,MISA)采用搜索参数(mono-10、di-6、tri-5、Tetra-5、penta-5和hexa-5,复合序列中两个不同SSR之间允许的最大间隔为100 bp)在7 639 467条序列(总长度2 571 197 198 bp)中,检测到SSR片段序列5 684 557条,含1个以上SSR片段的序列为1 396 521条,以复合形式存在的SSR序列为2 412 186条。单碱基重复到六碱基重复在豚鹿基因组中均有分布,其中双碱基重复占比最大,其次是单碱基重复,各碱基重复信息见表1。
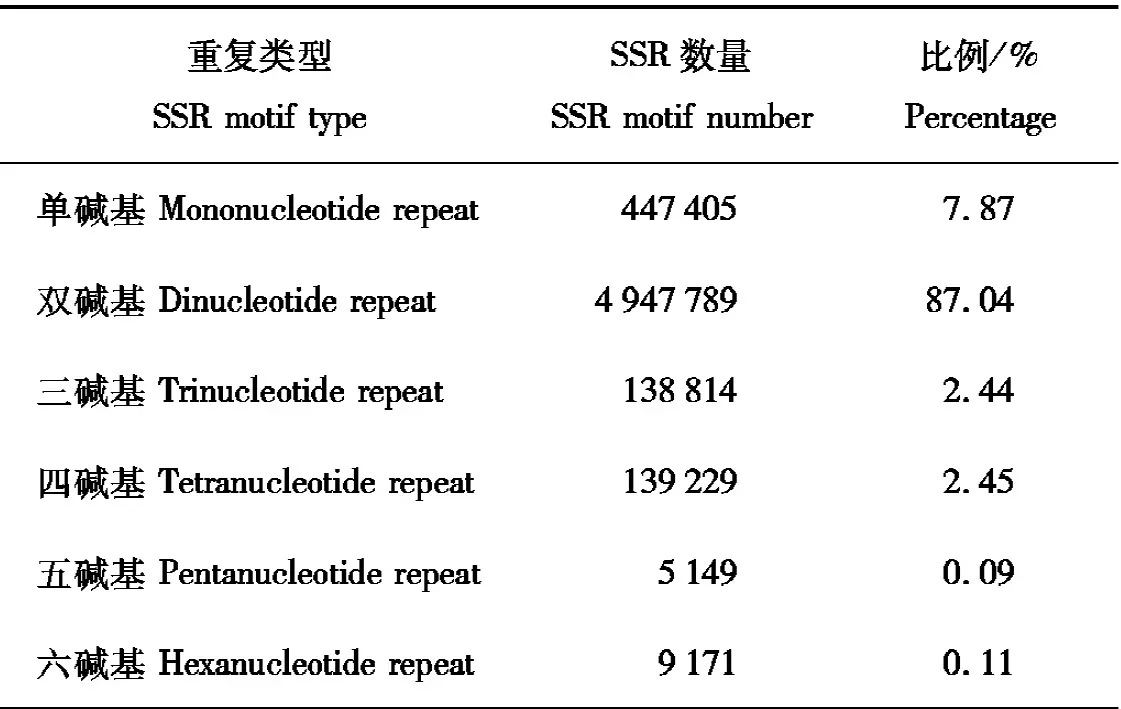
表1 不同重复类型SSR统计
单碱基重复SSR位点以A/T重复为主,占比为96.27%。双碱基重复中,AC/GT重复数为3 944 705,占比最大,为79.73%;AG/CT重复数为844 429,占比为17.07%;AT/AT重复数为156 843,占比为3.16%;CG/CG重复数为1 812,占比为0.04%。三碱基重复中主要重复为AAC/GTT、AAG/CTT和AGG/CCT。四碱基重复中主要重复为ACTC/GAGT。五碱基重复中主要重复为AACAC/GTGTT。六碱基重复中主要重复为ACACCC/GGGTGT。
2.2 多态性SSR引物筛选与遗传多样性分析
试验筛选出7个扩增效率高和稳定性好的多态性SSR引物,引物序列信息见表2。7个SSR标记在22只圈养豚鹿个体中共检测到19个等位基因,单个标记的等位基因数为2~5个,平均值为2.714个,观测杂合度为0.227~1.000,平均值为0.680,期望杂合度为0.206~0.672,平均值为0.513。多态性信息含量为0.181~0.590,平均值为0.421。哈迪-温伯格平衡检验经Bonferroni校正后,有2个位点不符合哈迪-温伯格平衡(表3)。

表2 引物序列信息
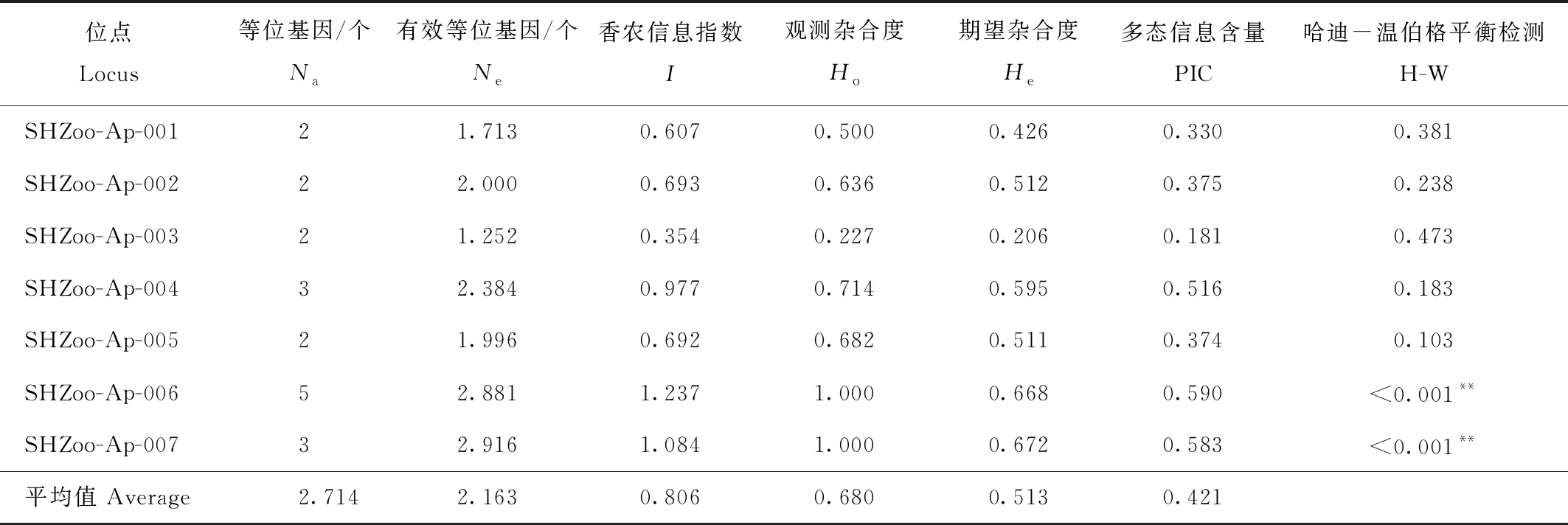
表3 豚鹿7个多态性基因位点分析
3 讨论
通过近缘物种间引物借鉴、公共数据库和相关文献[12]查找,小片段DNA克隆法和传统微卫星富集文库法得到的微卫星标记可以在一定程度上满足遗传多样性研究、遗传结构分析和亲缘关系鉴定等工作[9,13],但因工作量大、成本高无法满足连锁图谱构建、基因定位和QTL分析等需要大量标记的研究。利用通量大和周期性短的高通量测序技术,将通过探针富集得到的SSR序列测序获取微卫星位点,是目前大量获取微卫星序列的一种常用方法,该技术也是目前从gDNA、cDNA和EST中筛选微卫星位点的一种方式。本研究利用高通量测序技术对探针富集所得序列测序,得到的SSR标记对豚鹿物种构建遗传连锁图谱和分子标记的开发等具有重要意义。
本研究发现豚鹿SSR位点以双碱基重复为主,其次是单碱基重复,与梅花鹿(Cervusnippon)[14]和大鼠[15]等物种的微卫星优势重复类型一致,与牛、绵羊[16]和猪[17]等以单碱基重复为主的类型不同,这可能是由豚鹿自身基因决定的,也可能与本研究采取的SSR开发方法有关。研究发现,选用不同的搜索参数会出现不同优势的碱基重复类型[18-19],也可能是此种原因导致了豚鹿SSR分子标记以双碱基重复为主,但大部分研究认为双碱基重复是物种优势重复碱基类型[20],本研究也证明了此种观点。其他类型的碱基重复所占比例总体上呈现随重复单位的增加所占比例减少的趋势,符合有关研究规律[21]。在单碱基重复中,以A/T重复为主,是物种中普遍存在的现象。在双碱基重复中,AC/GT重复占比远大于另外3种重复,这与动植物中SSR DNA中AC/GT含量丰富的研究结果[22-24]相一致,此种现象可能是由于在DNA复制过程中,连接A、T的双键比连接G、C的三键更容易断裂导致。
群体杂合度的高低可以反映群体在多个基因座上的遗传变异程度。本研究所选种群的平均观测杂合度为0.680,平均期望杂合度为0.513,表明该群体的遗传多样性较高,观测杂合度与期望杂合度有差异说明该种群存在杂合子缺失或存在纯合子过剩的现象。本研究中有2个位点不符合哈迪-温伯格平衡,这可能与近亲杂交、存在无效等位基因、种群退化和圈养管理模式等因素有关。多态性信息含量(PIC)是衡量群体遗传多样性的一个重要参数,依据其值高低分为高度多态位点(PIC>0.50)、中度多态位点(0.25≤PIC≤0.50)和低度多态位点(PIC<0.25)。本研究筛选出的7个SSR标记,高度多态位点有3个,中度多态位点有3个,低度多态位点有1个,这可能是因样本量小于25所致[25]。
本研究采用Illumina MiSeq测序平台结合SSR富集文库测序方法开发的豚鹿SSR分子标记,能够为豚鹿种群的遗传多样性和连锁图谱构建等研究提供技术基础。
