农药在植物和微生物中的代谢转化研究进展
2022-08-12刘婷婷李如男董丰收郑永权李远播
刘婷婷 ,李如男 ,董丰收 ,郑永权 ,李远播 *
(1.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193;2.济南大学,前沿交叉科学研究院,济南 250002)
农药作为在当代农业生产中被广泛应用的植物保护投入品,其在防治病虫害、铲除杂草和提高作物产量等方面发挥着不可替代的作用[1]。然而,大量和频繁地使用农药引发了一系列环境安全和食品安全问题。过度使用农药可能会对农产品、土壤和水体造成污染,进而经过直接摄入或食物链富集效应传递到人体,威胁人类健康[2-4]。同时,转基因作物的大量种植间接导致了农药过量施用,引发的生态安全问题也引起相当关注[5]。在环境治理方面,一些植物可以吸收和代谢污染土壤/水体中的农药,微生物也可以对农药进行降解与代谢[6-7]。作为农药污染的修复策略,植物修复和微生物修复对减轻农药污染具有重要意义。因此,我们有必要研究农药在植物体内的吸收、转运、积累与代谢转化行为和机制,以及微生物降解、代谢和转化农药的行为机制,并制定有效的策略来缓解农药污染导致的生态环境问题。
农药被植物根和叶等部位吸收后,经共质体或质外体途径运输到其他部位进而富集,然后在体内多种代谢酶的参与下进行代谢与转化。一般来说,转化产物毒性较小,但是某些农药经过生物转化及活化后毒性增强,增加了环境风险[8-10]。与植物不同,微生物一般只作为降解农药的工程菌,当农药渗入菌体后,其可直接对农药进行降解与代谢[7,11]。由于两者生命结构的不同,其代谢过程有相似之处,但也存在差异。研究农药在植物和微生物中的代谢转化行为,一方面有利于对农药的环境暴露进行风险评估,以明确其在靶标植物和非靶标植物中的残留行为,从而指导农药的安全合理使用;另一方面作为基因工程植物和微生物对农药面源污染修复具有重要的应用价值。此外,深入探索农药在植物和微生物体内的代谢调控机制,为绿色农药的创制、植物抗性基因的挖掘、抗性转基因作物的培育以及基因工程植物及微生物的构建等提供一定的理论基础。
本文聚焦农药在植物和微生物中的代谢转化行为及其机制,综述了农药在两者中的代谢转化行为,影响农药代谢转化的因素,代谢转化研究策略与方法,代谢机制及其应用,以期为农药的安全合理使用、转基因作物的培育及污染修复策略提供进一步参考。
1 农药在植物中的吸收、转运、累积与代谢转化
一般农药均可以被植物各部位吸收或渗透到植株内部组织,经共质体途径或质外体途径运输。由于药剂性质和植株各部位构成组分的差异,不同农药在植株各部位具有不同的累积行为[12-13]。农药一旦过量累积,会损害植株的生理结构,引起植物毒性[10,14]。大多数累积在植物体内的农药在体内代谢酶的介导下可通过多种特异性代谢途径或生化反应来解毒[15]。
1.1 农药在植物中的吸收、转运与累积
在实际田间应用过程中,农药通过不同的途径进入植物组织,如叶面喷雾、根部施用和种子处理等[16-17]。如图1所示,农药喷洒到叶片后,首先穿透叶片的角质层和表皮,到达质外体,然后通过质膜进一步传导到共质体中。有些农药在此过程中需要载体的参与,如氨基酸转运体(AtLHT1)[18-19]。农药进入共质体后,通过韧皮部传导分布,但大多数农药难以经韧皮向下运输到根部。一些导向农药通过基于植物内源分子的载体修饰,如氯虫苯甲酰胺(CAP)偶联丙氨酸(Ala)形成CAP-Ala后,在AtLHT1转运体的介导作用下可实现由韧皮部向根部运输(图1)[19-21]。大多数杀虫剂和杀菌剂可施用于根部或周围土壤中,在蒸腾拉力的作用下传导至地上部分[22]。Fan等[23]研究发现,氯虫苯甲酰胺和四氯虫酰胺均可被玉米根系吸收并输送到植株上部分,证明了蒸腾拉力是其向上转运的主要因素。用农药处理种子后,种皮和子叶对药剂进行存储。当种子发芽后,药剂被吸收,进而转运到幼苗体内发挥作用。种子途径与根系途径对药剂吸收转运的协同作用应值得关注[24]。
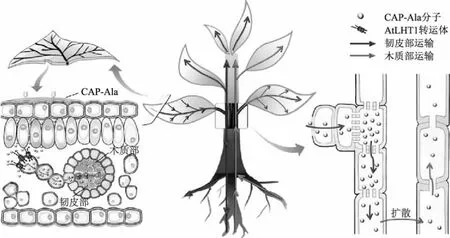
图1 载体介导的导向农药在植物体内的转运行为[21]
农药在植株体内的传导方式可分为局部传导、向上传导和双向传导[25],其在植物体内的累积行为受到多种因素的影响。有研究发现,噻虫嗪较易累积在小松菜根部,向叶部迁移能力较弱,而啶虫脒较易向叶部迁移,不易在根部累积。通过相关性分析发现,2种农药累积行为的不同与其分子量有关[12]。另一项研究则发现,农药在植株各部位的累积行为与辛醇-水分配系数(logKow)有关,药剂的logKow值越大,药剂越容易在根部累积;logKow值越小,药剂越容易向上传导,进而在叶部累积[13]。本团队一项最新的研究以小麦为典型作物,明确了吡虫啉和戊唑醇等11种农药在小麦植株不同部位的累积行为,通过根脂质归一化分析证实了作物根部的脂肪是影响农药富集的重要因子[26]。
1.2 农药在植物中的代谢转化
植物体内存在多种代谢酶,植物代谢酶参与农药代谢与解毒的过程[27]。农药在植物中的代谢转化一般可分为3个阶段:第1阶段(I相)包括氧化、水解和还原等过程,具体参与的酶类主要包括氧化酶(如细胞色素P450、过氧化物酶)、还原酶(如硝基还原酶、醛酮还原酶)和水解酶(如酯酶、酰胺酶和腈酶),该过程可产生更多极性和活性化合物;第2阶段(II相)包括激活的I相代谢产物与植物内源生物分子(如葡萄糖、氨基酸和谷胱甘肽等)结合,参与该过程的酶主要有谷胱甘肽-S-转移酶、糖基转移酶以及丙二酰基转移酶等;第3阶段(III相)是将第2阶段形成的轭合产物在ATP转运蛋白的作用下储存于液泡或聚合成细胞壁组分,从而形成不可提取的残留。研究表明,Ⅱ相轭合反应是植物中农药进行解毒的主要代谢途径[8,28-30]。
1.2.1 农药在植物中的Ⅰ相代谢
(1)氧化代谢。细胞色素P450酶系属于酶活性蛋白家族中最大的一类,其活性成分主要由细胞色素P450蛋白和NADPH细胞色素P450还原酶(CPR)组成[31]。细胞色素P450酶通过羟基化、环氧化、脱烷基化、脱氨和异构化等反应参与农药在植物中的I相代谢[32-33]。有研究表明,细胞色素P450酶系参与了吡虫啉等几种新烟碱类杀虫剂的氧化代谢,涉及的反应主要有羟基化和去甲基化等[28]。(2)水解代谢。水解过程中的水解酶通过向每个产物中加入H+或OH-来催化底物中某些化学键的裂解[27]。含有酰胺或氨基甲酸酯键的农药分子,或含有羰基、磷基和亚硫基键的酯类分子,都容易被水解酶水解[15]。(3)还原代谢。还原过程中的硝基还原酶(NTR)主要参与外源物质的硝基还原和还原性脱卤反应[34]。含有亚硝基的化合物,如新烟碱类化合物吡虫啉、噻虫胺和呋虫胺等在植物体内进行的还原代谢反应主要是由硝基还原酶介导[28]。醛酮还原酶(AKR)被报道参与介导水稻中的草甘膦代谢过程,导致水稻对草甘膦产生抗性[35]。此外,AKR超家族广泛存在于原核生物和真核生物中。由于其广泛的底物特异性,AKR也可代谢大量的外源物质,其中最具特征的是AKR4C家族,其参与醛酮解毒、应激防御和次生代谢等反应[36]。
1.2.2 农药在植物中的Ⅱ相代谢
谷胱甘肽-S-转移酶(GSTs)介导的反应。GSTs是一种二聚体多功能酶,具有多种同工型或同工酶。其催化谷胱甘肽硫基的亲核攻击,可与各种亲电底物结合,形成具有较高的水溶性和较低毒性的轭合物。轭合物随后被转运至液泡并在液泡中进一步被降解[37]。植物中的GSTs主要分为3类,即Ⅰ型、Ⅱ型和Ⅲ型[27]。其中,Ⅰ型GSTs包含3个外显子和2个内含子,具有防御基因的功能;其产生的蛋白质可以解毒除草剂,或者在抵御病原体攻击、延缓衰老以及在伴随这些过程产生的脂质过氧化反应中发挥积极作用[38]。谷胱甘肽在植物中主要以还原型形式存在,其结构中含有游离硫醇基[39]。作为GSTs的必需底物,谷胱甘肽在许多除草剂和其他外源性或内源性物质的解毒中起着关键作用[40-41]。例如,谷胱甘肽可以与农药或其他外源物质的Ⅰ相代谢产物结合形成轭合物,形成的轭合物被分解为半胱氨酸和硫代乳酸衍生物,再与丙二酸酰化形成N-乙酰基半胱氨酸轭合物[41]。这些末端代谢物可能以可溶性代谢物的形式储存在植物细胞液泡中,或以残留物的形式储存在植物细胞壁的生物聚合物中[39]。
糖基转移酶(GTs)介导的反应。GTs催化糖与植物内源代谢物或外源化学物质的结合,糖基化的作用是提高底物的水溶性,使底物更容易被甲基化[42]。GTs可将供体分子转移到受体分子上,如尿苷二磷酸(UDP)葡萄糖为植物体内最常见的核苷酸糖供体,另外还有UDP-木糖、UDP-鼠李糖和UDP-半乳糖等[15]。含有-OH、-SH、或-NH2基团的外源化合物易与糖基结合[43],从而形成含有糖苷键的化合物[30]。已有研究证实了GTs在除草剂解毒代谢及选择性方面具有重要作用,其中O-糖苷共轭是植物对农药解毒的重要结合方式[44-45]。苏湘宁[44]研究了水稻糖基转移酶OsIRGT1基因对异丙隆和乙草胺的降解和解毒作用,结果发现过表达水稻株系内异丙隆和乙草胺的积累量均显著低于野生型,这表明糖基转移酶OsIRGT1基因对于农药在植物中的解毒与代谢具有促进作用。张静静[45]研究发现,糖基转移酶OsARGT1基因促进了过表达水稻株系中阿拉特津的降解与代谢。
丙二酰基转移酶(MTs)介导的反应。糖基化轭合物通常可在MTs的作用下,以丙二酰基辅酶A为供体,与丙二酸偶联成丙二酸半酯[45]。例如,毒氟磷在大豆豆子和豆叶中的Ⅰ相代谢产物(DFL-M2)在UDP-O-糖基转移酶的作用下与葡萄糖轭合形成产物DFL-M3,进而在MTs的作用下与丙二酸轭合形成产物DFL-M4[46]。
农药在植物体内的Ⅱ相代谢发生的轭合反应主要有葡萄糖共轭、氨基酸共轭、谷胱甘肽共轭和丙二酸共轭等[15],如溴氰虫酰胺在番茄中的Ⅱ相代谢中发生了葡萄糖共轭[47];苯醚菌酯在黄瓜中的Ⅱ相代谢中与葡萄糖发生共轭反应[48];Fujisawa等[49]研究了拟除虫菊酯类和有机磷类等农药的降解产物(酚类、苯胺类和羧基化合物)在浮萍中的代谢转化,发现几种降解产物在Ⅱ相代谢中主要发生了葡萄糖共轭、氨基酸共轭和丙二酸共轭等反应。
1.2.3 农药在植物中的Ⅲ相代谢
农药在植物中经过氧化水解和共轭结合等一系列转化过程后进入Ⅲ相代谢,该阶段主要是轭合物的隔离和与细胞壁组分的结合[27]。在三磷酸腺苷(ATP)转运蛋白的作用下,农药在植物中产生的Ⅰ相和Ⅱ相代谢产物从细胞质转运至液泡中进行隔离解毒或被进一步分解[50]。Zhang等[51]研究发现,在紫花苜蓿中,6个ABC转运基因对阿特拉津产生响应,这些ABC转运蛋白被认为可在植物细胞中转运氨基酸等内源物质与外源物质形成的轭合物。部分轭合物与细胞壁组分结合形成不可提取的残留物。液泡隔离和形成细胞壁组分均是植物体对外源农药的解毒途径[50]。一般来说,所形成的结合物将被储存,不会被进一步代谢,但有些结合物通过现有的代谢途径被进一步矿化为它们的无机成分,从而解毒[52-53]。
1.3 影响农药在植物体内代谢与解毒的因素
农药在植物体内的吸收、转运与代谢行为受到诸多因素的影响,如植物种类、环境条件和外源物质等[8,54-56]。同一农药在不同植物中的代谢行为也不尽相同。丁硫克百威在小白菜中代谢为克百威、3-羟基-克百威和3-酮-克百威,而在黄瓜中仅代谢为克百威和3-羟基-克百威[54]。吡虫啉在芹菜叶中被发现有5种代谢物,在莴苣叶中被发现有3种代谢物,而在萝卜叶中则被发现有2种代谢物[8]。不同生长阶段和不同组织部位也影响农药在植株体内的代谢,如在生长成熟期,溴氰虫酰胺在番茄植株中的代谢快于幼苗期,且代谢主要发生在叶片中[55]。环境和地域条件也影响农药的降解与代谢,如在好氧条件下,氟虫腈很容易氧化形成氟虫腈砜,而在高水分或厌氧条件下则通过还原形成氟虫腈硫化物[56];丁硫克百威在小白菜中的降解速率随地域不同存在差异,其在杭州种植的小白菜中降解最快,其次是上海和北京[54]。
目前已经发现许多外源化合物可以通过增强代谢酶的活性来保护植物免受其他有毒化合物的伤害,安全剂可通过提高除草剂的代谢水平,或通过促进除草剂在受保护植物中的降解来发挥作用[14,57],如安全剂解草唑可分别缓解麦草畏和乙草胺对水稻及油菜产生的药害[58-59]。一些与植物生长有关的激素类物质可通过调控代谢酶基因的表达进而激活代谢酶活性来影响农药的代谢与降解。例如,Lu等[60]研究表明,添加5 mg/L的水杨酸(SA)上调了与降解代谢酶相关基因的表达,并促进了异丙隆在小麦植株根和茎中的代谢与降解。也有研究表明,添加0.1 μmol/L的茉莉酸甲酯(MeJA)增强了代谢酶活性,可明显增强异丙隆在小麦植株中的代谢与降解[61]。
2 农药在微生物中的降解与代谢转化
研究农药在微生物中的降解与代谢,对于农药环境污染治理具有重要的应用价值。降解农药的微生物包括真菌、细菌、放线菌和藻类等,可被降解的农药包括有机磷类、有机氯类、氨基甲酸酯类、磺酰脲类和新烟碱类等[62-65]。其中,已发现的对农药具有降解作用的微生物大多来自于土壤微生物[66]。有研究表明,降解新烟碱类杀虫剂的菌群主要来自受该类药剂污染的土壤,且主要以细菌为主[67]。赵百萍[68]从长期受污染的土壤中分离出能够降解炔苯酰草胺的菌株W1,并将其鉴定为睾丸酮丛毛单胞菌(Comamonas testosteroni)。
农药在微生物中的代谢过程包括氧化、还原、水解、缩合、偶联等过程[11]。降解代谢过程主要分为3个阶段:微生物首先通过细胞膜将农药吸附在其表面,然后将农药渗透进入体内,最后在酶促反应下对农药进行降解与代谢[69]。参与农药在微生物中代谢的酶类有酯酶、酰胺酶、谷胱甘肽-S-转移酶、细胞色素P450酶系和硝基还原酶等[52]。农药在微生物中代谢途径的多样性取决于外源化合物的化学结构、微生物种类、环境条件以及调控这些生化途径表达的代谢因子[69-72]。在土壤微生物作用下,新烟碱类杀虫剂哌虫啶在土壤中主要发生去丙基化、亚硝基化、脱硝化和去甲基化等进行代谢反应[73]。在降解酶参与下,真菌或细菌可以通过矿化作用将农药转化为CO2、H2O和无机氮等[74],如芳香族农药在矿化过程中会发生环裂解过程[62]。微生物也可通过共轭反应对农药进行降解,共轭反应包括木基化、烷基化、酰化和亚硝化,其产生的天然代谢产物也可与农药进行共价结合[75]。植物和微生物对农药代谢过程中产生的轭合物有着不同的归趋,植物没有排泄系统,因此其有毒产物通常被分隔在液泡中或嵌入结构聚合物中,以减少农药毒性,而微生物则主要通过矿化作用将轭合物矿化为无机成分[52,74]。
微生物通常可加速农药的降解。一些土壤在施用农药后,由于微生物种群的代谢适应而导致药效降低,随后在土壤中这些微生物对农药的生物降解潜力逐渐增强。例如,在重复使用丙炔草酮和二氯喹啉酸的土壤中,鞘氨醇单胞菌富集增加,进而促进了丙炔草酮和二氯喹啉酸的降解[76]。蒋晨等[77]在农田土壤中发现了降解扑灭津的微生物群落,暴露11 d后,约95%的扑灭津被降解。几种微生物相互作用也可加速农药的降解。有研究表明,微生物组合中光合自养生物和异养生物相互作用可促进水环境中农药的降解[78]。此外,存在于植物体各部位的微生物对农药也有一定的降解作用,如封国君[79]在茅草、飞机草和番石榴等植物中筛选出了可降解二甲四氯的植物内生菌。值得注意的是,根际微生物与植物相互作用有利于抵御生物和非生物胁迫,这一发现已引起众多研究者的关注[80-81]。小麦根际内生菌SR80可通过调控小麦体内防御基因表达和代谢通路,来抵御病原菌的入侵,并促进植株生长[81]。已有研究发现黄瓜根际分离得到的菌株P620对对羟基苯甲酸具有较强的降解能力,并缓解了对羟基苯甲酸累积对黄瓜植株产生的胁迫反应[80]。在根际内生菌与植物互作抵御农药胁迫方面,通过代谢降解植物吸收的某些除草剂或诱导植物进行更高水平的代谢降解,能使某些植物具有一定程度的除草剂耐受性[82-83],如最近的一项研究通过接种内生菌CIMAP-A7降低了阿特拉津在药用植物穿心莲中的含量,并改善了阿特拉津诱导的氧化应激反应[84],推测内生菌可能通过2个方面参与植株对农药的耐受性:一是通过其降解代谢外源物质的能力直接促进农药解毒;二是通过诱导增强宿主的应激反应来抵抗农药引起的毒性[82]。当然,这些假设需要大量的研究来验证,且需要进一步探究根际内生菌与植物互作抵御农药胁迫的分子机制。
3 农药在植物和微生物中代谢转化的研究方法
3.1 农药在植物和微生物中代谢产物的分析方法
放射性同位素示踪技术是一种利用含有放射性同位素标记的化学物质来研究生物体内各种物质分解和合成过程的手段,其具有灵敏度高、干扰少、结果准确、操作简单等优点[85]。在农用化学品研究方面,放射性同位素示踪技术被广泛应用于农药的吸收、传导、代谢行为与代谢产物的鉴定研究中[9]。14C、32P、35S、35Cl和3H是农药放射性配体中常用的标记物[86]。刘西莉等[87]研究了14C标记的腈菌唑在小麦幼苗中的吸收与传导行为。李薇[48]采用14C同位素示踪技术研究了苯醚菌酯在黄瓜中的代谢产物与途径,结果发现苯醚菌酯在黄瓜中产生6种代谢产物,存在3条代谢途径。也有研究将放射性同位素示踪技术与其他技术相结合,用于农药化合物在植物体内的代谢研究,如闻樊婷[46]采用放射性同位素示踪法结合液体闪烁测量仪与高效液相色谱-质谱联用技术,鉴定了毒氟磷在大豆豆子和豆叶中的代谢产物。由于放射性同位素具有电离辐射效应,其造成的环境污染及对人体健康的影响也不容忽视[85]。
高分辨质谱技术借助其超高分辨率可对化合物的精确分子量进行测定,并可依据同位素离子的丰度来推断化合物的元素组成,也可根据一级和二级谱库对未知代谢物进行筛选与确证[88]。近年来,高分辨质谱技术(QTOF-MS)由于具有高灵敏度、高分辨率、质量精度等优势在农药代谢研究中得到广泛的应用。葛国芹等[89]利用LC-QTOF-MS技术鉴定了啶虫脒等4种新烟碱类农药在茶树中的代谢产物。Chen等[30,90]运用HRLC-Q-TOF-MS/MS分析方法分别鉴定了氟磺胺草醚和硝磺草酮在水稻中的代谢产物。Tao等[8]利用UPLC-TQD-MS/MS技术研究了新烟碱类杀虫剂吡虫啉在莴苣等3种植物中的代谢与转化行为。高分辨质谱技术也被应用于鉴定农药在微生物中的降解产物研究。Zhang等[91]利用HRLCQ-TOF-MS/MS技术表征了土壤微生物对乙草胺的降解产物,其中主要包括10种I相代谢物和8种II相轭合物。目前,高分辨质谱仪相较于低分辨的三重四极杆质谱仪在化合物定性方面具有一定的优势,但其定量功能还需要进一步的改善。此外,核磁共振技术也可用于代谢产物的辅助鉴定,该技术可提供有关现有官能团的类型和数量的信息,从而辅助代谢产物的鉴定[92];质谱成像技术有利于对农药母本化合物和代谢产物进行实时追踪,利于明确化合物在植株各部位的分布与累积[93]。
3.2 农药在植物和微生物中代谢的分子机制研究方法
高通量测序技术、分子克隆技术等分子生物学方法通常被用于研究农药在植物中代谢的分子机制[27]。
基于高通量测序技术获得差异表达基因。该技术是将试验组和对照组2组样本进行RNA-seq测序,通过生物信息学分析获得差异表达基因,进一步明确各差异表达基因的代谢通路及其生物学功能,并采用qRT-PCR技术对RNA-seq测序结果进行验证,如张静静[45]利用RNA-seq测序技术分析差异表达基因,并采用qRT-PCR技术进行验证,获得了紫花苜蓿对阿拉特津解毒代谢相关的响应基因;Huang等[94]通过RNA-seq测序获得了参与莠去津和异丙隆在水稻中解毒代谢的漆酶基因,并利用毕赤酵母细胞异源表达进行功能验证。
基于分子克隆技术获得目标基因的过表达株系。研究植株中基因的生物学功能,并利用基因工程技术将该基因进行异源表达,进一步验证其功能,如苏湘宁[44]利用分子克隆技术获得了糖基转移酶基因OsIRGT1过表达的水稻株系,研究了该基因在调控水稻体内异丙隆和乙草胺代谢与解毒过程中的作用,并将该基因在毕赤酵母中进行异源表达,进一步验证了其在异丙隆和乙草胺降解代谢中的生物学功能;Pan等[35]结合RNA-seq测序和分子克隆技术获得了醛酮还原酶基因(EcAKR4-1)过表达的水稻幼苗株系,验证了EcAKR4-1在草甘膦代谢中的作用,并将该基因导入大肠杆菌中,发现其能够促进草甘膦代谢为氨甲基磷酸和乙醛酸。
利用分子对接技术进行结构模型预测。该技术也被用于农药分子与植株代谢酶作用模式的分子机制研究中,如Vemanna等[36]对水稻的醛酮还原酶基因OsAKR1进行了表征,并通过分子对接研究表明,OsAKR1能有效地与草甘膦分子结合;Lu等[95]通过同源建模对LOC_Os04g09604酶与阿拉特津之间的拓扑相互作用进行分析,并通过分子对接进行验证。也有研究利用结构模型预测稗草醛酮还原酶基因EcAKR4-1与草甘膦进行氧化结合[36]。
研究农药在微生物中降解与代谢的分子机制与农药在植物中代谢分子机制研究的手段类似[96-97]。例如,Agrawal等[97]从鱼腥藻(Anabaena sp.)PCC7120中鉴定到一个能够促进丁草胺降解的醛酮还原酶基因AKR17A1;Gao等[98]从芽孢杆菌(Bacillus sp.)hys-1中克隆得到能够降解乙草胺和丁草胺的C-脱烷基酶基因dbo。已有研究表明,克雷伯氏菌(Klesiella jilinsis)2N3可以降解氯嘧磺隆。通过对该菌株进行基因组学和转录组学分析,并采用基因敲除和基因异源表达等技术验证了水解酶基因Kj-mhpC-2096、细胞色素P450基因Kj-CysJ和糖基转移酶基因Kj-gst是菌株2N3降解氯嘧磺隆的响应基因[99-101]。陈雪婷等[102]通过比较基因组学方法预测了樊庆生氏红球菌(Rhodococus qingshengii)YL-1是降解噻酮嗪的相关基因。另外一项研究通过基因突变证明了nahQ基因与鞘脂菌(Sphingobium sp.)QC-18降解代谢敌草胺有关[103]。
4 农药在植物和微生物中代谢相关基因及其应用
4.1 抗性作物品种培育
在植物中过表达与农药解毒代谢相关的抗性基因可以提高植株对该农药的抗性水平,从而降低农药对植物的毒性。例如,在抗草甘膦稗草中,醛酮还原酶基因EcAKR4-1的表达量明显高于敏感性植株。研究人员在水稻幼苗中过表达此基因,发现其可促进水稻幼苗对草甘膦的代谢,水稻幼苗表现出抗草甘膦特性[36]。Pan等[104]研究发现了稗草对五氟磺草胺的抗性基因,即细胞色素P450基因CYP81A68,在水稻中过表达该基因可增强植株对五氟磺草胺、氰氟草酯和甲磺草胺的抗性。基于植物代谢酶基因的转基因作物的研究目前仍处于实验室研究阶段,未来需要开发商业化的转基因作物,并不断挖掘与代谢解毒功能相关的基因,这将有助于明确分子调控机制和抗除草剂作物的培育。
草甘膦在土壤中有2种主要的微生物降解途径(图2),其中一种类型的降解由草甘膦氧化还原酶(GOX)介导,分解草甘膦C-N键产生氨甲基膦酸(AMPA);另一种类型的降解则通过C-P裂解酶形成肌氨酸和无机磷酸[105]。将微生物中参与该降解途径的酶基因转入作物中可培育抗草甘膦作物,如大肠杆菌(Escherichia coli)中草甘膦氧化酶基因编码草甘膦氧化还原酶(GOX),可将其导入水稻体内,从而产生对草甘膦抗性的水稻植株[106];将根癌农杆菌(Agrobacterium sp.)中的CP4-EPSPS基因导入烟草体内,可编码不敏感的5-烯醇式丙酮莽草酸-3-磷酸合成酶(EPSPS),从而使烟草对草甘膦产生抗性[107]。另有研究将细菌中的有机磷水解酶(OPH)基因转入烟草植株中,从而增强了其对甲基对硫磷的降解[108]。目前,将微生物基因转入非靶标作物,如水稻、油菜中来培育抗草甘膦作物已发展较为成熟,未来研究需要挖掘更多的微生物降解基因,并评价其在不同非靶标作物中表达后对多种农药产生抗性的能力。
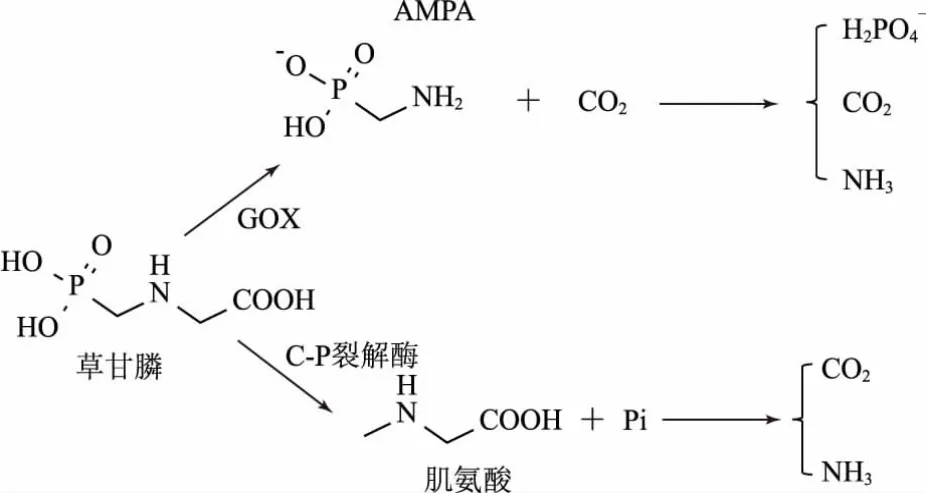
图2 草甘膦在微生物中的降解途径
4.2 环境修复
微生物的解毒和降解能力常被用来进行土壤和水体中农药污染的修复。农田土壤中扑灭津的施用可诱导微生物群落降解基因AtzB、AtzC和TrzN的表达,从而促进扑灭津的降解[77]。杜晓敏[109]筛选出能够降解毒死蜱的芽孢杆菌(Bacillus sp.)H27,并将其应用在毒死蜱污染的农田土壤中。刘畅[110]筛选出一株能够降解阿特拉津的肠杆菌(Enterobacter sp.)AT-b3,并以硅藻土为载体制备修复菌剂,发现施用该菌剂28 d后,其对土壤中阿特拉津的降解率可达80%。近年来,微生物表面活性剂被应用于土壤和水体中的农药污染修复,这是一种具有环境可持续性的环保方法[111]。基因工程微生物也被用于农药的降解与监测,如Li等[112]将能自发荧光的报告蛋白EGFP和能水解多种有机磷农药、底物特异性广的有机磷水解酶编码区克隆到表达载体pET-28b中构建基因工程菌,该方法可用于环境中有机磷农药的降解与监测。
植物修复是另一种修复受农药污染的水体和土壤的绿色策略。Lv等[113]研究了芦苇对水培营养液中抑霉唑和戊唑醇的修复效果,发现其对2种农药的吸收、转运与代谢行为同时发生,试验结束时水中农药去除率分别为96.1%和99.8%。Lyu等[114]研究表明,5种湿地植物对戊唑醇的去除途径主要是植物吸收后的内部降解和植物代谢。Azab等[115]通过室内和温室试验研究了细胞色素P450转基因植物在农药污染土壤修复中的潜在应用,转细胞色素P450基因(CYP1A2)的拟南芥植株能够代谢大量的除草剂和杀虫剂。此外,植物的根系分泌物与根际微生物相互作用可促进污染土壤中农药的降解,如黑麦草根系分泌物促进了根际微生物群落的富集,进而增强了有机氯农药的降解[116]。
5 展 望
农药在植物和微生物中的代谢转化是涉及多重生物酶参与的复杂的生物化学过程。同时,其降解与代谢行为也受到诸多因素的影响,如植物品种、环境条件、外源物质与植物内源物质等。深入探究农药在植物和微生物中的代谢转化行为及机制,对于农药残留毒性评价、代谢抗性、抗性作物品种培育及环境污染修复等方面具有重要意义。未来该领域需进一步研究和开发的方向如下:
(1)目前大多数研究主要集中于除草剂在植物中代谢行为及机制研究,其他类型农药如杀虫剂和杀菌剂等在植物中的代谢行为与机制需要进一步阐明;在复杂的环境条件下,农药或其他污染物共暴露对其中一种或几种农药代谢行为的影响需要进一步研究,利用体外细胞筛查技术可以更快地获得目标农药的代谢行为模式。此外,参与农药在植物和微生物中代谢的生物酶及其调控基因也需要进一步挖掘与验证。
(2)在微生物降解农药应用于环境修复方面,需要筛选更多的微生物降解菌群,明确其降解代谢农药的机制。再者,微生物与植物共代谢农药,尤其是根际内生菌与植物互作对农药的共代谢机制及其防御机制也需要深入研究,同时研究结果也可为微生物与植物联合修复农药污染提供理论依据。
(3)纳米技术已广泛应用于农药剂型研制中,成为农药剂型研究的前沿领域。纳米农药在植物中的吸收代谢行为与机制和常规农药是否存在不同也值得关注;利用功能纳米材料与植物酶相互作用调控农药在植物中的吸收与代谢,是否可同时实现农药的解毒与增效也值得进一步研究,这对促进农药的减施增效具有重要意义。
(4)需要开发与农药代谢研究相配套的研究技术和平台,如高分辨质谱、分子克隆、组学技术、生物信息学技术、同位素示踪、荧光定量可视化及质谱成像技术等。
