基于16S rRNA 高通量测序技术探究补中益气加减方对胃癌荷瘤小鼠肠道菌群的影响
2022-08-11陈亚玲张瑞娟孙庆敏
陈亚玲 陈 旭 张瑞娟 孙庆敏
(南京中医药大学附属医院,江苏南京 210029)
胃癌是我国常见的消化道恶性肿瘤,其发病率和死亡率在胃肠道癌症中均位居第二[1]。近年来对胃癌发病机制已有较深入的研究,但仍未完全明确。肠道微生态被称为“被遗忘的功能器官”[2],研究证实其与多种疾病相关,如炎症性肠病和胃癌、结直肠癌等多种肿瘤。相关研究表明,胃肠道菌群产生的代谢产物可抑制胃癌发展,如促进肠道稳态、调节免疫环境、促进机体免疫应答[3-5],又可促进胃癌细胞转移[6]。
中药服用方式主要为口服,进入胃肠道后必与肠道微生物接触。补中益气加减方是全国名中医刘沈林教授结合胃癌的主要病机“脾气虚损,癥瘕积聚”,由经典名方“补中益气汤”化裁所得。临床实践证实,本方能明显延长晚期胃癌患者的生存期,但其是否通过调节肠道菌群来发挥抗肿瘤作用目前尚未有报道。本课题组前期研究发现,补中益气加减方可以降低外周血中程序性死亡受体1(PD-1)的表达,减少PD-1和PD-L1在肿瘤细胞中的浸润[7],提示该方可能通过调节肿瘤微环境中PD-1,从而抑制胃癌进展。另有研究表明,肠道微生物可通过干扰PD-1信号通路发挥抗肿瘤作用,现有临床证据也提示PD-1抗体的治疗效果部分依赖于患者肠道微生态[8]。本研究制作胃癌荷瘤小鼠模型,观察补中益气加减方对模型小鼠瘤质量的影响,并运用16S rRNA高通量测序技术,分析补中益气加减方和PD-1抗体对胃癌荷瘤小鼠肠道菌群组成的影响,探讨两种药物是否通过调节肠道菌群组成发挥抗肿瘤作用,为治疗胃癌药物的研究提供实验依据。
1 实验材料
1.1 实验细胞和动物 MKN-28人胃癌细胞购自中国科学院上海生物科学研究所。细胞培养于含有10%新生牛血清的RPMI 1640培养基中,培养皿置于37 ℃、5%CO2的湿化培养箱中,隔日更换一次新鲜培养基,所有用于实验的细胞传代不超过7次。SPF级小鼠,体质量18~22 g,购自斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010,实验动物使用许可证号:SYXK(苏)2017-0069。小鼠饲养于南京医科大学动物研究中心动物房,动物房室温为20~24 ℃,饲料、饮水和鼠笼均严格消毒。本实验通过南京医科大学实验动物伦理委员会审查,伦理编号:IACUC-1703033。
1.2 药品与试剂 补中益气加减方由黄芪、党参、当归、甘草、升麻、柴胡、白术、陈皮、三棱、莪术按30∶15∶10∶5∶6∶6∶10∶10∶15∶15的 比 例 配 伍 组 成,药物饮片均由南京中医药大学附属医院中药房提供。将药材用1500 mL的双蒸水浸泡30 min,先武火煮至沸腾,再文火煮30 min,倒出药液;加1000 mL水重复上述步骤。混合2次煎煮所得的药液,倒入锅中浓缩至中药浓度为1 g/mL。将浓缩的中药2000×g离心15 min,3次,上清药液置于4 ℃冰箱备 用。鼠 源PD-1抗 体(Bio X cell,美国,货 号:BE0146),RPMI1640培养液(Gibco,美国),新生牛血清(Gibco,美国),DNA提取试剂盒(Thermo公司),AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)。
1.3 主 要 仪 器 1300A2型 生 物 安 全 柜,HERAcell 1501型CO2培养箱(Thermo公司);-80 ℃超低温冰箱(Thermo公司);超纯水机(millipore公司);高速离心机(Thermo公司);电子天平(Mettler公司);HiSeq2500 PE250型测序系统(Illumina公司)。
2 实验方法
2.1 造模 无菌条件下,将MKN-28人胃癌高转移细胞消化重悬为3×107/mL。取24只小鼠,每只小鼠腋下皮下注射0.2 mL混匀的肿瘤细胞悬液,约为6×106个细胞。每日相同时间观察小鼠的肿瘤生长情况,待瘤块长到5 mm3时为造模成功,可以进行后续实验。
2.2 分组与给药 造模成功的小鼠随机分为模型组、补中益气加减方组(中药组)和PD-1抗体组(阳性药物组),每组8只。另取8只正常小鼠作为正常组。中药组按每日25 g/kg体质量灌胃给药,每日1次,连续24 d;阳性药物组按每次10 mg/kg体质量,每3日1次腹腔注射给药,共注射8次;正常组和模型组灌胃等体积的生理盐水,每日1次,连续24 d。给药开始后的24 d为给药期。
2.3 小鼠体质量检测 各组小鼠均从给药第1天开始测量体质量,每6天测量1次。
2.4 小鼠瘤质量检测 给药期结束后脱颈椎处死小鼠,用手术剪剪开小鼠肿瘤周围皮肤,用镊子小心分离肿瘤附近组织,将剥离出来的肿瘤放在垫有锡箔纸的冰上。待所有肿瘤都取下后,称重,记录数据,按组别摆放、拍照。
2.5 粪便样本收集 给药期结束后将小鼠脱颈椎处死,用经酒精消毒的镊子取盲肠部位内容物置于灭菌的EP管中,每只小鼠收集3~4颗,-80 ℃保存备用,用于16S rRNA高通量测序分析。
2.6 16S rRNA高通量测序技术检测小鼠肠道菌群
2.6.1 DNA提取与测序 利用DNA提取试剂盒提取粪便中的总DNA,检测DNA的纯度和浓度,用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
2.6.2 PCR扩增 对16S rRNA基因V3-V4可变区进行PCR扩增,引物为338F(5’-ACTCCTACGGGA GGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTC TAAT-3’)。每个样本重复3次,将同一样本的PCR产物混合,然后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,纯化,Tris-HCl洗脱,最后用2%琼脂糖电泳检测。
2.6.3 荧光定量 利用QuantiFluor™-ST(Promega,USA)进行荧光定量检测,并按样本的测序量要求,对其进行对应比例的混合。
2.6.4 构建文库 使用Illumina MiSeq PE300测序仪将纯化后的扩增片段构建为PE文库,根据overlap关系对Miseq测序得到的PE reads序列进行拼接,并对其进行质控和过滤,得到优化序列,最终获取操作分类单元(OTUs)。
2.6.5 生物信息学分析 对OTUs进行聚类分析和物种分类学分析,基于OTUs进行α多样性分析和β多样性分析。α多样性指数分析物种的种类和丰富度,β多样性指数分析物种的组间差异和组内差异。通过物种组成分析可发现小鼠肠道微生物区系在门水平和属水平上的物种差异性。
2.7 统计学方法 数据使用GraphPad Prism 7软件进行处理,结果以(xˉ±s)表示。2组间比较采用独立样本 t 检验,多组间比较采用单因素方差分析(One-way ANOVA),方差齐则采用LSD检验,方差不齐则采用Dunnett's检验。P<0.05表示差异有统计学意义。
3 实验结果
3.1 各组小鼠体质量和瘤质量比较 如图1-A所示,给药期间各组小鼠体质量波动不明显,给药第24天,模型组与各给药组小鼠体质量与正常组比较差异无统计学意义(P>0.05),说明药物在体内几乎没有明显毒性作用。如图1-B、图1-C所示,与模型组比较,中药组和阳性药物组瘤质量均显著降低(P<0.05,P<0.01),中药组与阳性药物组组间瘤质量比较差异无统计学意义(P>0.05),表明中药和PD-1 抗体对胃癌荷瘤小鼠肿瘤的生长均有明显的抑制作用。

图1 各组小鼠体质量变化(A)、给药结束后瘤质量比较(B)和剥离后肿瘤形态比较(C)
3.2 各组小鼠肠道菌群多样性比较 如图2-A所示,小鼠肠道菌群的数量随着样本数量的增加而趋于某一恒定值,表明测序数据量合理,测序深度足以反映样本中群落丰度水平。如图2-B所 示,16S rRNA基 因V3-V4可变区的理论长度为400~440之间,将所有测得的序列进行统计,大部分序列的长度为400~420和420~440,即处于理 论长度范围内,表明测序质量良好。如图2-C所示,利用OTUs分布Venn图分析组间菌群OTUs数量(OTUs数量又可代表群落丰度)和其种类交叉情况。各组特异性/总的OTUs数目分别为:正常组1309/8508、模型组6236/12 995、中药组1110/7953、阳性药物组462/5919,各组共检测OTUs 17 905个,其中共有OTUs 3143个,为总OTUs数的17.55%。与正常组比较,模型组的OTUs数量升高;与模型组比较,中药组和阳性药物组的OTUs数量降低,接近于正常组。这一结果表明中药和PD-1抗体可能降低了肠道菌群的整体水平和多样性。

图2 小鼠肠道菌群的Specaccum物种累积曲线(A)、优质序列分布(B)和各组小鼠肠道菌群OTUs分析(C)
α多样性通过对肠道菌群的丰富度指数和多样性指数进行分析来评估微生物的多样性,包括丰富度指数(Observed_species、Chao1)和多样性指数(PD_whole_tree、Shannon)。分析结果如表1所示,与正常组比较,模型组小鼠肠道菌群丰富度指数和多样性指数均显著升高(P<0.01,P<0.05);与模型组比较,中药组、阳性药物组小鼠肠道菌群丰富度指数和多样性指数均显著降低(P<0.01)。与中药组比较,阳性药物组小鼠肠道菌群丰富度指数和多样性指数均有所升高,但差异无统计学意义(P>0.05)。结果表明,与模型组比较,中药组、阳性药物组的肠道菌群丰富度和多样性均显著降低,且趋近于正常组。

表1 各组小鼠肠道菌群的α多样性指数分析(xˉ±s)
β多样性可通过主成分分析(Principal Component Analysis,PCA)来研究微生物群落间构成的差异。如图3所示,模型组和正常组小鼠的肠道菌群明显分开,表明这2组小鼠的菌群结构组成存在显著性差异;中药组接近正常组,表明其菌群多样性和结构组成与正常组接近,可能和正常组存在着一定的关联性。

图3 各组小鼠肠道菌群的β多样性分析
3.3 各组小鼠肠道菌群组成与结构分析
3.3.1 门水平肠道菌群组成 如图4-A所示,除去部分未检测出的菌门,主要由拟杆菌门 (Bacteroidetes)、厚 壁 菌 门(Firmicutes)、变 形菌门(Proteobacteria)等3个菌门组成,其中拟杆菌门和厚壁菌门的丰度在检测出的菌门中比例达到90%以上。与正常组比较,模型组小鼠肠道中Bacteroidetes丰度降低,Firmicutes、Proteobacteria丰度升高,差异均无统计学意义(P>0.05);与模型组比较,中药组和阳性药物组Bacteroidetes、Proteobacteria丰度升高,Firmicutes丰度降低,差异均无统计学意义(P>0.05)。与正常组比较,模型组小鼠Firmicutes/Bacteroidetes值(F/B值)显著升高(P<0.01);与模型组比较,中药组、阳性药物组小鼠F/B值显著降低(P<0.05,P<0.01)。表明给药处理后可回调小鼠肠道菌群的菌门水平和结构组成,从而发挥抗肿瘤作用。详见图4-B。

图4 各组小鼠肠道菌群在门水平上的组成(A)、F/B值比较(B)
3.3.2 属水平肠道菌群组成 小鼠粪便样品中共检测到212个菌属,各组属水平组成如图5所示。测序结果发现,与正常组比较,模型组小鼠具有显著性差异的菌属有37个;与模型组比较,中药组小鼠具有显著性差异的菌群靶点有12个,阳性药物组小鼠具有显著性差异的菌群靶点有18个。此外如表2所示,我们发现与模型组比较,中药和PD-1抗体可共同调节Muribaculum、Enterorhabdus、A n a e r o s t i p e s、B a r n e s i e l l a、Clostridium、Lacrimispora、Mediterraneibacter、Lactonifactor、Dorea、Streptococcus10个 菌 群 靶点(P<0.01,P<0.05),但 中 药组和阳性药物组组间的菌属差异无统计学意义(P>0.05)。

表2 各组小鼠肠道菌群具有显著性差异菌属的相对丰度值(xˉ±s)
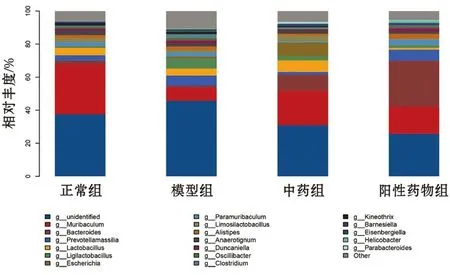
图5 各组小鼠肠道菌群在属水平上的组成
4 讨论
中医学认为,胃癌是由饮食不节、正气虚弱、情志内伤等多因素导致。中医药治疗具有整体观和辨证论治特色[9],其强调的“整体观”与微生态理论强调的“平衡与协调”相一致[10]。肠道菌群是由肠道内众多的真菌和细菌等微生物组成,其组成改变可导致肠道微生态的变化,肠道平衡被打破与肿瘤发生发展密切相关。中医药可通过多种方式调节胃肠道微生态,使其达到平衡,如抑制病原菌在肠道中定植、促进免疫应答的产生[11]等,从而达到抗肿瘤作用。也有研究表明,中医证候表型与肠道菌群相关[12],特别是脾虚证[13]。有报道表明以健脾养胃法为主要治则的方药可通过多靶点多层次的途径调节肠道菌群,发挥抗肿瘤作用[14]。陈彬等[15]研究证实健脾解毒方可增加益生菌的数量,促进其定植和活性,抑制瘤体的生长。补中益气加减方针对胃癌患者的基本病机“脾气虚损”而拟,因此其可能也通过调节肠道菌群实现治疗胃癌的目的。PD-1的配体PD-L1在几种癌症中高度表达,因此PD-1在癌症免疫逃避中的作用已得到很好的证实。许多肿瘤细胞表达PD-L1,抑制PD-1和PD-L1之间的相互作用可以增强体外T细胞反应并介导临床前抗肿瘤活性。
肠道菌群组成的变化可能改变肠道微生态,对患者的代谢和免疫功能造成影响,从而导致胃肠道疾病和自身免疫疾病[16]。朱燕燕等[17]运用PCRDGGE基因指纹图谱技术检测出了在胃癌患者和健康正常个体之间,肠道菌群的组成和结构存在显著性差异。也有研究表明胃中的微生物参与致癌物的产生[18],细菌过度生长是潜在的促癌因子[19]。本研究中Venn图、β多样性分析结果表明,造模使肠道菌群结构发生明显变化,但其在给药后逐渐恢复,接近正常组,表明补中益气加减方和PD-1抗体可能通过改善小鼠肠道菌群的丰度和β多样性发挥抗肿瘤作用。肠道菌群组成与结构分析表明,补中益气加减方和PD-1抗体可回调3个菌门和10个菌属。在门水平上,造模后Bacteroidetes丰度降低,Firmicutes、Proteobacteria丰度升高,给药处理后回调。目前研究提示与胃癌相关的细菌,主要包括Streptococcus和Clostridium等[20-21]。Streptococcus感染与胃癌相关[22],在胃癌中具有潜在的致癌作用[23]。Clostridium在胃癌组织中含量增加,并在胃癌患者胃微环境中定植[24]。有研究发现,Clostridium定植使Treg细胞发育的关键调节因子TGF-β含量增加,还可明显促进Foxp3表达细胞的分化[25]。带有Clostridium簇XIVa相关鞭毛蛋白特异性TCR的Foxp3+Treg细胞可以诱导肠道中的IgA+B细胞减少黏膜对微生物区系抗原的摄取,并阻止T细胞的激活[26]。Clostridium还可直接或间接将信号传递给条件树突状细胞,驱动Treg细胞或效应性T细胞的形成,影响Treg细胞的发育和功能[27]。Barnesiella可改变肿瘤的微环境,减少调节性T细胞,刺激同源的抗肿瘤细胞毒性T细胞(CTL)反应[28]。本研究结果表明,补中益气加减方和PD-1抗体能够改善胃癌荷瘤小鼠肠道菌群α、β多样性,并对10种差异菌属具有显著回调能力,使肠道微环境由紊乱恢复平衡,表明其通过多靶点、多途径发挥治疗作用。
综上,与模型组比较,补中益气加减方和PD-1抗体单独给药均可明显抑制胃癌荷瘤小鼠瘤质量,可有效改善胃癌荷瘤小鼠肠道菌群多样性的变化,回调Streptococcus、Clostridium和Barnesiella等10个 相 关 菌属,维护肠道微生态平衡,增强机体免疫,从而发挥抗肿瘤作用。本研究检测指标补中益气加减方和PD-1抗体组间差异不大,说明中药的效果和PD-1抗体类似,表明补中益气加减方抑瘤作用的潜在机制和PD-1抗体存在部分共同点,可能是通过它们共同调控的10个菌属发挥作用,但详细的机制还需进一步的实验验证。鉴于肠道菌群在肿瘤治疗中的重要性,本课题组未来将聚焦于此次发现的10个差异菌属在消化道疾病或消化道肿瘤中可能具有的功能,并对这些菌属进行鉴定,从而研究是否能分离出可预防消化道疾病或肿瘤的益生菌。
