生物样本库中Whipple手术根治标本的规范化解剖、拍照及样本采集
2022-08-11葛美玲丁杰刘艳红高玒王小巍胡月
葛美玲,丁杰,刘艳红,高玒,王小巍,胡月
·生物样本库建设·
生物样本库中Whipple手术根治标本的规范化解剖、拍照及样本采集
葛美玲,丁杰,刘艳红,高玒,王小巍,胡月
210008 江苏,南京大学医学院附属鼓楼医院生物样本库
胰腺十二指肠切除术,即“Whipple 手术”,是普外科最复杂、手术并发症和病死率均很高的手术。累计手术区的癌症主要包括胰腺癌、远端胆管癌、壶腹部癌和十二指肠肠癌。胰腺位于腹膜后间隙,起源于中胚层的原肠。胚胎发育第 4 周,前肠和中肠交界处出现腹侧和背侧膨出,即腹胰芽和背胰芽,前者分化为腹侧胰腺,后者分化为背侧胰腺。其中,腹侧胰腺又分为左、右两叶,左叶在分化的过程中逐渐萎缩。在第 7 周时,发育中的腹侧胰腺、胆囊和胆管顺时针旋转至十二指肠后方,并在腹膜后与胰腺背侧相连,腹侧胰腺与背侧胰腺融合为胰腺。腹侧胰腺形成钩突和胰头的大部分,背侧胰腺形成胰头的小部分、胰体和胰尾。如果在胚胎发育过程中腹侧胰腺与背侧胰腺融合不良,则会导致分裂胰、环形胰、异位胰腺等畸形。胰腺融合的同时胰管也相互融合,腹胰管与背胰管的远侧端融合形成主胰管,背胰管的近侧端逐渐退化,或保留为副胰管,并开口于十二指肠副乳头,仅引流胰头部少量胰液。如果背、腹胰管未能融合或者仅为细的分支融合,主胰管只能引流腹侧胰腺分泌的胰液,而副胰管则成为胰腺的主要引流管,容易造成胰液引流不通畅而导致胰腺炎发生。临床上主要表现为胰腺炎和胰腺假性囊肿[1-3]。美国癌症分期联合委员会(AJCC)分期第八版对病理取材和诊断提出了更新的要求。为了准确诊断肿瘤和病理分期,以指导患者术后处理和愈后随访,提高患者术后生存率,术后规范化的病理检查尤为重要。本文主要介绍我们对 Whipple 手术根治标本的规范化解剖、拍照及样本采集的经验,满足临床对肿瘤及其生物学行为评判的需要,满足生物样本库样本留取和科研需求。此外,清楚的巨检照片,有利于与临床影像对比研究。
1 材料与方法
1.1 材料
于南京大学医学院附属鼓楼医院行 Whipple手术后的胰腺十二指肠切除组织,主要包括胰腺癌、远端胆管癌、壶腹部癌和十二指肠肠癌,保存于江苏省科技资源(重大疾病生物样本)统筹服务平台南京鼓楼医院生物样本库。
1.2 方法
1.2.1 标本取材 胰十二指肠手术标本一般包括远端胃、十二指肠、Vater 壶腹、肝外胆管、胆囊和部分胰腺这几个基本组分;部分保留幽门的 Whipple 手术没有胃组织。标本剖开前,可根据临床医生送检的评估表和模式图,先预判病变位置,与周围组织的关系;若无评估表和模式图,可在电子病历系统中查询相关病史和影像学信息。
拿到标本后,首先判断还原标本的正常体位,判断胰腺腹侧和背侧,然后可参考临床资料通过触诊预判肿瘤的部位、大小和周围关系。沿十二指肠乳头对面剖开十二指肠,胃壁沿大弯剪开,胆囊底部剖开小口放出胆汁后沿腹腔面剖开,剖开后观察黏膜有无肿块,必要时清理胃、十二指肠和胆囊内容物,将标本冲洗干净。然后探查胆总管,首先寻找胆管切缘,大多数位于在胰腺断端切缘背侧附近,一般会有黑色缝线标记,用手触摸胰腺背侧脂肪,可触摸到直径 0.5 ~ 1.5 cm 的管道即为胆管,循胆管可找到切缘。找到胆管切缘后,用探针沿管道探查,直到探针从十二直肠乳头探入肠腔。查找主胰管时,找到胰腺断端切面,在断端切面查找主胰管开口,通常开口位于切面中央位置,管壁较薄,用探针探查主胰管至十二指肠乳头开口处。打开胆总管和主胰管前,需要结合胆总管、主胰管和肿块的位置,选择解剖时从胰腺的前方剖开还是后方剖开。从胰腺前方剖开一般需要剖开厚实的胰腺实质,容易暴露胰腺内肿瘤情况,容易探查副胰管,且不会损伤钩突切缘和后腹膜切缘,但剖开双管时有一定难度;从胰腺后方剖开,由于不用切开厚实的胰腺实质,双管剖开较容易,胆总管容易暴露,但需要注意避免损伤钩突切缘和后腹膜切缘。一般胰腺癌或远端胆管癌可以从胰腺前方剖开,暴露肿瘤主体,而壶腹部癌由于累及胰腺可能较少,一般可沿胰腺后方剖开。无论从前方还是后方剖开,都应注意角度和走位,尽量平行剖开胆总管和主胰管,避免剖开一个管道而损伤另一个管道。胆总管的管壁较厚,表面呈颗粒状,较粗糙,颜色较深;主胰管的管壁较薄,表面光滑,较透明,解剖时可以通过这些特征鉴别胆总管和主胰管。此外,标本打开前注意切缘的标注,包括胆总管切缘、胃切缘、十二指肠切缘、胰腺钩突切缘、后腹膜切缘和胰腺断端切缘等,方便后期切缘的取材和诊断,在病理报告中需要注明切缘有无癌组织累及。
解剖标本后,暴露肿块,根据肿块大体外形对肿瘤起源做出初步判断。胰腺癌一般肿瘤切面呈灰白色,质地硬韧,与周围胰腺组织界限不清;胰头癌早期可浸润胆总管和胰管,使胆总管和胰管管腔狭窄甚至闭塞。只有少数的胰头癌可穿透十二指肠肠壁在十二指肠肠腔内形成肿块。远端胆管癌表现为胆管壁局部增厚,或突入腔内,偶尔可引起管腔的环形狭窄或弥漫浸润而导致的胆管壁弥漫增厚,远端胆管癌常常侵及胰腺,因此需要注意和胰腺癌区分。壶腹部癌可生长在壶腹内,在壶腹部形成圆形隆起(壶腹内型),表面十二指肠黏膜光滑;亦可表现为壶腹区的隆起,伴有溃疡形成,或有菜花状肿物形成(壶腹周型);有些晚期病例可在胰头-壶腹区形成广泛的浸润(混合型),需要同胆管癌和胰头癌辨别[4]。
1.2.2 大体拍照
1.2.2.1 准备拍照所需材料 标本解剖后下一步进行大体拍照,拍照前需要准备好需要的材料,包括:①拍照背景的选择,通常选择黑色背景,使用表面均质的黑色丝绒布,根据标本大小裁剪成合适大小,平铺在取材台上;②准备好标尺,标尺上写上标本的唯一识别号,如住院号;③准备好相机;④准备好合适的光源,若取材台自带的灯光不合适,可额外准备拍照光源。
1.2.2.2 标本摆放 标本摆放时,注意应最大程度展现病变,明确与周围组织的关系,Whipple 手术标本应根据解剖位置将标本的几个组织部分,如胆囊、胰腺、十二指肠、胃摆放整齐,并充分暴露肿块位置,及其与胆总管和主胰管的关系。摆放后尽可能保证组织底部平整,不平整的部分,可以使用蜡块盒、橡皮泥或不用的组织垫平,用于垫平的这些材料拍照时尽量隐藏。此外,可以使用黑色丝绒背景和白色标尺,以减少反光和增强对比性,为保证拍照背景整洁干净,在标本摆放前先想好摆放位置,标本摆放时尽量一次摆放,减少移动。标本摆放整齐后可用吸水纸擦干标本表面的水、血液、墨汁,减少血污染和反光。将标尺放在一侧,通常放在标本下方或侧面,肿块部位要尽量靠近标尺。
1.2.2.3 标本拍照 拍照时,可将相机调节成微距模式,利用白色标尺对焦并测光,然后构图。为避免焦点落在非主体上,从而令主体模糊,我们可以把相机设为“单点对焦”,然后半按快门对焦,移动相机作构图,这样相机便会锁定对焦,直至完全按下快门为止。测光时建议选择点测光或中央重点测光。构图时尽量保证拍出长宽比为 4:3 的图片。注意拍摄整体及局部照片,局部包括十二指肠乳头、肿块部位、肿块与周围组织关系等。
1.2.2.4 大体照片后期处理 如果拍照时没有拍出令人满意的图片,可以通过后期处理的方法改善。使用 Photoshop CS6 打开图片,通过以下三个步骤调整图片:①通过滤镜→ 扭曲→ 镜头矫正对图片进行球面矫正;②使用标尺工具度量图片倾斜角度,通过图像→ 图像旋转→ 任意角度→ 输入调整角度,调整图片至水平后裁剪;③通过图像→ 调整→ 曲线调整图片颜色;④复合图层,获得满意的大体图片。
1.2.3 生物样本库样本采集和常规病理取材
1.2.3.1 生物样本库样本采集 为了保证样本质量,拿到标本后应尽快进行生物样本库的样本采集,样本库取材人员对大于2 cm的标本进行取材,样本库记录人员根据标本袋上的住院号,在病理系统及样本库信息系统中登记住院号并获得捐献者信息,准备好保存分割的组织样本块的冻存管、冻存盒及石蜡组织包埋盒,冻存管上贴上预打印的二维码标签或者使用预置二维码的冻存管,石蜡包埋盒写上样本库病理号及蜡块编号。取材人员区分肿瘤组织,癌旁组织和正常对照组织,用取材刀按照正常组织→ 癌旁组织→ 肿瘤组织的顺序取材;正常组织指距肿瘤边缘 5 cm 以外的组织,癌旁组织指距肿瘤边缘 2 cm 的组织;对于较小的标本,肿瘤周围组织不足 5 cm 的可只留取癌旁组织。胰腺新鲜冰冻组织大小一般为 0.5 cm × 0.5 cm × 0.2 cm[5],为避免后期使用样本时反复冻融,应注意将样本保存至不同分管中,依据标本及病变大小分装为 1 ~ 5 份,分别放入准备好的冻存管中;有研究表明,反复冻融对消化道组织尤其胰腺组织的 RNA 完整性有显著影响[6-7]。石蜡组织样本一般大小为(2.0 ~ 1.5)cm ×(1.5 ~ 1.0)cm × 0.3 cm,分装 1 ~ 2 份(依据标本及病变大小而定),分别放置于石蜡包埋盒中;分装时应遵循先正常后肿瘤的顺序,以免组织污染。在组织可能较小的情况下,优先满足新鲜冰冻组织的保存形式,取材时避免取肿瘤坏死部位及黏液较多的部位。对于淋巴结的取材,参考国家标准 GB/T 40352.1-2021《人类组织样本采集与处理第一部分:手术切除组织》的第 6 条样本采集,淋巴结是否取样及如何取样应由病理医生决定[8]。记录人员将冻存管条码扫描录入到 excel 表中,并将冻存管放入液氮罐中,石蜡组织放入 10% 中性福尔马林中固定,每例取材结束后记录人员将 excel 表中信息填写完整,当日取材结束后统一导入至样本库信息系统中,需要填写的信息主要包括:组织样本信息和国际样本前分析代码(SPREC)[9-10]。组织样本信息包括:样本类型(冰冻组织、石蜡组织、石蜡切片),项目编号,取材日期,所属住院信息,样本库病理号,取材器官,取材部位代码;样本前分析代码包括:热缺血时间、冷缺血时间、固定/稳定类型、长期储存条件、采集类型。每周将液氮罐中的所有样本转运至样本库低温存储区,放入–80 ℃冰箱中保存。冷缺血时间对样本质量尤为重要,冷缺血时间指组织标本离体后至样本固定或冷冻保存的时间[11-12],因此在处理样本过程中应保证将样本尽快放入固定液或液氮中保存。
1.2.3.2 常规病理取材 标本固定后进行常规病理取材,测量标本各部分器官大小;描述肿瘤部位、大小、颜色、质地、形状;描述累计范围,胃、胆总管、胰管受累情况,若肿瘤在壶腹部,注意壶腹内及壶腹周,是否两者均受累;描述各组淋巴结的数目和直径。标本取材:首先是肿瘤取材,包括肿瘤中央 1 块、肿瘤与胰腺交界处 1 块、肿瘤与胆管交界处 1 块、肿瘤与十二指肠交界处或壶腹部交界处1 块;其次注意切缘取材,需要留取胃上切缘、十二指肠下切缘、胆总管手术切缘、胰腺切缘;其他需要取材的部位包括十二指肠乳头处肠壁全层 1 块,各组淋巴结全部取材,其他器官均应取材(如胆囊)。此外,应注意仔细查找淋巴结,目前 AJCC 推荐查找 12 枚淋巴结。
1.2.4 样本的 RNA 质控使用 Q-sep100 核酸蛋白分析仪 RNA 卡夹检测总 RNA 的完整性,样本上机前准备分离缓冲液、稀释缓冲液和 lower marker,使用 1 × 稀释缓冲液调整 RNA 样本最佳浓度范围在 10 ~ 20 ng/μl,然后将样本 70 ℃变性 2 min,立即放冰上 5 min,开始上机检测。根据 RQN 值(1 ~ 10)衡量总 RNA 完整性,越接近 10说明总 RNA 完整性越高,越接近 1 则总 RNA 完整性越低。
2 结果
2.1 标本的规范化采集
南京大学医学院附属鼓楼医院生物样本库自 2014 年 10 月项目入组至2022 年 12 月共解剖拍摄胰腺十二指肠根治标本 465 例,所有拍摄的标本大体照片均上传至统一的文件夹保存。解剖拍摄大体照片并进行样本采集保存入库的共 355 例,1340 管。样本出库使用共 160 例,408 管,出库率为 45%(例数),30%(管数)。所有入库的样本均在样本库信息管理系统中记录冷缺血时间,样本离体至样本接收的平均时间为 10 min,样本接收至放入液氮的平均时间为 15 min,因此样本离体至放入液氮的时间即冷缺血时间平均为 25 min。样本规范化解剖、拍照及采集流程如图 1 所示。

图1 生物样本库组织标本采集入库流程
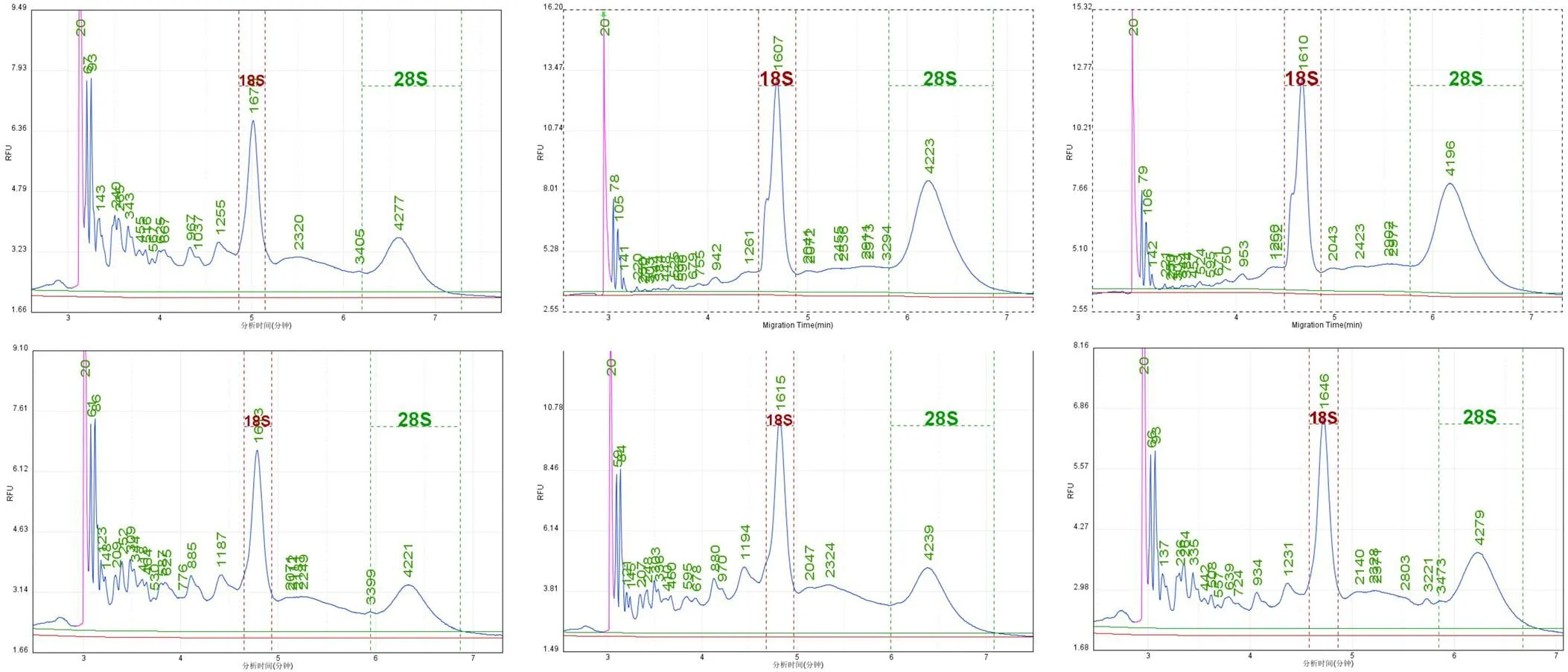
图2 6 管冰冻组织样本的 RNA 的完整性的峰图
2.2 标本的规范化质控
南京大学医学院附属鼓楼医院生物样本库会定期对样本做抽样质控,随机抽取 3 例捐献者的 6 管冰冻组织样本,提取 RNA,使用生物分析仪验证样本 RNA 的完整性,结果显示:所有 6 管冰冻组织的 RQN 值均> 6,说明 RNA 的完整性较好(图 2)。
3 讨论
Whipple 手术根治标本的规范化解剖及大体拍照可以保证后期病理诊断的准确性,准确的病理学检查结果是临床制订治疗方案、开展研究的基础[13]。生物样本库规范化的样本采集和保存可以进一步提高样本的科研价值,有研究表明,冷缺血时间对 RNA 的完整性及缺氧、应激、细胞凋亡和自噬相关基因的表达有影响。相关研究也证明了优化采集流程可以改善胰腺肿瘤样本的 RNA 质量[11, 14]。南京大学医学院附属鼓楼医院生物样本库制订了 Whipple 手术根治标本采集的标准操作流程,并参与了国家标准《GB/T 40352.1-2021 人类组织样本采集与处理 第1部分:手术切除组织》的制订,为对标本的进一步研究奠定了基础。随着肿瘤生物学的发展,越来越多的新技术应用于肿瘤研究。如人源异种移植技术(PDX)应用于肿瘤生物学研究,使得人们对肿瘤的特性有了更进一步的了解。利用免疫缺陷小鼠建立肿瘤 PDX 模型能够很好地保持患者肿瘤的遗传特性和异质性,PDX 模型的药物筛选结果可以指导临床用药[15-16]。此外,另一种肿瘤研究的重要模型是肿瘤类器官(PDO)。PDO 是精准医学和药物筛选的强大工具。与 PDX 相比,PDO 不仅在体外培养条件下能够无限增殖,可以最大程度地保持肿瘤及其体内微环境的特性,适用于大规模的药物筛选,同时还可以对该模型进行包括基因敲除、过表达和突变在内的基因编辑操作[17-18]。规范化的 Whipple 手术根治标本的取材在 PDX 和 PDO 模型构建样本采集过程中发挥重要的作用,可以为 PDX 和 PDO 模型提供精确的样本,从而促进肿瘤研究的发展。
[1] Mortelé KJ, Rocha TC, Streeter JL, et al. Multimodality imaging of pancreatic and biliary congenital anomalies. Radiographics, 2006, 26(3):715-731.
[2] El-Gohary Y, Tulachan S, Branca M, et al. Whole-mount imaging demonstrates hypervascularity of the pancreatic ducts and other pancreatic structures. Anat Rec (Hoboken), 2012, 295(3):465-473.
[3] Verbeke CS. Resection margins in pancreatic cancer. Surg Clin North Am, 2013, 93(3):647-662.
[4] Adsay V, Ohike N, Tajiri T, et al. Ampullary region carcinomas: definition and site specific classification with delineation of four clinicopathologically and prognostically distinct subsets in an analysis of 249 cases. Am J Surg Pathol, 2012, 36(11):1592-1608.
[5] Ji JF. Capacity building and best practices for biobank. Beijing: Science Press, 2013. (in Chinese)
季加孚. 生物样本库的能力建设与最佳实践. 北京: 科学出版社, 2013.
[6] Hu Y, Han H, Wang Y, et al. Influence of freeze-thaw cycles on RNA integrity of gastrointestinal cancer and matched adjacent tissues. Biopreserv Biobank, 2017, 15(3):241-247.
[7] Wang Y, Zheng H, Chen J, et al. The impact of different preservation conditions and freezing-thawing cycles on quality of RNA, DNA, and proteins in cancer tissue. Biopreserv Biobank, 2015, 13(5):335-347.
[8] State Administration for Market Regulation, Standardization Administration. GB/T 40352.1-2021 Collection and processing of human tissue biomaterial—Part 1: Surgical removal tissue biomaterial. Beijing: China Standards Press, 2021.(in Chinese)
国家市场监督管理总局, 国家标准化管理委员会. GB/T 40352.1-2021 人类组织样本采集与处理 第1部分: 手术切除组织. 北京: 中国标准出版社, 2021.
[9] Betsou F, Bilbao R, Case J, et al. Standard PREanalytical Code Version 3.0. Biopreserv Biobank, 2018, 16(1):9-12.
[10] Zhang PF, Zheng XH, Li XZ, et al. Informatics management of tumor specimens in the era of big data: challenges and solutions. Biopreserv Biobank, 2021, 19(6):531-542.
[11] Rudloff U, Bhanot U, Gerald W, et al. Biobanking of human pancreas cancer tissue: impact of ex-vivo procurement times on RNA quality. Ann Surg Oncol, 2010, 17(8):2229-2236.
[12] Song SY, Jun J, Park M, et al. Biobanking of fresh-frozen cancer tissue: RNA is stable independent of tissue type with less than 1 hour of cold ischemia. Biopreserv Biobank, 2018, 16(1):28-35.
[13] Mizutani S, Suzuki H, Aimoto T, et al. Usefulness of color coding resected samples from a pancreaticoduodenectomy with tissue marking dyes for a detailed examination of surgical margin surrounding the uncinate process of the pancreas. J Nippon Med Sch, 2017, 84(1):32-40.
[14] Guo D, Wang A, Xie T, et al. Effects of ex vivo ischemia time and delayed processing on quality of specimens in tissue biobank. Mol Med Rep, 2020, 22(5):4278-4288.
[15] Cho SY, Kang W, Han JY, et al. An integrative approach to precision cancer medicine using patient-derived xenografts. Mol Cells, 2016, 39(2):77-86.
[16] Rosfjord E, Lucas J, Li G, et al. Advances in patient-derived tumor xenografts: from target identification to predicting clinical response rates in oncology. Biochem Pharmacol, 2014, 91(2):135-143.
[17] Gao D, Chen Y. Organoid development in cancer genome discovery. Curr Opin Genet Dev, 2015, 30:42-48.
[18] Matano M, Date S, Shimokawa M, et al. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nat Med, 2015, 21(3):256-262.
10.3969/j.issn.1673-713X.2022.04.012
江苏省重大疾病生物资源样本库开放课题(SBK202006003、SBK202006001、SBK202006002)
胡月,Email:h.y200607@163.com
2022-01-27
