微波复合暴露对小鼠外周血免疫指标的影响研究
2022-08-11姚传福董霁王惠王浩宇周红梅任可赵黎彭瑞云
姚传福,董霁,王惠,王浩宇,周红梅,任可,赵黎,彭瑞云
·论著·
微波复合暴露对小鼠外周血免疫指标的影响研究
姚传福,董霁,王惠,王浩宇,周红梅,任可,赵黎,彭瑞云
100850 北京,军事科学院军事医学研究院辐射医学研究所
探索微波复合暴露对小鼠免疫功能的影响,为微波复合暴露对免疫功能损伤机制和防治靶点研究提供依据。将 30 只 SPF 级雄性 C57BL/6N 小鼠随机分为假辐射组、低剂量复合组(比吸收率为3 W/kg)和高剂量复合组(比吸收率为 15 W/kg)。采用 X 和 S 波段微波复合照射,于辐射后 6 h 和 7 d,分别采集小鼠外周血,采用全自动血细胞计数仪检测外周血细胞计数,流式细胞仪分析小鼠外周血淋巴细胞亚群,酶联免疫吸附法检测血清免疫球蛋白 IgG、IgM 和 IgA 浓度,多功能液相芯片分析平台检测小鼠血清细胞因子 IL-2、IL-4 和 TNF-α 浓度。与假辐射组相比,辐射后 6 h,低剂量和高剂量复合组白细胞(WBC)和淋巴细胞(LYMPH)计数显著增加(< 0.05 或< 0.01);外周血 CD19+B 淋巴细胞与 CD3+T 淋巴细胞比值显著增加(< 0.05),CD4+T 淋巴细胞与 CD8+T 淋巴细胞比值均显著升高(< 0.01)。与假辐射组相比,辐射后 6 h,低剂量复合组血清 IgG、IgM 和 IgA 浓度均显著增加(< 0.01 或< 0.05),高剂量复合组血清 IgG 和 IgM 浓度明显增加(< 0.01 或< 0.05);辐射后 7 d,低剂量和高剂量复合组血清 IgA 浓度均显著降低(< 0.01)。辐射后 6 h,低剂量和高剂量复合组血清IL-2、IL-4 和 TNF-α 浓度显著下降(< 0.05 或< 0.01);辐射后 7 d,与假辐射组和低剂量复合组相比,高剂量复合组 IL-2 浓度显著下降(< 0.05 或< 0.01)。微波复合暴露可导致小鼠细胞免疫功能紊乱;体液免疫呈现先激活后抑制现象;辐射后 6 h 外周血LYMPH 计数、血清 IgG 浓度、IL-2、IL-4 和 TNF-α 浓度等指标改变与辐射剂量呈正相关。
微波; 复合暴露; 小鼠; 外周血; 免疫功能
随着信息化进程的加快,各类电器设备在为人们工作和生活提供高效便捷的同时,也形成各种微波辐射源,使得环境中微波辐射污染日益复杂,其所造成的健康危害备受关注。研究表明,微波具有广泛的生物学效应,对神经、生殖、心血管、免疫、造血、内分泌和皮肤等系统均可产生不同程度的影响[1-8]。免疫系统作为微波辐射重要的效应部位,是机体抵御外来侵袭和损伤最为重要的防御体系[9-10],因此,检测机体免疫功能成为微波辐射健康评估和防护的基本手段。
然而,目前有关微波辐射对外周血免疫相关指标的研究大多采用单一波段微波暴露,微波复合暴露的研究相对缺乏。但随着人们所处环境中微波辐射源的种类和辐射量越来越复杂,复合暴露的研究更能反映现实微波辐射环境对人们健康的影响。因此,为探讨复合暴露对小鼠免疫功能的影响及与辐射剂量之间的关系,本研究采用不同波段的微波复合暴露小鼠,通过检测外周血多种免疫功能相关指标,明确微波复合暴露的免疫功能效应,为微波复合辐射致免疫损伤的机制和防治研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 取 8 周龄 SPF 级 C57BL/6N 雄性小鼠 30 只,体重(22 ± 2)g,许可证号:SCXK(京)2016-0006,购自维通利华;在 20 ~ 24 ℃、湿度 50% ~ 70% 的条件下饲养。根据比吸收率(specific absorption rate,SAR)将小鼠随机分成假辐射组、低剂量复合组(SAR = 3 W/kg)和高剂量复合组(SAR = 15 W/kg),每组 10 只。
1.1.2 试剂与仪器 血细胞分析稀释液和全自动血细胞分析仪均为日本光电产品;异硫氰酸荧光素(FITC)标记CD3ε、多甲藻素-叶绿素蛋白复合物-花青素 5.5(PerCP/Cyanine5.5)标记CD8a、藻红蛋白(PE)标记CD4、别藻蓝素(APC)标记CD19 和 FITC-CD4 均购自美国 Biolegend 公司;小鼠 IgG、IgM 和 IgA ELISA 检测试剂盒购自杭州联科生物技术有限公司;小鼠多因子检测试剂盒购自美国 Thermo Fisher 公司;流式细胞仪购自美国 BD 公司;多功能液相芯片分析平台购自美国 Luminex 公司。
1.2 方法
1.2.1 微波辐射方法 小鼠于多孔透明的有机玻璃盒中固定体位,置辐射台上匀速旋转进行全身辐射,依次进行 X 和 S 波段微波辐射,每个波段暴露时间为 6 min。低剂量复合组各波段均为3 W/kg、高剂量复合组各波段均为15 W/kg。假辐射组置于辐射台不予辐射,其余处理同微波复合暴露组。
1.2.2 小鼠外周血白细胞和淋巴细胞计数 采用摘眼球方法取血,取 20 μl 乙二胺四乙酸二钾抗凝的小鼠外周血,加入血细胞分析稀释液中,按全自动血细胞分析仪操作说明,检测外周血白细胞(white blood cell,WBC)和淋巴细胞(lymphocyte,LYMPH)数量。
1.2.3 小鼠外周血淋巴细胞亚群比例 取外周血 100 μl,加入相应抗体:FITC-CD3ε、PerCP/Cyanine5.5- CD8a、PE-CD4、APC-CD19 和 FITC-CD4 各 1 μl。37 ℃孵育 30 min 后加入红细胞裂解液 2 ml,室温 15 min 后离心,PBS 洗涤 2 次,2% 多聚甲醛固定,采用流式细胞仪,检测 B 细胞与 T 细胞比值和 CD4+T 细胞与 CD8+T 细胞比值。
1.2.4 小鼠血清免疫球蛋白 IgG、IgM 和 IgA 浓度 采用小鼠 IgG、IgM 和 IgA ELISA 检测试剂盒,按照操作说明进行。具体为:在 96 孔板中加入标准品和各组小鼠血清各 100 μl,37 ℃孵育90 min;加入 100 μl 生物素化抗体/抗原工作液,37 ℃孵育 60 min,洗涤 3 次;加入 100 μl 酶结合物工作液,37 ℃孵育 30 min,洗涤 5 次;加入 90 μl 底物溶液,37 ℃孵育 15 min;再加入 50 μl 终止液;立即在 450 nm 波长处测量值,计算 IgG、IgM 和 IgA 浓度。
1.2.5 小鼠血清细胞因子 IL-2、IL-4 和 TNF-α 浓度 采用小鼠多因子检测试剂盒,按照操作说明进行。具体为:在 96 孔板中加入各组血清 50 μl,依次进行微球与血清孵育、洗板、加入检测抗体、洗板、加入 SA-PE、洗板,采用多功能液相芯片分析平台检测。采用 5 参数非线性回归的方式拟合标准曲线,计算 IL-2、IL-4 和 TNF-α 浓度值。
1.3 统计学处理
2 结果
2.1 小鼠外周血 WBC 和 LYMPH 计数的变化
微波复合暴露后小鼠外周血 WBC 计数结果显示,与假辐射组相比,低剂量和高剂量复合组 WBC 计数于辐射后 6 h 均明显增加(< 0.05,图 1A)。微波复合暴露后小鼠外周血 LYMPH 计数结果显示,与假辐射组相比,低剂量和高剂量复合组 LYMPH 计数于辐射后 6 h 均显著增加(< 0.01,图 1B)。上述结果表明,复合微波暴露可在辐射后6 h显著提升外周血 WBC 和 LYMPH 的数量。
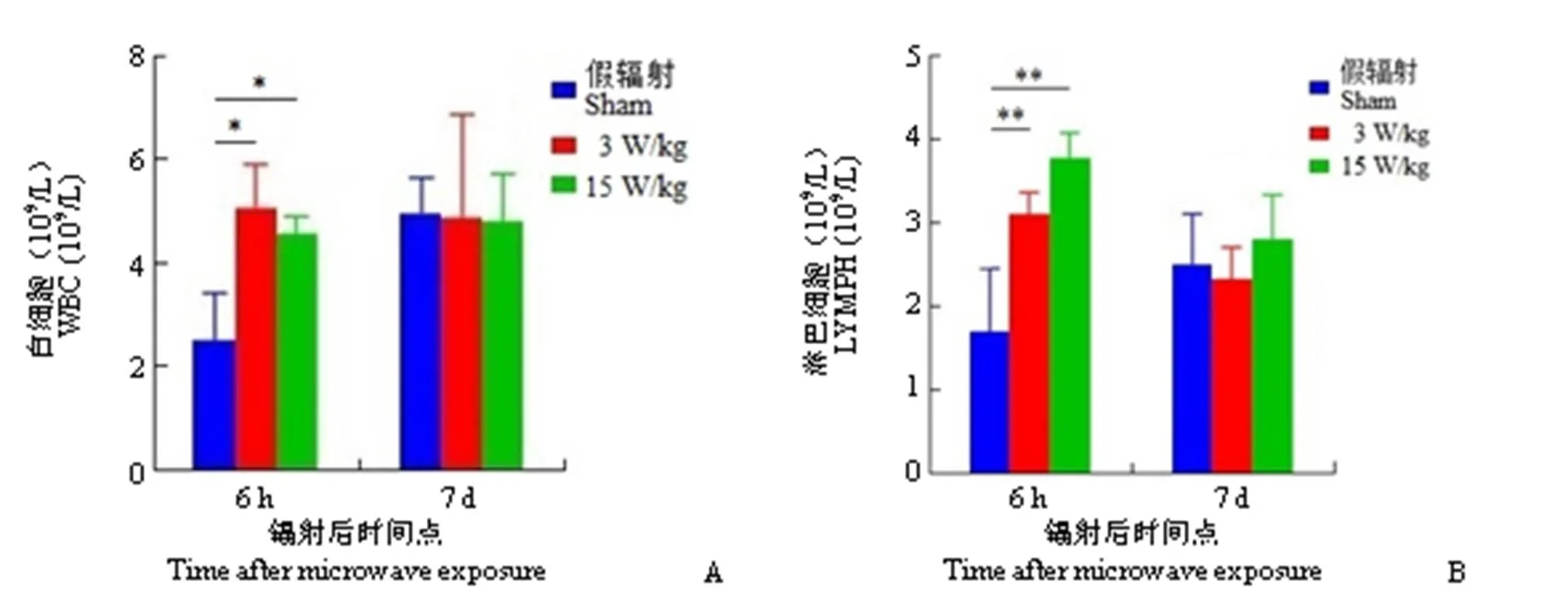
图1 微波复合暴露后小鼠外周血 WBC(A)和 LYMPH(B)计数的变化(与假辐射组相比,*P < 0.05,**P < 0.01)
Figure 1 WBC(A) and LYMPH(B) counts of peripheral blood in mice after combined microwave exposure (*< 0.05,**< 0.01, compared with sham group)
2.2 小鼠外周血淋巴细胞亚群比例的变化
微波复合暴露后,小鼠外周血 CD19+B 淋巴细胞和 CD3+T 淋巴细胞亚群分析结果显示,与假辐射组相比,低剂量和高剂量复合组外周血 CD19+B 淋巴细胞与 CD3+T 淋巴细胞比值于辐射后 6 h 明显增加(< 0.05,图 2A)。由于外周血淋巴细胞数量于辐射后 6 h 显著上调,提示复合暴露可刺激 B 淋巴细胞增殖。
微波复合暴露后小鼠外周血 T 淋巴细胞亚群检测结果显示,与假辐射组相比,辐射后 6 h,低剂量和高剂量复合组外周血 CD4+T 淋巴细胞与 CD8+T 淋巴细胞比值均显著升高(< 0.01,图 2B),提示微波辐射可引起细胞免疫功能紊乱。
2.3 小鼠血清免疫球蛋白 IgG、IgM 和 IgA 浓度的变化
微波复合暴露后小鼠血清 IgG 浓度结果显示,与假辐射组相比,低剂量和高剂量复合组血清 IgG 浓度于辐射后 6 h 显著增加(< 0.01,图 3A)。微波复合暴露后小鼠血清 IgM 浓度结果显示,与假辐射组相比,低剂量和高剂量复合组血清 IgM 浓度于辐射后 6 h 明显增加(< 0.05,图 3B)。微波复合暴露后小鼠血清 IgA 浓度结果显示,与假辐射组相比,低剂量复合组血清 IgA 浓度于辐射后 6 h 明显增加(< 0.05);低剂量和高剂量复合组 IgA 浓度于辐射后 7 d 显著降低(< 0.01,图 3C)。提示微波辐射可先应激性激活 B 淋巴细胞功能,于辐射早期上调血清免疫球蛋白浓度,而后呈抑制性改变。
2.4 小鼠血清细胞因子 IL-2、IL-4 和 TNF-α浓度的变化
微波复合暴露后小鼠血清 IL-2 浓度结果显示,与假辐射组相比,低剂量和高剂量复合组于辐射后 6 h 显著下降(< 0.05 或< 0.01),高剂量复合组于辐射后 7 d 明显下降(< 0.05);与低剂量复合组相比,高剂量复合组于辐射后 7 d 显著下降(< 0.01,图 4A)。微波复合暴露后小鼠血清 IL-4 浓度结果显示,与假辐射组相比,低剂量和高剂量复合组于辐射后 6 h 血清 IL-4 浓度明显下降(< 0.05,图 4B)。微波复合暴露后小鼠血清 TNF-α 浓度结果显示,与假辐射组相比,低剂量和高剂量复合组于辐射后 6 h 血清 TNF-α 浓度显著下降(< 0.01,图 4C)。上述结果提示,微波辐射可抑制免疫细胞的细胞因子分泌能力,但在辐射后 7 d 逐步恢复。
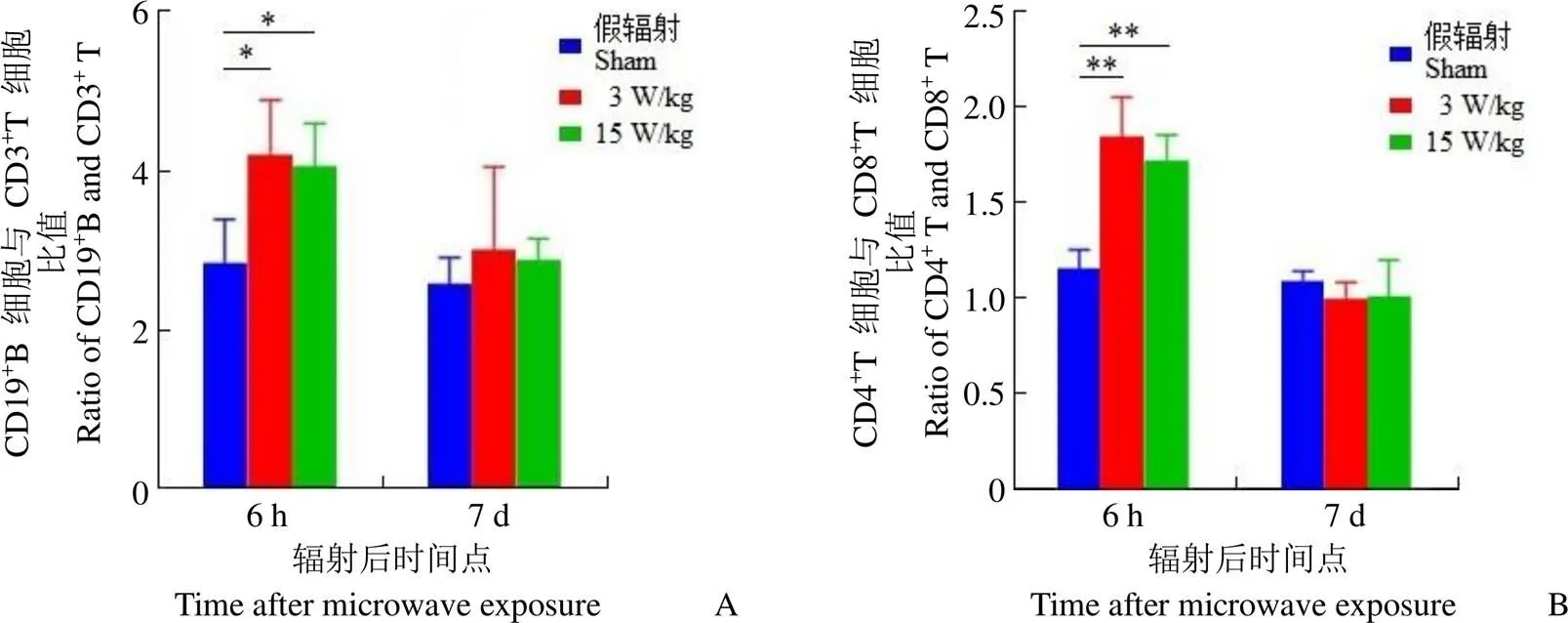
图2 微波复合暴露后小鼠外周血淋巴细胞亚群比例的变化(A:CD19+B 细胞与 CD3+T 细胞比值;B:CD4+T 细胞与 CD8+T 细胞比值。与假辐射组相比,*P < 0.05,**P < 0.01)
Figure 2 The ratio of peripheral blood lymphocyte subsets in mice after combined microwave exposure (A: The ratio of CD19+B and CD3+T; B: The ratio of CD4+T and CD8+T,*< 0.05,**< 0.01, compared with sham group)
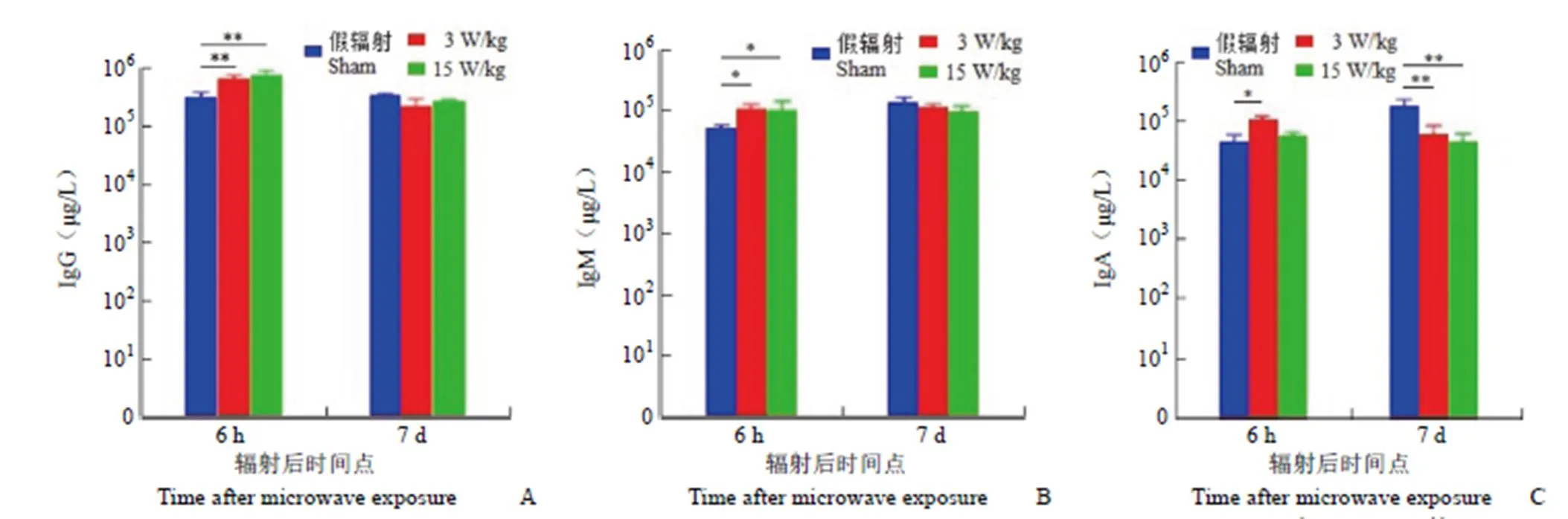
图3 微波复合暴露后小鼠血清免疫球蛋白 IgG(A)、IgM(B)及 IgA(C)浓度(与假辐射组相比,*P < 0.05,**P < 0.01)
Figure 3 Concentration of serum immunoglobulin of IgG (A), IgM (B) and IgA (C) in mice after microwave compound exposure (*< 0.05,**< 0.01, compared with sham group)

图4 微波复合暴露后小鼠血清细胞因子浓度的变化(A:IL-2;B:IL-4;C:TNF-α;与假辐射组相比,*P < 0.05,**P < 0.01;与 3 W/kg 组相比,#P < 0.01)
Figure 4 Concentration of serum cytokines in mice after combined microwave exposure (A: IL-2; B: IL-4; C: TNF-α;*< 0.05,**< 0.01, compared with sham group;#< 0.01, compared with the 3 W/kg group)
3 讨论
外周血免疫细胞是免疫系统的重要效应细胞,是抵御病毒侵入和清除损伤细胞的屏障。然而,目前微波辐射对外周血免疫指标的影响研究多集中于单一波段微波辐射,微波复合暴露相关研究缺乏[11-15]。因此,本研究探讨微波复合暴露对小鼠外周血免疫功能相关指标的影响及其与辐射剂量之间的关系,为微波复合辐射对机体免疫功能的影响研究奠定基础。
免疫细胞数量和各细胞亚型的比例变化可反映机体免疫功能状态,白细胞是外周血中抵御病毒入侵的第一道防线,其中,淋巴细胞是免疫功能的主要执行者。微波辐射对免疫指标的影响与辐射频率、功率密度、辐射时间和辐射方式等均有关,不同的研究结果不尽一致。尹金玲等[16]采用平均功率密度为 5 ~ 60 mW/cm2的微波辐射 Wistar 大鼠,发现与对照组相比,辐射后大鼠外周血 T 淋巴细胞比例下降,B 淋巴细胞比例升高,CD4+/CD8+比值降低。张怡堃等[17]采用 10 mW/cm2的微波长期辐射小鼠,结果显示辐射后小鼠外周血白细胞显著上升,CD4+/CD8+比值呈上升趋势。张文辉等[18]采用平均功率密度为 1 ~ 15 mW/cm2微波辐射小鼠,发现辐射后小鼠 T 淋巴细胞数量下降,细胞免疫功能降低。朱美财等[19]利用 10 mW/cm2微波辐射 SD 大鼠,每天 15 min,每周 5 天,在辐射 2 周和 3 周后取大鼠腹腔静脉血进行检测,结果发现辐射 3 周后,10 mW/cm2组大鼠 WBC 和 LYMPH 计数均明显降低。本研究发现,低剂量和高剂量微波复合暴露后早期均可引起外周血白细胞和淋巴细胞的数量增加,提示复合暴露可能应激性刺激白细胞和淋巴细胞增殖。为了明确微波复合暴露所刺激的淋巴细胞类型,通过亚型分析发现,微波复合暴露后小鼠外周血淋巴细胞数显著上调;同时,CD19+B 淋巴细胞与 CD3+T 淋巴细胞比值增加,提示微波复合暴露可激活 B 淋巴细胞的增殖。进一步研究显示,微波复合暴露后外周血 CD4+T 淋巴细胞与 CD8+T 淋巴细胞比值升高,表明 T 淋巴细胞免疫功能紊乱。该实验结果与张怡堃等[17]的研究一致。以上结果提示,微波复合暴露后 B 淋巴细胞活化,T 淋巴细胞免疫功能紊乱。
由于 B 淋巴细胞和 T 淋巴细胞是外周血淋巴细胞的两大主要细胞类型,两者在免疫调节中均发挥关键的作用。因此,我们检测了 B 淋巴细胞和 T 淋巴细胞的主要免疫功能指标。免疫球蛋白 IgG、IgM 和 IgA 由 B 淋巴细胞激活转化为浆细胞后分泌产生,在机体防御中发挥抗感染、中和毒素及调理等重要作用,其含量在一定程度上可以反映机体体液免疫功能。IgG 是血清和胞外液中含量最高的免疫球蛋白,是免疫应答产生的主要抗体,其亲和力高,在体内分布广泛,是机体抗感染的“主力军”。IgM 是个体发育中最早合成和分泌的抗体,也是初次体液免疫应答中最早出现的抗体,是机体抗感染的“先头部队”。IgA 可以结合抗原,在循环免疫复合物的抗体中占有相当比例,它可以无炎症形式清除大量抗原,维持机体内环境的稳定。既往研究发现,不论是在电磁辐射工作环境中作业人员的流行病学研究,还是微波辐射动物的实验研究,单一频率微波辐射可致机体 IgG、IgA 和 IgM 抗体分泌呈波动性改变,主要表现为短时间低剂量微波暴露的免疫刺激作用和长时间大剂量微波暴露的免疫抑制作用[12, 18, 20-22]。本研究发现,在辐射 6 h 后,微波复合辐射后小鼠血清 IgG、IgM 和 IgA 浓度均增加,但辐射 7 d 后IgA 浓度下降,以高剂量微波复合变化更为显著,这与文献[23-25]的报道一致,表明微波复合暴露可先激活后抑制 B 淋巴细胞的抗体分泌功能。电磁辐射暴露引起免疫细胞抗体库产生水平和多样性改变的具体机制尚不明确,可能与 B 细胞发育过程中免疫球蛋白轻链位点上 V(D)J 重组有关[26]。
T 细胞可分为 CD4+辅助性 T 淋巴细胞和 CD8+细胞毒性 T 淋巴细胞两个亚群,它们主要通过分泌不同的细胞因子参与免疫调节。有研究采用平均功率密度为 5 mW/cm2的微波长期辐射昆明小鼠,发现微波辐射后小鼠血清中 IFN-γ 含量显著增加,IL-4 仅有降低趋势[27]。徐俊杰等[28]在研究微波辐射对小鼠免疫功能的影响中,每天以 100 mW/cm2微波照射 15 min,连续 10 d,证实连续多次微波辐射会导致刀豆蛋白或脂多糖诱导的小鼠脾淋巴细胞的增殖能力下降,IL-1、IL-2、IL-3 等细胞因子活性水平明显降低。王源等[27]采用 5 mW/cm2的微波连续辐射昆明小鼠 30 d,30 min/d,发现辐射后小鼠 IFN-γ 基因及蛋白表达水平增高,IL-4 的表达有降低的趋势。Gatta 等[29]观察了频率为 900 MHz 全球移动通信系统调制辐射对暴露于 SAR 为 1 W/kg 或 2 W/kg 的小鼠脾脏淋巴细胞的影响,2 h/d,连续辐射 1、2 或 4 周,结果显示,暴露组 IL-2 水平无显著改变,IFN-γ 表达明显增多。本研究检测了 IL-2、IL-4 和 TNF-α 浓度,结果显示,微波复合暴露后小鼠血清 IL-2、IL-4 和 TNF-α 浓度均下降,以高剂量微波复合变化更为显著,表明微波复合暴露可导致小鼠 T 淋巴细胞功能受损。
微波辐射对免疫细胞影响的机制尚不明确,可能与免疫细胞活性氧损伤、核转录因子信号转导途径和细胞内第二信使 Ca2+浓度有关。ROS 是一种在多种细胞中持续产生的不稳定反应分子,很容易与生物大分子发生反应,参与细胞内信号转导途径,调控抗炎、细胞生长、分化、增殖和应激的基因表达。研究发现,微波辐射后淋巴细胞 ROS 水平显著高于对照组[30-31]。NF-κB 是一类关键性的核转录因子,它与免疫细胞的活化、T 和 B 淋巴细胞的发育、应激性反应、细胞凋亡等多种细胞活动有关。研究表明,微波辐射可激活 NF-κB 信号通路,从而激活细胞免疫功能[32-33]。Ca2+作为细胞内第二信使,主要参与细胞内外信息的传递、酶的代谢与调节等重要病理生理过程,在细胞周期和凋亡调节中也起着重要作用[34]。研究表明,微波辐射可影响淋巴细胞膜 Ca2+-Mg2+-ATP 酶活性,导致细胞内第二信使 Ca2+浓度变化,从而影响细胞膜通透性和细胞功能[35-36]。
综上,本研究发现微波复合暴露可通过上调 B 淋巴细胞数量从而增加外周血淋巴细胞及白细胞数量,同时,微波复合暴露造成 B 淋巴细胞的抗体分泌功能先激活后抑制,而 T淋巴细胞比例下调可能导致细胞因子含量下降,最终造成机体免疫功能紊乱,且与复合暴露剂量呈正相关。由于微波复合暴露对免疫功能的影响机制十分复杂,与辐射频率、辐射功率、辐射时间和复合方式等密切相关。因此,微波复合暴露对免疫系统的影响仍待进一步深入探讨。
[1] He CQ, Wang Y, Long DX. Adverse effects and mechanisms of electromagnetic radiation on the central nervous system. Chin J Radiol Health, 2017, 26(3):381-384. (in Chinese)
何楚琦, 王月, 龙鼎新. 电磁辐射对中枢神经系统的影响及机制. 中国辐射卫生, 2017, 26(3):381-384.
[2] Wan P, Gao JT, Wang CY, et al. Effects of microwave radiation on reproductive system in male mice. Chin J Androl, 2015, 29(7):24-27. (in Chinese)
万朋, 高俊涛, 王春艳, 等. 微波辐射对雄性小鼠生殖系统的影响. 中国男科学杂志, 2015, 29(7):24-27.
[3] Zhang W, Tong J. Effects of radon and electromagnetic radiation on hematopoietic system. Chin Occup Med, 2007, 34(2):144-146. (in Chinese)
张卫, 童建. 氡与电磁辐射对造血系统的影响. 中国职业医学, 2007, 34(2):144-146.
[4] Arthamin, MZ, Sulalah A, Resvina R, et al. Exposure of 1800 MHz radiofrequency with SAR 1,6 W/kg caused a significant reduction in CD4+ T cells and release of cytokines in-vitro. Iran J Immunol, 2020, 17(2):154-166.
[5] Pan S, Wu AS, Lin S. Influence of low intensity microwave radiation on worker's cardiovascular and vegetative nervous function. Chin Occup Med, 2006, 33(5):361-363. (in Chinese)
潘绥, 吴安生, 林燧. 低强度微波辐射对作业工人的心血管和植物神经功能的影响. 中国职业医学, 2006, 33(5):361-363.
[6] Falcioni L, Bua L, Tibaldi E, et al. Report of final results regarding brain and heart tumors in Sprague-Dawley rats exposed from prenatal life until natural death to mobile phone radiofrequency field representative of a 1.8 GHz GSM base station environmental emission. Environ Res, 2018, 165:496-503.
[7] Sangün Ö, Dündar B, Çömlekçi S, et al. The effects of electromagnetic field on the endocrine system in children and adolescents. Pediatr Endocrinol Rev, 2015, 13(2):531-545.
[8] Matic M, Lazetic B, Poljacki M, et al. Influence of different types of electromagnetic fields on skin reparatory processes in experimental animals. Lasers Med Sci, 2009, 24(3):321-327.
[9] Szmigielski S. Reaction of the immune system to low-level RF/MW exposures. Sci Total Environ, 2013, 454-455:393-400.
[10] Szymański Ł, Sobiczewska E, Cios A, et al. Immunotropic effects in cultured human blood mononuclear cells exposed to a 900 MHz pulse-modulated microwave field. J Radiat Res, 2020, 61(1):27-33.
[11] Nageswari KS, Sarma KR, Rajvanshi VS, et al. Effect of chronic microwave radiation on T cell-mediated immunity in the rabbit. Int
J Biometeorol, 1991, 35(2):92-97.
[12] Chen ZM. The injury effects of S-band high power microwave radiation on rats. Beijing: Academy of Military Medical Sciences, 2007. (in Chinese)
陈忠民. S-波段高功率微波照射对大鼠损伤效应研究. 北京: 中国人民解放军军事医学科学院, 2007.
[13] Meng XY, Gao CJ, Zhang YK, et al. Inhibitory effect of electromagnetic radiation on immune function of mice. Acad J PLA Postgrad Med Sch, 2009, 30(2):215-217. (in Chinese)
孟旭英, 高春记, 张怡堃, 等. 电磁辐射对小鼠免疫功能的抑制作用. 军医进修学院学报, 2009, 30(2):215-217.
[14] Wang W, Liu HX, Wang DW, et al. Effects of electromagnetic radiation on the peripheral leukocyte count and subtypes and levels of serum TNF-α, sIgA and sIgG. Chin J Stereology Image Analy, 2013, 18(1):79-84. (in Chinese)
王炜, 刘换新, 王德文, 等. 电磁辐射对SD大鼠外周血白细胞数量、血清免疫球蛋白及TNF-α水平的影响. 中国体视学与图像分析, 2013, 18(1):79-84.
[15] Zhang YK, Li H, Li SZ, et al. Effect of low-dose electromagnetic radiation on peripheral blood cells in mouse. High Power Laser Particle Beams, 2011, 23(11):2861-2864. (in Chinese)
张怡堃, 李慧, 李世芝, 等. 低剂量电磁辐射对小鼠外周血象的影响. 强激光与粒子束, 2011, 23(11):2861-2864.
[16] Yin JL, Man QH, Cui YF, et al. Effects of microwave radiation on lymphocyte subpopulations in rat peripheral blood. Radiat Protection Bull, 2011, 31(4):19-22. (in Chinese)
尹金玲, 满其航, 崔玉芳, 等. 微波辐照诱发Wistar大鼠外周血淋巴细胞亚群变化. 辐射防护通讯, 2011, 31(4):19-22.
[17] Zhang YK, Li H, Huang GS, et al. Long-term effects of lasting and high-dose electromagnetic radiation on peripheral blood immune cells in mice. J Jilin Univ (Medi Ed), 2012, 38(5):856-860. (in Chinese)
张怡堃, 李慧, 黄根山, 等. 持续高剂量电磁辐射对小鼠外周血免疫细胞数量影响的长期效应. 吉林大学学报(医学版), 2012, 38(5): 856-860.
[18] Zhang WH, Sun X, Han CC, et al. Effects of microwave radiation on immunological function in mice at different power densities. Guangxi J Prev Med, 2005, 11(3):129-132. (in Chinese)
张文辉, 孙侠, 韩长城, 等. 不同强度微波辐射对小鼠免疫功能的影响. 广西预防医学, 2005, 11(3):129-132.
[19] Zhu MC, Yan XT, Cheng SQ, et al. Impact of microwave radiation on blood cells and immune system of rats. Med J Natl Defending Forces Southwest China, 2019, 29(6):644-647. (in Chinese)
朱美财, 晏雪婷, 程苏琴, 等. 微波辐射对大鼠血液细胞和免疫系统的影响. 西南国防医药, 2019, 29(6):644-647.
[20] Ma F, Xiong HY, Zhang Y, et al. Study on damage effect of blood components of occupational population exposed to high-frequency electromagnetic fields. Chin J Dis Control Prev, 2005, 9(5):437-440. (in Chinese)
马菲, 熊鸿燕, 张耀, 等. 高强度电磁辐射对长期暴露人群血液成分的损伤效应研究. 疾病控制杂志, 2005, 9(5):437-440.
[21] Yuan ZQ, Wang DG, Li F, et al. Investigation on the effects of very high frequency electromagnetic radiation on immunoglobulin in human. Acta Acad Med Milit Tertiae, 2001, 23(2):168. (in Chinese)
袁正泉, 王登高, 李锋, 等. 超短波电磁辐射环境对人体免疫球蛋白影响的调查. 第三军医大学学报, 2001, 23(2):168.
[22] Yan XT. Study on the influence of microwave radiation on the immune function in flight environment. Dalian: Dalian Medical University, 2016. (in Chinese)
晏雪婷. 飞行环境中微波辐射对机体免疫功能影响的研究. 大连: 大连医科大学, 2016.
[23] Chen Y, Li YC, Qiu R, et al. Effects of low-intensity microwave radiation on the immune system in mice. Strait J Prev Med, 2010, 16(5):48-50. (in Chinese)
陈昱, 李昱辰, 邱睿, 等. 低强度微波辐射对小鼠免疫系统的影响. 海峡预防医学杂志, 2010, 16(5):48-50.
[24] Zhu SZ. Experimental research of effects of extremely low frequency electromagnetic fields on immune function of BALB / c mice. Chin J Radiol Health, 2010, 19(2):145-147. (in Chinese)
朱世忠. 极低频电磁场对BALB/c小鼠免疫功能影响的实验研究. 中国辐射卫生, 2010, 19(2):145-147.
[25] Glushkova OV, Novoselova EG, Ogaĭ VB, et al. Effect of centimeter microwaves on the antibody production in mice. Biofizika, 2001, 46(1):126-130.
[26] Ioniţă E, Marcu A, Temelie M, et al. Radiofrequency EMF irradiation effects on pre-B lymphocytes undergoing somatic recombination. Sci Rep, 2021, 11(1):12651.
[27] Wang Y, Zhang GB, Chu F, et al. Effects of accumulative electromagnetic irradiation on Th1/Th2 cytokine balance. Chin
J Public Health, 2011, 27(7):887-888. (in Chinese)
王源, 张广斌, 储芳, 等. 电磁辐射累积暴露对Th1/Th2细胞因子平衡影响. 中国公共卫生, 2011, 27(7):887-888.
[28] Xu JJ, Zhu WH, Pan WG, et al. Effects of synergistic effects of hypobaric and non-hypoxic conditions and microwave radiation on the immune function of mice. Chin J Gerontol, 2016, 36(9):2061-2062. (in Chinese)
徐俊杰, 朱文赫, 潘文干, 等. 低压不缺氧条件与微波辐射协同作用对小鼠免疫功能的影响. 中国老年学杂志, 2016, 36(9):2061-2062.
[29] Gatta L, Pinto R, Ubaldi V, et al. Effects of in vivo exposure to GSM-modulated 900 MHz radiation on mouse peripheral lymphocytes. Radiat Res, 2003, 160(5):600-605.
[30] Guo Y, Cui YF. The role of reactive oxygen species in apoptosis signal transduction. Infect Inflamm Repair, 2005, 6(1):61-63. (in Chinese)
郭瑛, 崔玉芳. 活性氧在细胞凋亡信号转导中的作用. 感染炎症修复, 2005, 6(1):61-63.
[31] Man QH, Cui YF, Du L, et al. Effects of microwave radiation on the levels of reactive oxygen species in rat spleen and human AHH-1 T lymphocytes and apoptosis of the latter. Med J Chin PLA, 2010, 35(5): 533-536. (in Chinese)
满其航, 崔玉芳, 杜丽, 等. 微波辐照对大鼠脾脏和人AHH-1 T细胞活性氧水平和凋亡的影响. 解放军医学杂志, 2010, 35(5):533-536.
[32] Natarajan M, Vijayalaxmi, Szilagyi M, et al. NF-kappaB DNA-binding activity after high peak power pulsed microwave (8.2 GHz) exposure of normal human monocytes. Bioelectromagnetics, 2002, 23(4):271-277.
[33] Wang Y, Yang J, Zhang GB, et al. Electromagnetic radiation enhances IL-12 expression in vivo and in vitro. Acta Acad Med Milit Tertiae, 2012, 34(24):2459-2464. (in Chinese)
王源, 杨举, 张广斌, 等. 电磁辐射急性暴露对小鼠IL-12表达的影响及其机制. 第三军医大学学报, 2012, 34(24):2459-2464.
[34] Hesketh TR, Smith GA, Moore JP, et al. Free cytoplasmic calcium concentration and the mitogenic stimulation of lymphocytes. J Biol Chem, 1983, 258(8):4876-4882.
[35] Wang Y, Ning ZZ, Wang DG. Effects of microwave irradiation on Ca2+, intracellular cyclic adenosine monophosphate and DNA synthesis in isolated mouse lymphocytes. Chin J Ind Hyg Occup Dis, 1998, 16(2):54-55. (in Chinese)
王勇, 宁竹之, 王登高. 微波辐照对小鼠离体淋巴细胞Ca2+、细胞内环磷酸腺苷及DNA合成的影响. 中华劳动卫生职业病杂志, 1998, 16(2):54-55.
[36] Yang MJ. Influence of microwave on immune function of body. Foreign Med Sci, 2000, 27(5):261-265. (in Chinese)
杨明杰. 微波对机体免疫机能的影响. 国外医学(卫生学分册), 2000, 27(5):261-265.
Effects of combined microwave exposure on the parameters of immune functions of peripheral blood in mice
YAO Chuan-fu, DONG Ji, WANG Hui, WANG Hao-yu, ZHOU Hong-mei, REN Ke, ZHAO Li, PENG Rui-yun
Author Affiliation: Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
To explore the effects of combined microwave exposure on immune functions of mice, and to provide basis for further investigating the mechanisms underlying combined microwave exposure induced injuries and screening therapeutic targets.Thirty male C57BL/6N mice were randomly divided into sham group, low dose compound group (specific absorption rate, SAR = 3 W/kg) and high dose compound group (SAR = 15 W/kg). The peripheral blood was collected at 6 h and 7 d after combined exposure microwave with X-band and S-band. The peripheral hemogram was analyzed by an automatic blood cell counter and the subtypes of lymphocytes (LYMPH) were detected by flow cytometry. The concentration of IgG, IgM and IgA in serum were tested by enzyme linked immunosorbent assay (ELISA). The level of cytokines in serum, including IL-2, IL-4 and TNF-α was measured by multifunctional liquid phase chip analysis platform.Compared to sham group, the count of white blood cells (WBC) and LYMPH were increased at 6 h after exposure (< 0.05 or< 0.01), the ratio of CD19+B cells and CD3+T cells obviously increased at 6 h after exposure both in high and low dose groups exposed to combined microwave (< 0.05). And the ratio of CD4+T cell to CD8+T cell increased significantly (< 0.01). The concentrations of IgG, IgM and IgA in serum of low dose group were up-regulated (< 0.05 or< 0.01) compared to sham group at 6 h after exposure, and the concentrations of IgG, IgM of high dose group were up-regulated as well. The IgA level in serum of low and high dose group were reduced (< 0.01) at 7 d after exposure. The cytokines, interleukin-2 (IL-2), IL-4 and tumour necrosis factor-α (TNF-α) in serum of low and high dose groups were down-regulated (< 0.05 or< 0.01) at 6 h after exposure compared to sham group. Moreover, compared to sham and low dose group, the concentration of IL-2 in high dose group was decreased significantly (< 0.05 or< 0.01) at 7 d after exposure.Combined microwave exposure could lead to the imbalance of immune cells, and the humoral immunity is initially activated and then quickly suppressed. Our data suggested that the combined microwave inducing injuries on immune cells are positively correlated with exposure dosage on the parameters of LYMPH, IgG, IL-2, IL-4 and TNF-α at 6 h after exposure.
microwave; compound exposure; mouse; peripheral blood; immune function
s: PENG Rui-yun, Email: ruiyunpeng18@126.com; ZHAO Li, Email: lillyliz@163.com
10.3969/j.issn.1673-713X.2022.04.005
彭瑞云,Email:ruiyunpeng18@126.com;赵黎,Email:lillyliz@163.com
2022-01-25
