规范产时抗生素预防对合并无乳链球菌定植孕妇母婴结局的影响
2022-08-11揭晓婷翁晓英
林 容,揭晓婷,翁晓英
无乳链球菌又称为B族链球菌(group B streptococcus,GBS),是人体肠道和阴道微生物区系中的共生菌。若妊娠期间在阴道、直肠或肛周取分泌物进行培养发现GBS阳性且不伴有相关症状,即为孕妇阴道GBS定植[1]。GBS作为条件致病菌在非孕期女性的生殖道或肠道中定植时可不治疗。但在孕晚期,生殖道-肠道定植的GBS在某些条件下会转变为致病菌,从而引起一系列疾病,包括母体感染、早产、胎膜早破、新生儿早发性感染等。为降低孕期GBS定植引起的相关疾病,临产后预防性使用抗生素具有重要意义,而产时预防性抗生素使用的规范性更是决定治疗效果的关键点[2]。本研究回顾性分析了2021年1月至2021年12月于本院定期产检的经阴道试产的176例GBS定植产妇的临床资料,根据抗生素使用情况分为产时抗生素预防(intrapartum antibiotic prophylaxis,IAP)规范组与IAP不规范组,以探讨规范的IAP对妊娠晚期GBS定植孕妇母婴结局的影响。现报道如下。
1 资料与方法
1.1一般资料 选择2021年1月至2021年12月于我院产检及分娩的2 981例孕妇的临床资料,获得GBS阳性者244例,排除行剖宫产者68例,最终共纳入176例。均在临产或胎膜破裂后接受抗生素预防性治疗,根据抗生素使用的及时性、时长等情况将其分为IAP规范组(n=124)和IAP不规范组(n=52)。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医院伦理委员会批准(K2021-01-034)。

表1 两组基线资料比较
1.2纳入与排除标准 纳入标准:(1)临床资料完整;(2)单胎妊娠;(3)采集阴道-直肠分泌物行GBS培养,且结果为阳性者;(4)在临产或胎膜破裂后接受抗生素预防性治疗;(5)经阴道试产。排除标准:(1)采集阴道-直肠分泌物行GBS培养前2周内有使用抗生素者;(2)合并急性生殖道感染者;(3)孕妇合并严重内外科疾病,存在其他影响分娩的疾病者;(4)新生儿合并畸形或先天性疾病者;(5)择期剖宫产者。
1.3GBS培养方法 于孕35~37周行阴道-直肠分泌物GBS培养。若孕35周前临产,入院时即取阴道-直肠分泌物行GBS培养。采样时不使用阴道窥器,用拭子在阴道下1/3处取样,然后用同一拭子通过肛门括约肌在直肠内取样。采样后置于COPAN运送培养基中立即送检培养。将标本接种于哥伦比亚血琼脂平板(购自郑州市贝瑞特生物技术有限公司)和GBS显色培养基(购自郑州安图生物工程股份有限公司),日本松下恒温二氧化碳培养箱培养24 h(温度37 ℃,二氧化碳浓度5%)。对血平板上β溶血的可疑菌落进行革兰染色和触酶试验。革兰染色阳性和触酶试验阴性者进行协同溶血试验(CAMP试验),指示菌株为金黄色葡萄球菌ATCC25923(购自国家卫生健康委临床检验中心)。同时,直接选取GBS显色平板上的浅粉至红色的典型菌落,使用全自动微生物分析仪及药敏分析系统(VITEK2-Compact,购自法国生物梅里埃公司),并经CAMP试验以进一步鉴定菌种。CAMP试验与上机鉴定均符合者确认为GBS。
1.4干预措施
1.4.1 临产诊断[3]出现规律宫缩,持续≥30 s,间隔5~6 min,伴宫颈管消退,宫口开大,胎先露下降。
1.4.2 抗生素使用方案 (1)在临产或胎膜破裂后开始使用抗生素,参照2020年美国妇产科医师学会(American College of Obstetrics and Gynecology,ACOG)发布的预防新生儿早发型GBS(GBS early-onset disease,GBS-EOD)共识[4],具体用药方案:治疗前行青霉素皮试,皮试阴性者首选青霉素钠[石药集团中诺药业(石家庄)有限公司]静滴,首剂500万U,维持剂量为250万U,4 h/次,直至分娩,青霉素皮试阳性者或无法行青霉素皮试者,予静脉滴注头孢唑林(成都倍特药业有限公司),首剂2.0 g,维持剂量1 g,8 h/次,直至分娩。对于头孢类及青霉素均过敏者,静脉滴注克林霉素(成都天台山制药有限公司),剂量900 mg,8 h/次,直至分娩。(2)入院时GBS培养结果未回报或未进行GBS检测者,若已临产,如存在高危因素,包括产时发热≥38.0 ℃、早产临产、未足月胎膜早破、胎膜破裂≥12 h等,则按GBS阳性进行治疗。若不存在高危因素,结合既往新生儿GBS史和前次妊娠GBS定植情况选择治疗方案:有上述情况则按GBS阳性治疗,无上述情况则按GBS阴性待产。产后发现GBS阳性,则根据IAP规范情况进行归组。
1.5分组方法 (1)IAP规范组:孕妇至少于分娩前4 h行上述抗生素治疗,持续用药至分娩。(2)IAP不规范组:包括未按上述用药共识使用足量抗生素、未在分娩前4 h内开始使用抗生素、未持续用药至临产、未使用抗生素等。
1.6资料收集 通过医院电子病历系统收集孕妇和新生儿的临床资料,包括孕妇的一般资料(年龄、孕周、孕次、产次)、母婴不良事件发生情况,以及新生儿体重、新生儿1分钟Apgar评分[3]等。母婴不良事件包括羊水污染、绒毛膜羊膜炎[3],以及新生儿入住新生儿重症监护室(neonatal intensive care unit,NICU)、新生儿窒息、新生儿感染、新生儿肺炎、新生儿败血症[5]等。新生儿在出生后24 h内采静脉血行血常规、C反应蛋白检测。
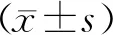
2 结果
2.1两组羊水浑浊、绒毛膜羊膜炎发生率比较 IAP规范组羊水浑浊、绒毛膜羊膜炎发生率与IAP不规范组比较差异无统计学意义(P>0.05)。见表2。
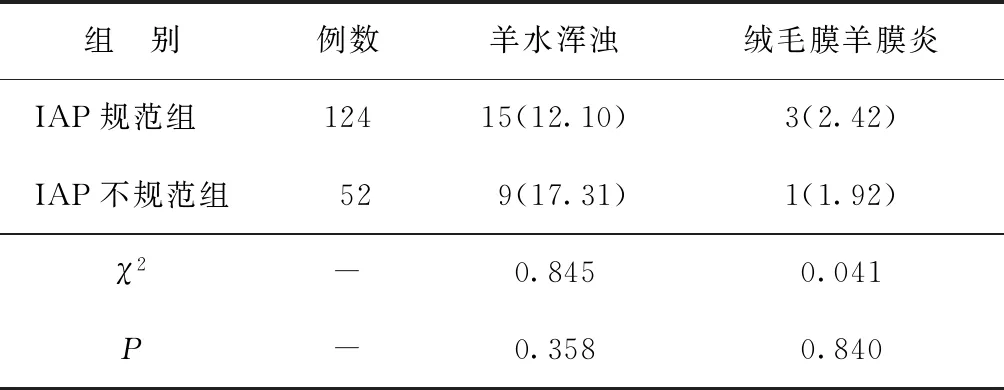
表2 两组羊水浑浊、绒毛膜羊膜炎发生率比较[n(%)]
2.2两组新生儿情况比较 IAP规范组新生儿入住NICU、新生儿肺炎、新生儿败血症的发生率,以及白细胞计数、中性粒细胞比低于IAP不规范组,差异有统计学意义(P<0.05)。见表3。
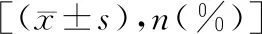
表3 两组新生儿情况比较
3 讨论
3.1GBS是定植于人体直肠与阴道区系的共生菌,正常情况下该菌群不引发疾病。但在一定条件下,生殖道、胃肠道GBS定植可转变为致病菌,诱发母婴疾病,包括孕产妇感染,如泌尿系感染、肺炎、产后子宫内膜炎等,以及早产、未足月胎膜早破、新生儿败血症、新生儿神经系统感染等,严重者导致新生儿死亡[1,6]。
3.2孕期GBS定植是新生儿出生3个月内发生感染的主要原因[7]。若未进行干预,垂直传播至新生儿占40%~70%[8],导致新生儿发生不同程度的感染。按新生儿感染发生的时间不同分为GBS-EOD与新生儿晚发型GBS(GBS late-onset disease,GBS-LOD)[3]。GBS-EOD是指出生1周内的新生儿发生GBS感染,多由合并GBS定植的产妇垂直传播所致,发生率为1%~2%[9],临床表现为新生儿败血症、新生儿肺炎及神经系统炎症等。新生儿GBS-LOD是指GBS感染发生于新生儿出生后1周至3个月,多与母婴水平传播或接触院内外其他传染源相关,多表现为菌血症,少部分也可表现为脑膜炎及软组织感染[3]。因此,孕期进行GBS筛查以及规范的IAP是降低新生儿GBS-EOD发生风险的重要措施[10]。
3.3自20世纪90年代初提出针对GBS定植孕妇进行IAP以来,直至2015年,美国的新生儿GBS-EOD发病率降低了80%[11-12]。2020年一项纳入90多个国家的研究显示,约65%的国家较好实施了GBS的筛查预防工作;其中三分之二的国家针对孕期GBS定植制定了IAP策略;大多数国家认为孕期一旦发现GBS阳性即应选择IAP以降低新生儿GBS-EOD发生率[13]。本研究单位自2018年开始对孕妇进行GBS筛查,筛查开展初期因各医疗组治疗方案不统一,导致针对合并GBS阳性孕妇的IAP不规范,难以进行同质性比较。根据2020年ACOG制定的预防新生儿GBS-EOD共识[4]建议,2021年本研究单位统一了孕期GBS筛查及治疗方案,规定在妊娠35~37周进行阴道-直肠分泌物GBS培养,若在35周前临产或出现胎膜早破则于入院时立即采集阴道-直肠分泌物进行GBS培养,其中GBS阳性孕妇在临产或发生胎膜早破后进行规范的IAP。目前,国内的大部分研究主要是针对GBS阳性患者开展IAP的情况进行研究,而对于治疗的规范性问题缺乏关注。然而,临床上规范的IAP与母婴预后密切相关。
3.4在欧美国家,孕妇GBS的定植率为8.0%~22.8%,而这一数值在亚洲国家相对较低,我国孕妇GBS的定植率为8.3%~11.8%[14]。一项针对我国孕妇GBS定植率的Meta分析结果显示,我国孕妇GBS的定植率为11.3%[15]。本研究对2 981例孕晚期孕妇进行GBS检测,其中阳性244例,GBS定植率为8.19%,与上述研究大致相同。孕妇GBS定植在一定条件下可引起孕产妇不良结局,如产褥感染、绒毛膜羊膜炎等,经过IAP干预可能降低母体不良结局的发生率。但也有研究认为绒毛膜羊膜是抵抗逆行GBS感染的强大屏障,GBS感染甚至增加了绒毛膜羊膜的细胞膜厚度[16]。因此,并非所有GBS阳性孕妇都出现早产、胎膜早破以及产褥感染等不良事件。本研究结果显示,IAP规范组羊水浑浊、绒毛膜羊膜炎发生率与IAP不规范组比较差异无统计学意义(P>0.05),这可能与样本量较少有关,后续将扩大样本进一步验证。
3.5孕妇感染GBS是新生儿发生感染性疾病的主要原因,特别是在出生后第1周。有研究发现,2015年全球估计有205 000例新生儿发生GBS-EOD,GBS感染导致的新生儿死亡人数超过了母婴传播人类免疫缺陷病毒导致的总死亡人数[7]。为了降低孕妇及新生儿GBS感染率,降低垂直传播风险,降低新生儿GBS-EOD的发生率,应规范IAP的实施。相较于口服或肌注抗生素以及使用抗生素进行阴道冲洗,静脉抗生素治疗能更有效地降低新生儿GBS-EOD的发生率和严重程度,且在胎儿娩出前抗生素用药超过4 h方能获得满意的预防效果[17-18]。因此,对于GBS阳性孕妇行规范的IAP具有重要的意义。本研究结果显示,IAP规范组新生儿入住NICU、新生儿肺炎、新生儿败血症的发生率均低于IAP不规范组,说明通过规范的IAP能够有效减少新生儿严重并发症的发生。另外,本研究单位为更好地筛查出无症状感染的新生儿,对GBS阳性孕妇所分娩新生儿在出生后24 h内均进行了炎症指标检查(血常规与C反应蛋白),结果发现IAP规范组的白细胞计数、中性粒细胞比显著低于IAP不规范组。白细胞计数与中性粒细胞比升高提示可能存在感染,结果说明经过规范IAP可降低新生儿感染发生率。同时,进一步的研究显示,23例(39.66%,23/58)无症状新生儿在出生后因炎症指标升高而转新生儿科进一步治疗,追踪这部分新生儿的预后情况,发现其中4例出现新生儿肺炎,均出现在IAP不规范组。所有发生新生儿感染者在经过抗感染治疗后顺利出院,无其他并发症出现。
综上所述,孕期GBS阳性是母婴不良预后的风险因素,而规范的IAP是目前降低其并发症发生率的最佳方案。因此,临床医师不仅需要关注孕妇GBS的筛查结果,而且更应注意IAP干预的规范性,在实现最优治疗收益的同时避免抗生素滥用。
