葡萄根际原核生物多样性及其与土壤因子的相关性研究
2022-08-10吴志浩赵鹏丽陈以杰夏运生张俊锋杞丽红张仕颖
吴志浩,赵鹏丽,陈以杰,夏运生,张俊锋,杞丽红,张仕颖
(云南农业大学资源与环境学院,云南 昆明 650201)
葡萄(Vitis viniferaL.)是世界各地广泛种植的水果,品种繁多[1-2]。其果实可作为水果鲜食或制成葡萄干、葡萄酒等[2];其籽粒可食用(如葡萄籽含片等),可提炼制成葡萄籽油,可制成化妆品(如葡萄籽洁面乳),还可入药;葡萄皮渣还可作肥料和饲料[3]。因此,葡萄具有较高经济价值。
我国葡萄种植历史悠久,拥有丰富的葡萄种质资源。云南是我国葡萄主产地之一[2],而建水、宾川、弥勒、元谋等地为云南葡萄主要产区[4],主栽品种为红提、夏黑,还有少量的阳光玫瑰、克伦森等[5]。研究表明,某些微生物会影响葡萄的生长发育和果实品质[6],例如葡萄根系土壤微生物群落就与其生长发育密切相关。一方面葡萄根系释放的分泌物将影响根际微生物群落的多样性;另一方面,根际微生物群落又影响葡萄根系对养分的吸收利用。研究表明,接种叶杆菌属(Phyllobacterium)微生物不仅能提高草莓的产量和品质,还能增加草莓果实中的维生素C含量[7],并且根际微生物在促进植物生长[8]、增强植物抗病性[9]、降解土壤污染物[10]等方面也发挥着重要作用。目前,关于葡萄种植条件的研究主要集中在土壤水分[11]、光照[12]、肥料[13-14]等方面,关于葡萄根际原核生物多样性及其对促进葡萄生长、提高葡萄抗逆性等方面的研究报道较少。因此,笔者以云南建水、宾川、弥勒和元谋主产区的葡萄根际土壤为研究对象,运用16S rRNA基因扩增子测序技术,获得葡萄根际土壤原核生物信息,进而探究云南主产区葡萄根际土壤主要原核生物种类及其与土壤因子的相关性,为深入了解葡萄根际土壤原核生物、改善葡萄根际土壤环境提供参考。
1 材料与方法
1.1 供试材料
土壤样品采自云南4个主要葡萄产区:建水(JS)、宾川(BC)、弥勒(ML)和元谋(YM),采集了27份不同种植区的葡萄根际土壤,土壤样品信息见表1。

表1 云南主产区葡萄根际土壤样品基本情况
采用5点取样法对土壤样品进行采集。在一块葡萄地内随机挑选5棵葡萄植株,在距离葡萄主干 25 cm 左右的位置,用锄头挖出0~30 cm深的葡萄根系,将附着于葡萄根际的土壤取下收集,把5棵葡萄的根际土壤混合成一个样品,用无菌袋收集后做相应标记,放入冰盒带回实验室。一部分土壤样品放置于-80℃冰箱,用于提取土壤总DNA;其余自然风干,用于测定土壤理化性质。
1.2 试验方法
1.2.1土壤因子测定土壤因子采用常规方法测定。土壤pH值参照NY/T 1377—2007中的方法测定,电导率参照HJ 802—2016中的方法测定,土壤全氮、全磷、全钾、碱解氮、有效磷、速效钾和有机质含量参照《土壤农化分析》[15]中的方法测定。
1.2.2土壤总DNA提取、PCR扩增及测序用于测定土壤原核生物的样品送至上海美吉生物医药科技有限公司提取土壤总DNA,以提取的土壤总DNA为模板,采用引物515F (5'-GTGCCAGCMGCCGCGG-3')/907R (5'-CCGTCAATTCMTTTRAGTT-3')对27个土壤样品进行16S rRNA 基因的V4-V5区PCR扩增,回收目的条带,上机测序。
1.3 数据分析
用Excel 2010和美吉云平台进行数据处理和绘图。
2 结果与分析
2.1 葡萄根际土壤的理化性质
27份葡萄根际土壤样品的理化性质如表2所示。从表2可以看出,来自建水、宾川、弥勒和元谋4个葡萄主产区的27份葡萄土壤样品理化性质存在差异。各项指标的范围分别是:酸碱度(pH值)4.80~8.30、有机质(OM)11.74~105.56 g/kg、碱解氮(AN)47.74~325.07 mg/kg、有效磷(AP)11.13~133.75 mg/kg、速效钾(AK)117.89~1227.50 mg/kg、全氮(TN)0.86~3.70 g/kg、全磷(TP)0.50~3.60 g/kg、全钾(TK)3.64~21.38 g/kg、电导率(EC)135~2 800 μs/cm。其中除BC_RSC3土壤为偏碱性土,JS_GC3、BC_OC2、BC_OC3、BC_RSC2、ML_OC1、YM_GC2和YM_GC3土壤为偏中性土,其他土壤样品均为偏酸性土。葡萄土壤样品间EC值差异较大,ML_RSC2的EC值最高达到了2 800 μs/cm,而BC_RSC3的EC值最低仅有135 μs/cm。ML_OC3的土壤有机质含量达到105.56 g/kg,JS_GC1、BC_OC2、ML_RSC1、ML_RSC2和YM_GC3的土壤中速效钾含量高,超过了1 000 mg/kg,表明部分葡萄土壤的有机质和速效钾投入量很大,可能与葡萄高投入高产出的种植模式有关。

表2 云南主产区葡萄根际土壤样品理化性质
2.2 测序信息统计和α多样性分析
通过16S rRNA测序分析,从27个样本中共获得1 270 251条有效序列,平均有效序列长度为376 bp。在所有样品中,以97%的相似度划分原核生物OUT,其数量为6 175个。土壤原核生物多样性可以通过α多样性指数表示。如表3所示,27份云南葡萄土壤样品原核生物群落多样性指数Shannon、Simpson、ACE、ChaoCoverage的变化范围分别为:3.67~6.51、0.003 7~0.108 8、781~3 140、760~3 172和97.16%~99.50%。其中,27份云南葡萄土壤样品的覆盖度(Coverage)均大于97%,表明样品测序量满足分析要求。对ACE、Chao、Shannon和Simpson值的分析发现,27个葡萄土壤样品中,ML_OC3的原核生物OTU数目和物种数最多,BC_OC1原核生物OTU数目和物种数最少。BC_RSC2原核生物群落多样性最高,ML_OC3群落分布最均匀,而JS_RSC2原核生物多样性和丰富度最低。

表3 27份葡萄土壤样品原核生物多样性指数
2.3 土壤样品的原核生物群落
图1和图2分别为门和属水平上的葡萄根际土壤原核生物群落结构。27份葡萄根际土壤具有不同的原核生物群落组成。所有葡萄根际土壤样品都含有变形菌门(Proteobacteria,11.63%~61.78%)、放线菌门(Actinobacteriota,8.73%~33.84%)、绿弯菌门(Chloroflexi,2.68%~37.98%)、酸杆菌门(Acidobacteriota,3.72%~17.80%)、厚壁菌门(Firmicutes,1.83%~30.88%)、浮游菌门(Planctomycetota,1.07%~6.93%)、拟杆菌门(Bacteroidota,0.05%~6.96%)、Gemmatimonadota(0.006%~5.81%)、粘 球 菌 门(Myxococcota,0.06%~2.83%)、Nitrospirota(0.03%~1.42%)、蓝菌门(Cyanobacteria,0.004%~2.97%)和unclassified_k__norank_d__Bacteria(0.09%~1.83%)的微生物,其中变形菌门和放线菌门是葡萄根际土壤的优势菌门。

图1 云南主产区葡萄根际土壤原核生物群落结构(门水平)
在27份葡萄根际土壤样本中,总共有68个属的相对丰度大于2%(图2)。所有土壤样本中都检测出芽孢杆菌属(Bacillus,0.89%~21.31%)、酸杆菌属(Acidibacter,0.15%~7.55%)、节杆菌属(Arthrobacter,0.03%~8.55%)、Bryobacter(0.30%~2.15%)、康奈斯氏杆菌属(Conexibacter,0.007%~6.05%)、Gaiella(0.003%~4.33%)、分枝杆菌属(Mycobacterium,0.05%~4.08%)、Nitrolancea(0.007%~2.47%)、类诺卡氏属(Nocardioides,0.03%~2.96%)、类芽胞杆菌属(Paenibacillus,0.14%~2.35%)、苯基杆菌属(Phenylobacterium,0.003%~2.28%)、Pseudaminobacter(0.003%~2.29%)、Pseudolabrys(0.11%~4.13%)、链霉菌属(Streptomyces,0.06%~3.64%)、高温放线菌属(Thermoactinomyces,0.003%~2.22%)、norank_f__67-14 (0.12%~5.05%)、norank_f__Gemmataceae(0.32%~4.36%)、norank_f__JG30-KF-CM45 (0.03%~4.50%)、norank_f__norank_o__Acidobacteriales(0.007%~5.50%)、norank_f__norank_o__Elsterales(0.08%~3.48%)、norank_f__norank_o__Gaiellales(0.19%~10.53%)、norank_f__norank_o__norank_c__Alphaproteobacteria(0.003%~2.65%)、norank_f__norank_o__ norank_c__TK10(0.04%~2.15%)、norank_f__norank_o__Vicinamibacterales(0.02%~8.42%)、norank_f__Roseiflexaceae(0.003%~2.19%)、norank_f__SC-I-84(0.01%~3.99%) 和unclassified_f__Microbacteriaceae(0.003%~3.73%)。推测这27个共有属可能是云南地区葡萄根际土壤的核心原核生物。

图2 云南主产区葡萄根际土壤原核生物群落结构(属水平)
2.4 葡萄根际土壤原核生物群落比较
采用主成分分析(PCA)比较云南主产区葡萄根际土壤原核生物群落结构的相似性,结果如图3所示,PC1和PC2轴分别解释了样本原核生物群落差异的43.03%和17.18%。其 中,ML_RSC1、BC_OC1、YM_GC1和JS_RSC2与其他样品距离较远,说明这4个样品的土壤原核生物群落结构明显区别于其他23个样品,可能受其环境因素的影响。其余23个葡萄根际土壤样品聚在一起,说明除个别样品外,大多数葡萄根际土壤样品具有相似的原核生物群落结构。
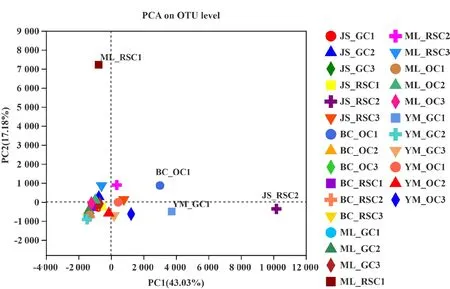
图3 云南主产区葡萄根际土壤原核生物多样性主成分分析(PCA)
2.5 土壤因子相关性研究
为了解土壤因子相关性,以属水平的原核生物群落作为物种数据,进行冗余分析,结果如图4所示,2个排序轴总共解释了27个云南葡萄根际土壤样本中原核生物群落组成的30.68%,其中第一排序轴解释了18.84%,第二排序轴解释了11.84%。基于Spearman相关性检验,分析样本中相对丰度排名前30的原核生物及其土壤因子相关性,结果如图5所示。在丰度前30的原核生物属中,有14个菌属与土壤pH值呈显著负相关(P<0.05),分别为Conexibacter、norank_f__Chitinophagaceae、Acidipila、Acidothermus、Bryobacter、norank_f__norank_o__Acidobacteriales、Mycobacterium、unclassified_f__Acetobacteraceae、Acidibacter、Pseudolabrys、norank_f__norank_o__Elsterales、norank_f__norank_o__Gaiellales、norank_f__JG30-KF-AS9和Chujaibacter;3个菌属与土壤pH值呈显著正相关(P<0.05)。仅有1个菌属与土壤有机质呈显著正相关(P<0.05)。有3个菌属与土壤碱解氮呈显著正相关(P<0.05);2个菌属与土壤碱解氮呈显著负相关(P<0.05)。有1个菌属与土壤有效磷呈显著正相关(P<0.05);4个菌属与土壤有效磷呈显著负相关(P<0.05)。有2个菌属与土壤速效钾呈显著正相关(P<0.05);3个菌属与土壤速效钾呈显著负相关(P<0.05)。有1个菌属与土壤全氮呈显著正相关(P<0.05);1个菌属与土壤全氮呈显著负相关(P<0.05)。有1个菌属与土壤全磷呈显著正相关(P<0.05);2个菌属与土壤全磷呈显著负相关(P<0.05)。有4个菌属与土壤全钾呈显著正相关(P<0.05);5个菌属与土壤全钾呈显著负相关(P<0.05)。有5个菌属与土壤EC值呈显著正相关(P<0.05),1个菌属与土壤EC值呈显著负相关(P<0.05)。在云南葡萄根际土壤中,土壤pH值(r2=0.343,P<0.05)是影响土壤原核生物群落的主要因素。
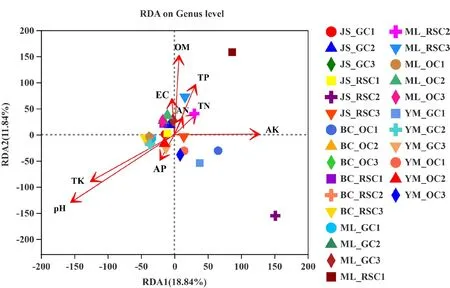
图4 云南葡萄根际土壤原核生物与土壤因子RDA分析

图5 云南地区葡萄土壤原核生物(属水平)与土壤因子Spearman相关性分析热图
3 讨 论
研究结果显示,变形菌门和放线菌门是葡萄根际土壤的优势菌门,这与高彦婷等[16]关于葡萄根际微生物群落的研究结果相似。根际微生物除了受到植物种类影响外,还会受到土壤理化性质、肥料种类和形态的影响[17-18]。通过葡萄根际原核生物及土壤因子相关性分析,发现土壤pH值显著影响葡萄根际土壤原核生物群落构成(P<0.05),这与阿根廷圣胡安省的葡萄根际土壤的结果类似[19]。因此,pH值是影响葡萄根际原核生物群落的关键因素,对维持葡萄根际土壤原核生物群落的稳定性起到关键作用。
葡萄根际核心原核生物对保证葡萄的生长具有重要作用。该研究从27份葡萄根际土壤样品中找到27个核心原核生物属,其中15个核心原核生物能明确鉴定到属。Bacillus中的一些菌株能产生脱落酸、吲哚乙酸、赤霉素[9];部分菌株对葡萄白腐病菌[20]、灰霉病菌[21]和霜霉病[22]具有抑制作用。此前有研究证明,Bacillus存在于葡萄根际土壤中[23],并且Taあner等[24]提出Bacillus是绿叶蔬菜土壤的核心微生物成员。Acidibacter能够分解蛋白质,摄取土壤酸性物质,在维持土壤生态平衡方面发挥重要作用[25]。Arthrobacter的部分菌株具有控制细菌和真菌病原体的潜力,可促进植物生长[26]。Bryobacter可与病原菌竞争,促进植物生长,Wang等[27]研究发现,该菌是促进玉米高产的关键类群。Conexibacter能够将硝酸盐还原成亚硝酸盐,可在土壤-植物系统的氮循环中发挥作用,且Conexibacter可以增强土壤微生物群落的稳定性[28]。Gaiella可通过提高养分利用率促进植物生长[29]。Mycobacterium的部分菌株可以产生IAA,还能促进种子萌发[30-31],且此前有研究表明它是水稻根际土壤的核心微生物成员[32]。Nitrolancea是一种亚硝酸盐氧化细菌,可将亚硝酸盐转化为硝酸盐,在土壤-植物系统的氮循环中发挥作用[33],另外,Nocardioides的部分物种还可代谢一系列甲硫代三嗪除草剂[34],加速除草剂的降解。Paenibacillus的一些菌株对Phaeomoniella chlamydospora(葡萄埃斯卡病的主要病原菌)具有拮抗活性[35];部分菌株具有固氮能力,可促进植物生长[36]。Phenylobacterium是一种固氮菌,能增加土壤氮素含量[37]。谭伟等[38]研究表明,使用除草剂会降低葡萄的果实品质,而Pseudaminobacter是一种广泛存在于土壤中的细菌,它的成员能够利用除草剂作为碳源[39],从而消除除草剂对葡萄果实的影响。Pseudolabrys存在于富含碳氢化合物的土壤中,已被确定为碳氢化合物的降解剂[40]。从葡萄根际土壤筛选出来的Streptomyces属部分菌株(如Streptomyces anulatusS37),具有促进葡萄藤生长以及诱导植株产生对病原体抗性的能力[41],此前Lee等[42]也提出Streptomyces属菌株是番茄根际土壤的核心微生物成员。Thermoactinomyces属的部分菌株能产生IAA促进作物生长[43]。以上相关报道,充分说明该研究确定的15个核心原核生物是葡萄生长的关键原核生物组群。此外,该研究发现还有12个属未能明确鉴定到属名,但它们却是云南主产区葡萄根际土壤中的共有属,其在葡萄生长发育过程中的作用还有待进一步研究证实。
4 结 论
该研究在云南建水、宾川、弥勒和元谋4个主要葡萄产区采集了27份葡萄根际土壤样本,运用16S rRNA基因扩增子测序技术,获得葡萄根际土壤原核生物信息,进而探究云南主产区葡萄根际土壤主要原核生物种类及其与土壤因子的相关性,结果表明:(1)云南主产区葡萄根际以变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为主要优势菌门;(2) 从葡萄根际鉴定出27个共有原核生物属,其中Bacillus、Acidibacter、Arthrobacter、Bryobacter、Conexibacter、Gaiella、Mycobacterium、Nitrolancea、Nocardioides、Paenibacillus、Phenylobacterium、Pseudaminobacter、Pseudolabrys、Streptomyces、Thermoactinomyces这15个属是已明确鉴定出属名的核心原核生物。此外,还有12个共有属未能明确鉴定出属名,但结果显示它们共存于云南主产区葡萄根际土壤中,在葡萄生长发育过程中的作用还有待进一步研究证实;(3)与土壤因子相关性分析表明,土壤pH值是显著影响葡萄根际土壤原核生物群落组成的关键因子,其对维持葡萄根际土壤原核生物群落的稳定起到关键作用。
