功能性氨基酸对猪胎盘血管生成及繁殖性能影响的研究进展
2022-08-09王舒琪罗瑾熹杜俊源谭成全
王舒琪 罗瑾熹 杜俊源 谭成全
(华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广州 510642)
长期以来,育种工作者对母猪繁殖性状的定向选择导致母猪产仔数逐步提高,但实际生产中的仔猪存活率却未得到相应的大幅改善,其原因在于影响仔猪存活率的因素众多且作用机制复杂,这意味着现代高产母猪繁殖力还有待进一步提升。造成仔猪死亡率高的2个重要因素包括:仔猪个体初生重低和仔猪初生重整齐度差。对“高产”性状的偏好,使胎猪数量超过了母猪子宫承受力,限制了胎猪获取充足的营养物质和氧气的能力,易造成其生长发育异常,因此,仔猪平均初生体重降低。而胎儿间的竞争激烈导致营养物质获得存在差异,仔猪间初生体重的整齐度差异也越来越大[1]。此外,母猪窝产仔数越多,产程越长,死胎的风险也就越大[2]。
仔猪宫内发育迟缓(intrauterine growth retardation,IUGR)等病态妊娠不仅降低了母猪生产力,而且可引发和加剧仔猪的福利问题[3]。研究发现,产生仔猪IUGR现象的最根本原因是母猪胎盘功能不全[4]。妊娠期间,胎猪生长发育的所有生理活动均需要靠胎盘维持,而胎盘功能的完整程度与胎盘血管的正常发育有着非常紧密的联系[5]。因此,从改善胎盘血管生成的角度出发,研究并探索有效的促进胎猪发育的营养方案,不仅对提升母猪生产性能现状具有重要学术价值,而且有利于减少妊娠母猪的妊娠损失,进一步促进现代生猪养殖行业的可持续发展。本文聚焦胎盘血管生成的营养调节策略,首先介绍了胎盘血管生成对胎猪发育的重要性及其关键调控因子,最后综述了功能性氨基酸促进胎盘血管生成以促进胎猪发育的可能性,以期为提高胎盘效率、降低妊娠并发症和减少IUGR现象提供参考依据和技术支持。
1 胎盘血管生成对胎猪生长发育的意义
1.1 胎盘血管生成异常易引发IUGR
IUGR是指胎儿在母体子宫内发育时未达到其遗传生长潜能,胎儿大小异常。这往往是由子宫容量不足和胎盘功能不全引起的,最终导致胎儿在围产期的发病率和死亡率较高,且仔猪初生体重偏低导致后期的生长发育受到限制[6]。猪作为多胎动物,其子宫和胎盘对胎儿的供给通常比较吃力,因此很容易发生自然IUGR[7]。随着近年来育种技术和饲养管理水平的提高,母猪产仔数越来越多,平均产仔窝重增加,但窝内初生重变异系数的上升加剧了此现象的发生[8]。IUGR仔猪随着年龄增加,其负面影响是伴随终生的,比如发病率和死亡率增高、胴体组成低劣、代谢紊乱、生长性能下降等,导致了生产和经济损失的大幅增加[7]。目前常规猪场对于IUGR猪一般是直接淘汰,暂无实际有效的应对方法。因此,降低IUGR仔猪的发生率和减小窝内初生重变异系数具有十分重要的实际生产意义。
针对仔猪初生重低等问题,以往营养学角度的研究大多从饲料原料的选择、饲料配方的调整以及饲养环境的改善等方面入手,但效果一直不太理想,其根本原因是对低初生重仔猪的发生机制缺乏足够的认识。虽然仔猪的生长发育受到各种因素的影响,但越来越多的证据表明,血管生成异常所导致的胎盘机能不全是IUGR现象和阻碍仔猪生长的重要原因[6]。
胎盘是妊娠期介于胎儿与母体间的重要器官,用于维持胎儿的正常生长发育,其功能的完善主要依靠胎盘血流量的持续增加[9]。在出生前,仔猪生长发育所需的营养物质及能量全部来源于母体,而胎盘血液循环系统是仔猪与母体进行气体交换、获得营养物质以及排泄代谢产物的唯一媒介。一旦胎盘血管生成异常,胎盘的运输能力无法与胎猪快速增长的营养物质需求保持同步,胎猪的生长发育就会受到限制,从而引发IUGR现象,导致仔猪初生重降低。以往研究表明,胎盘血管疾病与IUGR之间存在很强的相关性,IUGR仔猪的血管生成受到抑制[10]。
1.2 胎盘血管生成的过程
胎盘血管系统的建立始于2种血管新生(neovascularization)方式(图1):一种见于胚胎发育初期,由内皮前期细胞或血管母细胞形成新血管,称之为血管发生(vasculogenesis),其步骤主要包括血管母细胞和成血管细胞的诱导、原始血管的形成以及血管发生到血管生成的转变,在该阶段其主要调控因子包括血管内皮生长因子(vascular endothelial growth factor,VEGF)和成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2);另一种是指由体内既存的毛细血管或毛细血管后静脉以分支型或非分支型2种方式形成新血管的复杂过程,称之为血管生成(angiogenesis),主要步骤包括血管基底膜的降解,内皮细胞的激活、增殖和迁移以及新血管和血管网的重建[11-12]。其调控因子主要包括VEGF、胎盘生长因子(placental growth factor,PLGF)、转化生长因子-β(transforming growth factor-β,TGF-β)、促血管生成素-1(angiopoietin-1,Ang-1)和促血管生成素-2(angiopoietin-2,Ang-2)。
胎盘绒毛内血管生成是涉及到众多细胞和生物分子参与的复杂生物学事件。管腔状原始血管形成后,在绒毛滋养层细胞和Hofbauer细胞等分泌的血管形成相关生长因子作用下,妊娠早期主要生成分支型新血管,胎盘毛细血管面积扩大;在妊娠后期,分支型的生长方式逐渐被非分支型所替代,滋养细胞增殖减缓而内皮细胞增殖迅速,生成血管的速度更快,胎盘中毛细血管密度增加[13]。
2 调控胎盘血管生成的关键因子
血管生成是一个多细胞、多生物分子及众多信号通路共同参与调节的复杂过程。一般来说,胎盘血管生成由生长因子启动,通过酪氨酸激酶介导复杂的信号传导过程,其中包括特异性黏附受体和细胞外基质降解蛋白酶的表达,诱导内皮细胞发生增殖、趋化性迁移和形成血管腔,最终新毛细血管功能成熟即代表着血管生成完成[14]。胎盘血管生成的主要调控因子有VEGF、PLGF、成纤维细胞生长因子(fibroblast growth factor,FGF)、促血管生成素(angiopoietin,Ang)、TGF-β、可溶性血管内皮生长因子受体-1(soluble vascular endothelial growth factor receptor-1,sFlt-1)和可溶性内皮糖蛋白(soluble endoglin,sEng)(表1)。
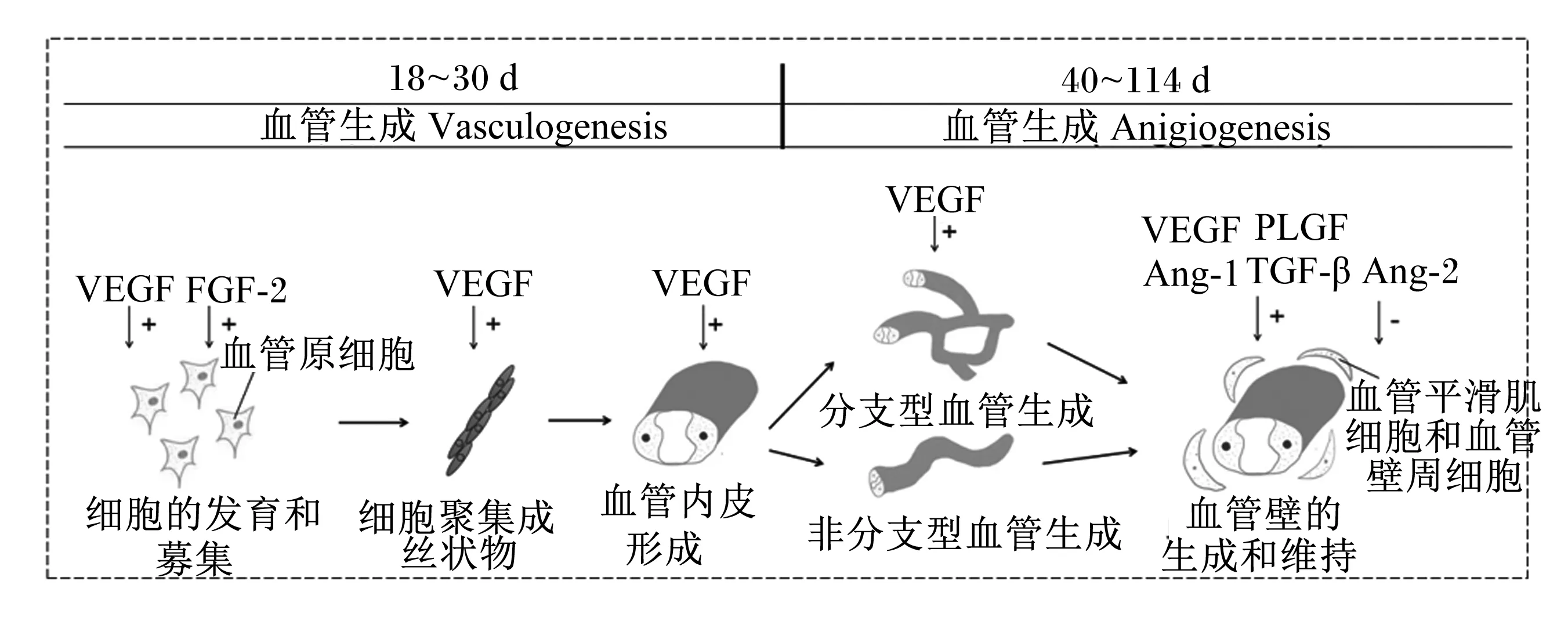
Ang-1:促血管生成素-1 angiopoietin-1;Ang-2:促血管生成素-2 angiopoietin-2;FGF-2:成纤维细胞生长因子-2 fibroblast growth factor-2;PLGF:胎盘生长因子 placental growth factor;TGF-β:转化生长因子-β transforming growth factor-β;VEGF:血管内皮生长因子 vascular endothelial growth factor。

表1 调控胎盘血管生成的关键因子及其功能
2.1 VEGF、PLGF及sFlt-1
VEGF是目前所知研究最多的一类血管生成因子,包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和PLGF,VEGF-A是该家族中最典型的成员,也是最常出现的成员[15]。
VEGF信号通路在血管生成的整个过程中起着不可替代的作用,通过结合细胞膜上的血管内皮生长因子受体-1(vascular endothelial growth factor receptor-1,Flt-1)或激酶插入结构域受体(kinase insert domain-containing receptor,KDR),进而激活一氧化氮合酶(nitric oxide synthase,NOS)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)等信号传导通路实现其生物学功能[25]。VEGF与Flt-1结合主要促进血管内皮细胞增殖;与KDR结合主要调节内皮细胞功能,能抗凋亡、加快原始血管空腔化[11]。研究发现,信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)/VEGF-A信号通路介导烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(nicotinamide adenine dinucleotide phosphate oxidas 2)可诱发活性氧(reactive oxygen species,ROS)产生,降低猪胎盘血管生成[26],而半胱胺(cysteamine,CS)可在体外逆转此抑制作用[27]。
PLGF与VEGF有53%的同源性。血管生成最初由VEGF控制,在后期,PLGF与VEGF竞争Flt-1,使血管生成转化为主要由PLGF诱导的、不同于VEGF的无分支血管生成[16]。此外,sFlt-1是Flt-1的可溶性形式,对VEGF具有高亲和力但不能转导信号。研究发现,sFlt-1能够与膜受体竞争性结合VEGF,从而对VEGF的活性起到抑制性作用,也可阻断VEGF诱导的AKT磷酸化,抑制内皮细胞迁移、侵袭、导管形成和血管生成[23]。
2.2 FGF
FGF是一种在发育、修复和代谢中具有多种功能的蛋白质。与大多数生长因子一样,FGF受体与配体的结合激活酪氨酸激酶,接着启动Ras-MAPK、PI3K-AKT、磷脂酶Cγ(PLCγ)等主要的细胞内信号通路,进一步向细胞内传递信号,最终刺激细胞生长和增殖[28]。
2.3 Ang
Ang是主要调节血管生成后期的血管稳定性的分泌型生长因子家族,该家族主要由Ang-l、Ang-2、Ang-3和Ang-4组成,Ang-1和Ang-2是其中最典型的成员,通过结合细胞膜上免疫球蛋白样EGF样域酪氨酸激酶(tyrosine kinase with immunoglobulin-like and EGF-like domains protein,Tie)传导信号。现已知Tie家族中包括Tie1和Tie2 2个成员,其中Tie2由血管内皮细胞特征性表达[18]。一般情况下,Ang-1是Tie2的激动剂;Ang-2因缺少部分结构,不能刺激Tie2的磷酸化而作为拮抗剂存在[22],或依赖VEGF的存在而参与血管生成调节[21]。
2.4 TGF-β及sEng
TGF-β在不同条件下作用于不同细胞时活性有所差异,其主要功能是调节细胞的生长和分化,诱导细胞外基质的合成及细胞凋亡[29]。TGF-β激活Smad蛋白信号通路对血管生成有双重作用:低剂量TGF-β1通过活化素受体样激酶1(activin receptor-like kinase,ALK1)激活Smad1/5,激活内皮细胞的增殖和迁移而促进血管生成;高剂量TGF-β1通过活化素受体样激酶5(activin receptor-like kinase 5,ALK5)激活Smad2/3,则减少内皮细胞侵袭并增加细胞外基质蛋白表达,促进血管成熟[19]。
sEng是内皮糖蛋白(endoglin,Eng)的可溶性形式。Eng是TGF-β1和TGF-β3的受体复合物的成分之一,介导TGF-β与受体的结合。sEng可抑制TGF-β1与其受体的结合,并阻断其下游信号,引起血管生成障碍。同时,sEng介导的TGF-β/Smad2/3信号通路也能抑制内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)依赖性血管舒张[24]。sEng与sFlt-1具有协同作用,能够抑制血管生成[30]。
3 功能性氨基酸对胎盘血管生成的影响
近年来,研究氨基酸营养对母猪繁殖性能的影响时发现,部分功能性氨基酸及其在代谢过程中生成的一些活性物质,对胎盘血管生成具有重要的调控作用[31]。目前在胎盘血管生成调控方面,研究较多的几种功能性氨基酸主要包括精氨酸(arginine,Arg)家族、亮氨酸和含硫氨基酸。
3.1 精氨酸家族
精氨酸家族包括精氨酸、谷氨酸、脯氨酸、瓜氨酸和鸟氨酸,它们在大多哺乳动物体内可经过复杂的代谢过程相互转换(图2)。除鸟氨酸和瓜氨酸外,这些氨基酸通常在食物蛋白质中含量丰富[32]。其中,精氨酸是目前动物营养研究中成果最多的一个功能性氨基酸。有研究表明,在妊娠母猪饲粮中添加精氨酸可以增加活产仔数和仔猪总初生重,且不会降低仔猪的平均初生重[33-34]。
这可能是通过调控胎盘中PLGF和VEGF等基因表达水平,促进胎盘血管生成和改善胎盘功能的结果,从而达到促进胎猪生长以改善母猪繁殖性能的目的[35]。

mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;AGAT:精氨酸甘氨酸转氨酶 arginine glycine transaminase;BH4:四氢生物蝶呤 tetrahydrobiopterin;GTP:鸟苷三磷酸 guanosine triphosphate;GTP-CH-1:Ⅰ型三磷酸鸟苷环化水解酶 type Ⅰ guanosine triphosphate cyclohydrolase;OAT:鸟氨酸转氨酶 ornithine transaminase;ODC:鸟氨酸脱羧酶 ornithine decarboxylase;NO:一氧化氮 nitric oxide;+:促进作用 promoting effect.
3.1.1 精氨酸与胎盘血管生成
精氨酸是妊娠母猪的必需氨基酸[37],其不仅是蛋白质的组成部分,还是许多生物活性分子的前体,包括一氧化氮(nitric oxide,NO)、鸟氨酸、多胺(腐胺、亚精胺和精胺)、肌酸和胍丁胺[38](图2)。有研究发现,在妊娠母猪饲粮中补充精氨酸,促进了胎盘发育和繁殖性能,提高了活产仔数[33]。
精氨酸及其代谢产物影响胎盘血管生成而促进胎猪发育的作用途径包括以下2条:1)哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞生长、增殖、凋亡和自噬的中枢调控因子,mTOR通路在调节细胞生长、细胞周期进程和蛋白质合成等过程中发挥重要作用,并可以在转录和翻译水平调节VEGF等促血管生成因子的产生[39-40]。精氨酸能够通过激活mTOR-核糖体蛋白S6激酶(RPS6K)-核糖体蛋白S6(RPS6)-真核翻译起始因子4E结合蛋白1(EIF4EBP1)信号转导通路,刺激猪滋养外胚层细胞增殖和迁移,促进胎盘血管的生成[41]。2)精氨酸是动物体内NO合成的唯一前体物质,可在NOS的作用下生成NO和瓜氨酸。妊娠期间,NO是胎盘血管生成的关键调节因子:一方面,NO是体内主要的内源性舒张因子,在调节胎盘-胎儿血流以及营养物质和氧气从母体向胎儿的转移过程中起重要作用[42];另一方面,NO还可以协助血管生成因子(如VEGF)调节胎盘血管生成[43]。
值得一提的是,在一般情况下,精氨酸可以在精氨酸酶作用下产生鸟氨酸,进而合成关键调控因子多胺[38]。多胺是胎盘生长和胚胎发育不可或缺的活性物质。例如,二氟甲基鸟氨酸(difluoromethylornithine,DFMO)阻断多胺生成后,水貂的滋养层细胞增殖受阻,降低了胚胎植入率[44]。精氨酸间接调节核内基因的转录和表达,从而参与调控细胞的增殖和分化等过程[45]。
但是,胎盘为了在胚胎发育过程中最大限度地将精氨酸从母体供应给胎猪,导致胎盘内缺乏精氨酸酶活性,因此,无法通过精氨酸合成鸟氨酸的途径来合成多胺。而在整个妊娠期间,脯氨酸氧化酶、鸟氨酸转氨酶(ornithine aminotransferase,OAT)和鸟氨酸脱羧酶(ornithine decarboxylase,ODC)均在猪胎盘中存在活性,且这3种酶的活性在妊娠20~40 d分别增加了132%、148%和240%,随后下降,与脯氨酸含量的变化进程高度一致[46]。所以在猪胎盘组织细胞中,由脯氨酸在脯氨酸氧化酶和鸟氨酸转氨酶催化下合成鸟氨酸,然后在鸟氨酸脱羧酶催化下形成多胺[47]。该合成途径的活性在妊娠早期胎盘迅速生长时最高,具有治疗宫内生长受限的潜力[48]。研究表明,多胺通过调控细胞的基因表达,具有促进血管生成的作用[4]。脯氨酸是猪胎盘中合成多胺的主要含氮底物[49],在妊娠期间其胎盘中含量是动态变化的。在妊娠20~40 d增加51%,在妊娠40~60 d保持不变,之后下降,且脯氨酸合成胎盘多胺的速率在该妊娠阶段同样达到最大值,增加了150%~160%[46]。也有研究指出,在妊娠25~90 d,脯氨酸含量有显著增长[36]。多种研究表明,胎盘发育和胎儿生长迟缓均与妊娠母畜的胎盘脯氨酸转运减少有关。补充脯氨酸的小鼠胎盘中VEGF、血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、NOS2和NOS3的mRNA水平增加,这表明补充脯氨酸对胎盘血管发育有正面促进作用[50]。现已有研究发现,通过饲粮添加脯氨酸可改变妊娠母猪及其后代的营养代谢状况,从而影响母猪繁殖性能[51]。
3.1.2 精氨酸在母猪妊娠期的应用
动物体内代谢所需的精氨酸可以通过饲粮供给、体内蛋白质的周转代谢以及从头合成这3条途径获得[38],胎猪生长发育所需的精氨酸需要母体供应。在生产中,为了防止妊娠母猪体况过肥和哺乳期食欲低下,在妊娠期间往往采用限制饲喂的方式,易造成母猪精氨酸不足甚至营养不良,进而导致NO和多胺的胎盘合成受损,引发IUGR[52]。这时,可采取在妊娠母猪饲粮中合理补充精氨酸的方式,促进胎盘血管生成,改善母猪繁殖性能和胎猪发育情况[53]。
为满足胎猪正常生长发育的需要,母猪妊娠0~70 d需精氨酸6.09 g/d,妊娠70 d至分娩需14.93 g/d[54],如果采用常规的玉米-豆粕型饲粮,其中能够进入血液循环的精氨酸含量不足以满足妊娠母猪的需要。因此,饲喂妊娠母猪时需在常规饲粮中额外补充精氨酸。大量试验结果(表2)证明:1)妊娠早期在基础饲粮中补充精氨酸有利于母猪繁殖性能的改善[55-56]。2)精氨酸的添加剂量和时间都会影响其作用效果,甚至产生反作用,在实际生产条件中,妊娠22~114 d添加1%精氨酸具有显著效果[33,57]。这可能与胎盘血管生成过程、氨基酸之间的拮抗作用以及氨的毒性有关,为避免碱性氨基酸之间的不平衡,猪的精氨酸补充水平不应超过2.0%[58]。3)N-氨甲酰谷氨酸是精氨酸内源合成限速酶激活剂N-乙酰谷氨酸的代谢稳定类似物,能够促进内源性精氨酸的生成,在生产实践中可作为精氨酸替代物使用[59]。

表2 饲粮中补充精氨酸对胎盘血管生成和母猪繁殖性能的影响
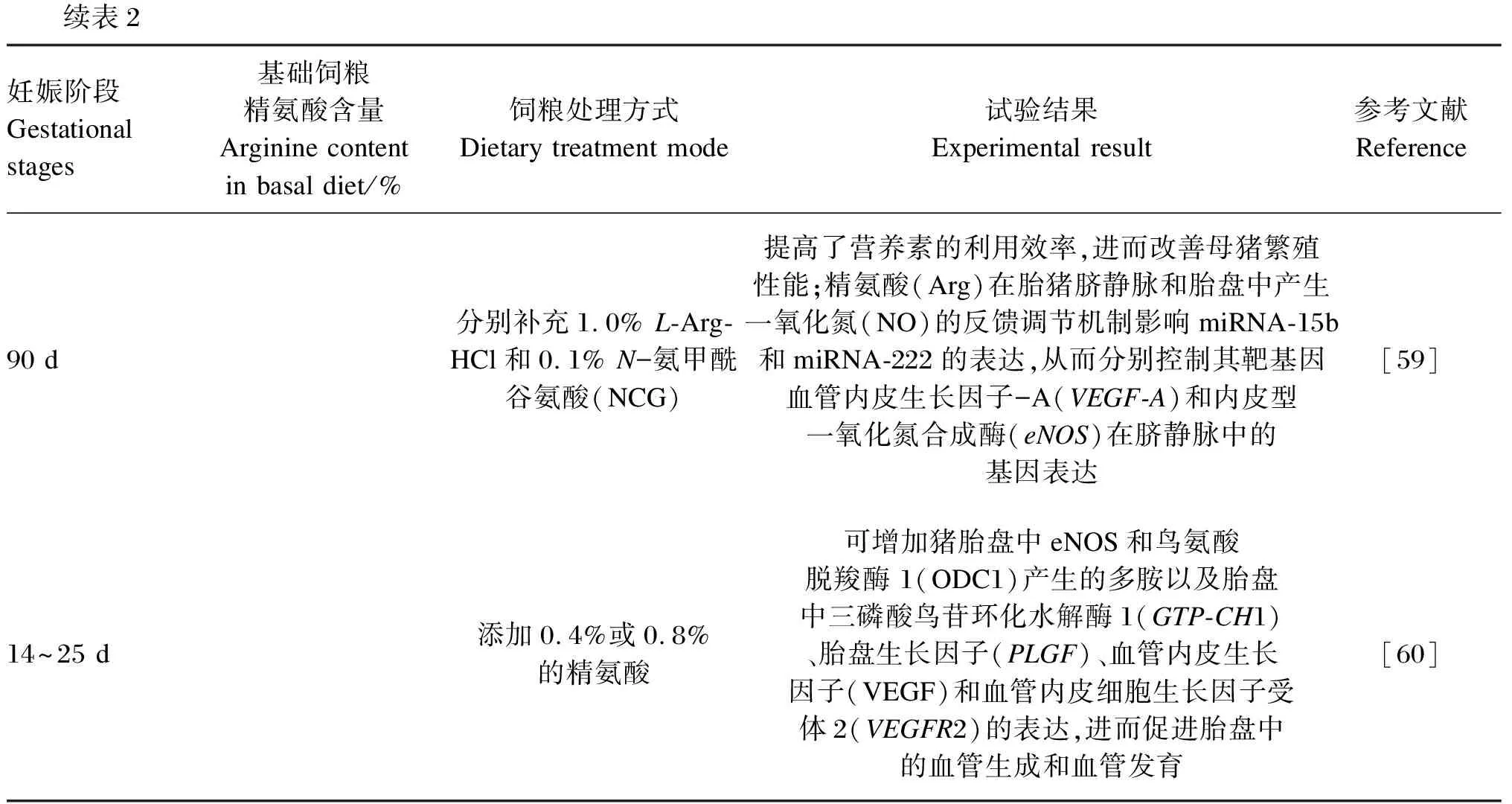
续表2妊娠阶段Gestational stages基础饲粮精氨酸含量Arginine content in basal diet/%饲粮处理方式Dietary treatment mode试验结果Experimental result参考文献Reference90 d分别补充1.0% L-Arg-HCl和0.1% N-氨甲酰谷氨酸(NCG)提高了营养素的利用效率,进而改善母猪繁殖性能;精氨酸(Arg)在胎猪脐静脉和胎盘中产生一氧化氮(NO)的反馈调节机制影响miRNA-15b和miRNA-222的表达,从而分别控制其靶基因血管内皮生长因子-A(VEGF-A)和内皮型一氧化氮合成酶(eNOS)在脐静脉中的基因表达[59]14~25 d添加0.4%或0.8%的精氨酸可增加猪胎盘中eNOS和鸟氨酸脱羧酶 1(ODC1)产生的多胺以及胎盘中三磷酸鸟苷环化水解酶1(GTP-CH1)、胎盘生长因子(PLGF)、血管内皮生长因子(VEGF)和血管内皮细胞生长因子受体2(VEGFR2)的表达,进而促进胎盘中的血管生成和血管发育[60]
综上所述,在妊娠母猪饲粮中补充精氨酸可以促进胎盘血管生成,提高母猪繁殖性能。但是由于母猪对精氨酸需要量存在多种变化情况,所以还需要做更多的研究以确定妊娠期间不同阶段的最佳精氨酸需要量。
3.2 亮氨酸
亮氨酸属于支链氨基酸之一,不能在哺乳动物体内合成,只能在植物和微生物中合成,可以作为调节因子,调节胎盘的生长发育,提高母猪的繁殖性能[61]。
3.2.1 亮氨酸与胎盘血管生成
目前关于亮氨酸的营养研究大多集中在调控蛋白质代谢方面,因而缺少对胎盘血管生成影响的研究报道。尽管如此,仍有研究称平衡支链氨基酸等其他氨基酸时,提高亮氨酸的摄入量对母猪繁殖有着重要的影响[61]。亮氨酸可能通过以下2条途径促进胎盘血管生成,进而促进胎猪生长发育:1)亮氨酸可以发挥和精氨酸的协同作用,激活mTOR信号通路以刺激滋养外胚层细胞的肥大、增生和迁移,促进绵羊胎盘血管生成[62]。近年来许多研究表明mTOR信号通路可上调L型氨基酸转运载体1(L-type amino acid transporter 1,LAT1)、抗原4F2重链(4F2 heavy chain,4F2hc)及氨基酸转运系统A的表达下调,与母体营养不良和胎儿生长受限有关[63-64]。亮氨酸可以通过增强以胰岛素样生长因子2表达水平为标志的胎盘转运机能,促进营养不良的大鼠胚胎发育[65]。2)亮氨酸可能通过促进子宫雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)的表达,提高子宫对雌激素和孕激素的应答,间接影响血管生成因子对胎盘血管生成的调控作用,促进子宫分化,从而促进胎猪发育。亮氨酸可提高母鼠细胞ER和PR的表达[65],而甾体类激素(雌激素、孕激素和雄激素)在生理和病理条件下均能参与调节胎盘血管生成[66],且这种调节作用不能没有受体的参与。在雌性小鼠模型中,雌激素能增强正常个体的FGF诱导的血管生成,但不能诱导ER缺失的小鼠子宫血管生成[67]。由于缺少相关猪的试验的报道,故尚不明确亮氨酸是否也以此方式参与猪胎盘血管生成调控。
3.2.2 亮氨酸在母猪妊娠期中的应用
亮氨酸影响母鼠胎盘功能,主要体现在提高胎盘转运能力和促进胎盘血管生成以改善IUGR的发生率[65]。根据妊娠后期胎猪快速生长发育需要大量蛋白质沉积的生理特性,以及亮氨酸调控体内蛋白质合成的生物学功能特点,王超先[68]在妊娠后期母猪基础饲粮中添加不同浓度(0、0.4%、0.8%和1.2%)的亮氨酸,发现添加0.8%亮氨酸能显著提高新生仔猪初生个体重,而添加0.4%、0.8%和1.2%的亮氨酸对窝产仔数、窝活产仔数、健仔数、弱仔数和初生窝重无显著影响。有研究指出,是亮氨酸的代谢产物,而非亮氨酸本身促进了蛋白质的合成代谢[69]。β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate,HMB)是亮氨酸的下游代谢产物,事实证明母猪妊娠后期基础饲粮中添加适量HMB也能发挥与亮氨酸相似的促进胎猪发育的作用,使仔猪初生个体重显著提高[70];围产期基础饲粮中添加0.2%的HMB可降低IUGR发生率[71]。
关于亮氨酸在妊娠后期及哺乳期促进仔猪蛋白质沉积的作用机理已得到广泛研究,但关于亮氨酸对于胎盘血管生成及胎猪发育的影响尚属空白,需更加深入的研究来揭示它的作用机理。
3.3 含硫氨基酸
含硫氨基酸对猪的摄食、生长、免疫等方面都有着重要的作用,可以影响机体营养代谢。除了在蛋白质合成中发挥作用外,还可以在疾病预防和改善生产性能中发挥关键作用,主要包括蛋氨酸、胱氨酸和半胱氨酸[72]。
3.3.1 蛋氨酸与胎盘血管生成及应用
蛋氨酸作为猪的第二限制性氨基酸,对猪的生长发育起着至关重要的作用,而且母猪妊娠后期氨基酸营养需要量明显高于妊娠前期[54],故提高饲粮蛋氨酸水平对促进胎猪发育具有较大的影响。
在动物体内,蛋氨酸直接或间接地参与多项生理活动。除了参与合成蛋白质外,还可以经过转甲基代谢、氨丙基转移、转硫基代谢和再甲基代谢生成甲基供体S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)、同型半胱氨酸(homocysteine,Hcy)以及具有抗氧化功能的谷胱甘肽等产物,为体内的甲基化修饰提供甲基(如DNA和RNA)和发挥抗氧化作用[73]。已有研究发现,提高妊娠母猪饲粮中蛋氨酸水平能够提高仔猪初生窝重和仔猪初生个体重[74]。对此的深入研究表明,饲粮中添加蛋氨酸对胎猪发育的促进作用,可能是蛋氨酸参与调控猪胎盘血管生成的结果(图3)。蛋氨酸能够通过提高猪血管内皮细胞VEGF和基质金属蛋白酶9表达水平,促进内皮细胞迁移并形成血管[75]。此外,蛋氨酸的代谢产物已被证明参与了调控血管生成过程:1)蛋氨酸的中间代谢产物SAM影响细胞增殖,一方面在细胞水平,它作为体内重要的甲基供体,影响核糖体的生物发生[76];另一方面SAM可以合成多胺,提高小鼠胚胎植入率[77]。2)妊娠期母体对Hcy损伤敏感性增强,蛋氨酸过量会造成Hcy累积,引发同型半胱氨酸血症以及一系列不良妊娠反应[78]。这可能是由于高水平Hcy会减少内皮细胞组织纤溶酶激动剂的分泌,降低纤溶系统的活性,进而抑制血管生成,增加微血管纤维蛋白积聚和血栓形成[79]。
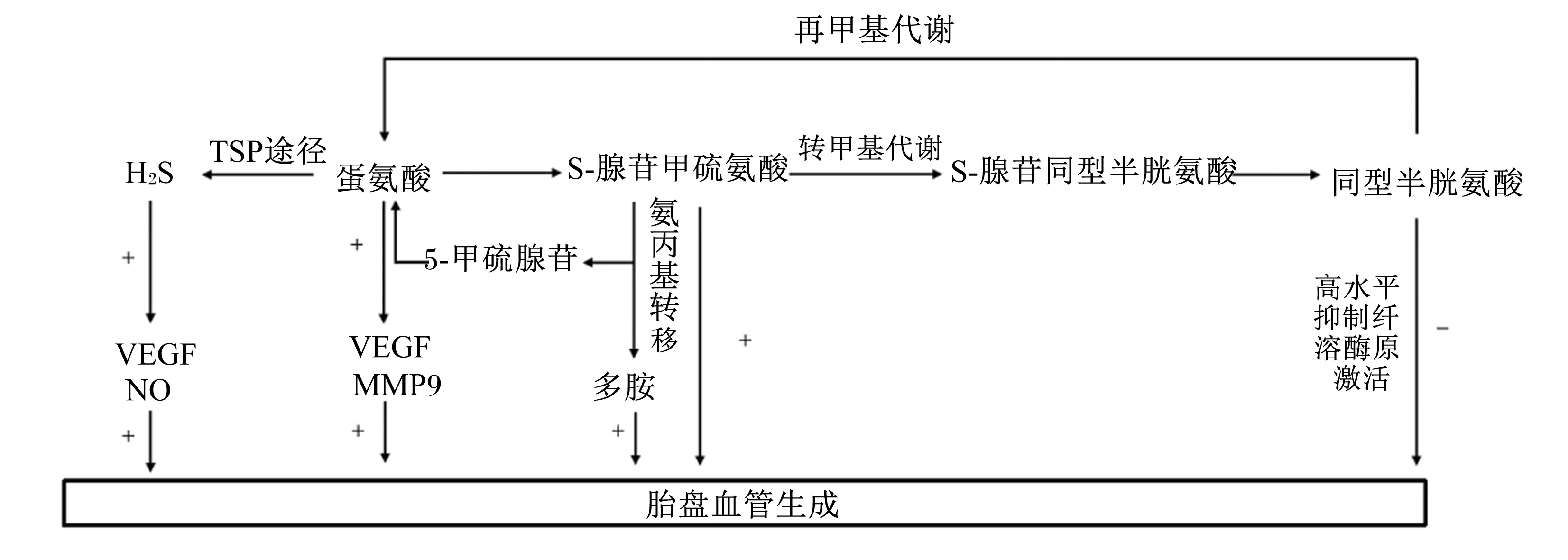
H2S:硫化氢 hydrogen sulfide;VEGF:血管内皮生长因子 vascular endothelial growth factor;MMP9:基质金属蛋白酶9 matrix metallopeptidase 9;TSP途径:转硫途径 transsulfuration pathway;+:促进作用 promoting effect;-:抑制作用 inhibiting effect。
畜牧生产中常用的玉米-豆粕型饲粮往往蛋氨酸含量不足,这与妊娠母猪的氨基酸需要量因供给胚胎发育而大幅增加相矛盾。通过在基础饲粮中额外补充蛋氨酸,随着蛋氨酸与赖氨酸比值的增加提高了后备母猪的生长和繁殖性能,且蛋氨酸与赖氨酸比值为38.2%时的后备母猪繁殖性能表现最佳[74]。有研究表明,妊娠母猪饲粮的蛋氨酸与赖氨酸比值与初生体重和胎盘血管生成呈二次曲线关系,其中蛋氨酸与赖氨酸比值为0.37%时有助于发挥高繁殖力母猪的最佳性能[82]。目前,合成的蛋氨酸添加剂包括DL-蛋氨酸羟基类似物和DL-蛋氨酸二肽等,且已被广泛使用,但饲粮中添加不同来源的蛋氨酸会影响其他氨基酸的肠道吸收和全身代谢[83],而且在猪不同细胞系中的代谢特征以及对细胞功能的影响也会有所差异[73]。因此,在生产上应当选择哪种蛋氨酸源较适宜和最佳添加的比例等实际问题还有待解决。
3.3.2 半胱氨酸与胎盘血管生成及应用
近年来,越来越多证据表明妊娠母猪的氧化应激可能导致死胎等不良妊娠结果[84]。CS是谷胱甘肽(glutathione,GSH)的前体,具有抗氧化的功能。而作为其下游产物之一的L-半胱氨酸能提高母体胎盘的抗氧化能力,增加PLGF的含量和促进血管生成,能有效降低母胎界面的炎症反应[85]。CS可通过代谢半胱氨酸抑制核苷酸结合寡聚化结构域样受体,从而改善母猪母体-胎盘界面的氧化还原状态。在妊娠后期提供CS可改善母猪的妊娠结果,包括初生体重和死产。对于生产低初生重仔猪的母猪,饲喂100 mg/kg CS不仅能显著增加其胎盘血管密度,还使胎盘中的GSH含量提高,减少ROS的形成,保护胚胎免受氧化应激。目前试验证明,氧化应激通过STAT3信号通路失活来抑制猪血管内皮细胞(porcine vascular endothelial cells,PVECs)的增殖和迁移。CS可通过STAT3信号通路调节过氧化氢诱导的PVECs氧化应激的修复,因此CS积极作用的潜在机制可能与PVECs中STAT3的激活有关[27]。据此前报道,半胱氨酸可合成N-乙酰半胱氨酸,后者不仅可与ROS作用并清除自由基,提高NO含量,有利于胎盘血管的合成,还可合成GSH进而增强抗氧化能力[42,86]。
饲粮中添加CS应注意剂量,使用低剂量的CS可促进半胱氨酸进入细胞进一步合成GSH,并影响细胞的氧化还原稳态。而高剂量的CS则会使氧化应激和IUGR的风险增加,对此可能的解释是:当使用过高剂量的CS时,在过渡金属存在下,CS氧化生成过氧化氢分子,从而引起氧化应激[87]。因此,与较高剂量相比,最小剂量(体内和体外剂量分别为100 mg/kg和500 μmol/L)为合适的补充剂量,能有效缓解胎盘的氧化应激,增强血管生成,提高母猪繁殖效率[27]。
4 小 结
胎盘血管网络的形成是保障胎猪正常生长发育的重要因素,众多研究表明饲粮中添加功能性氨基酸可以通过关键代谢途径调控胎盘血管生成,从而达到促进胎猪发育的目的。目前已知能够促进胎盘血管生成的功能性氨基酸有精氨酸家族(精氨酸和脯氨酸)、亮氨酸和含硫氨基酸(蛋氨酸和半胱氨酸),但尚存在许多问题有待解决,比如相关的功能性氨基酸在母猪体内的作用机制及其在生产实际中的添加效果尚不明确,还需要做更多、更加深入的研究工作,来推动功能性氨基酸在母猪生产中的开发利用。
